Бактериофаги против резистентной микобактерии
Микобактериальные инфекции на протяжении веков являются серьезной медицинской проблемой, которая сильно осложняется развитием лекарственной устойчивости как у микобактерий туберкулеза, так и у нетуберкулезных микобактерий. Для пациентов с муковисцидозом это зачастую становится решающим аспектом в выборе терапии: часто требуется трансплантация легких, и в то же время данная группа лиц особенно сильно подвержена инфицированию устойчивыми микобактериями, а это существенно повышает летальность.
На данный момент надежды по решению данной проблемы возложены на бактериофаги. В начале мая 2019 года были опубликованы результаты применения смеси, состоящей из 3 типов бактериофагов, на пациенте с диссеминированной инфекцией Mycobacterium abscessus, одним из представителей нетуберкулезных микобактерий.
У пациента 15 лет с муковисцидозом и сопутствующими заболеваниями, такими как недостаточность поджелудочной железы, инсулинозависимый сахарный диабет, остеопороз и поражение печени, была хроническая инфекция Pseudomonas aeruginosa и M. abscessus, в связи с чем он получал антимикобактериальную терапию в течение 8 лет до трансплантации легких.
За 6 месяцев до постановки в лист ожидания пациент принимал Лумакафтор/Ивакафтор. Однако объем форсированного выдоха за 1 секунду упал до 0,63 литра с появлением признаков гиперкапнии и увеличением диаметра легочной артерии на КТ. В связи с этим пациент был направлен на двустороннюю трансплантацию легких, которая прошла без осложнений. Пациенту были назначены иммуносупрессивные препараты и комбинированные антибиотики внутривенно. Но тяжелые побочные эффекты в виде тошноты, анорексии, диареи и нарушения электролитного баланса потребовали прекращения внутривенного введения антибиотиков и перехода на парентеральное питание.
В течение первой недели после отмены антибиотиков появилось покраснение послеоперационной раны, а M. abscessus стала высеваться из мокроты. Врачам пришлось вернуться к антибиотикотерапии, добавив клофазимин и бедаквилин (рисунок 1). Кроме того, при проведении ПЭТ КТ при помощи фтордезоксиглюкозы в области грудины был обнаружен очаг накопления 3,5 см × 4 см с вовлечением окружающих мягких тканей. В связи с этим введение микофенолата мофетила было прекращено. Его заменили на ритуксимаб, предполагая посттрансплантационное лимфопролиферативное заболевание. Однако очаг увеличился до 6,8 см × 4 см, а на коже появились два участка воспаления, которое после исследования биоптата было определено как гранулематозное. Пациент был выписан через 7 месяцев с диагнозом «диссеминированная микобактериальная инфекция», по поводу которого продолжал получать антимикробную терапию. Но через 8 недель количество очагов воспаления на коже достигло 20, а в области послеоперационной раны имелись признаки несостоятельности швов. Было принято решение об использовании бактериофагов.
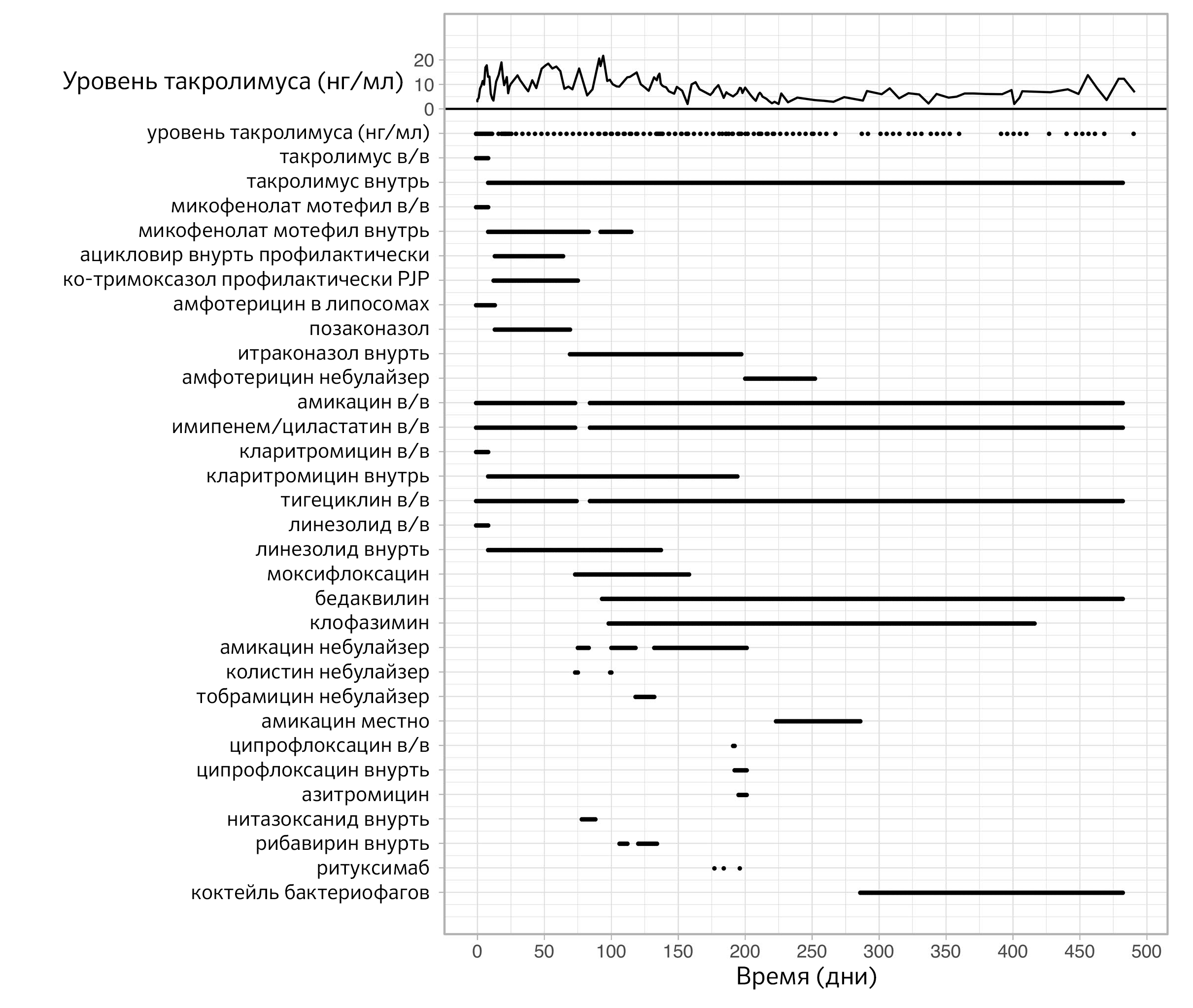
Рисунок 1. Сроки введения препаратов. График приема антибиотиков, иммуносупрессивных препаратов и бактериофагов.
Наверху — уровни концентрации иммуносупрессивного препарата Tacrolimus
Смесь содержала более 10 000 фагов, выделенных с использованием Mycobacterium smegmatis студентами в программе Science Education Alliance Phage Hunters Advancing Genomics and Evolutionary Science (SEA-PHAGES). Геном 1800 фагов был известен. Скрининг показал, что бактериофаг Muddy эффективен против M. abscessus. Вторым фагом стал ZoeJ, который изначально обладал слабой способностью к уничтожению бактерий. Однако после использования нового метода генной инженерии Bacteriophage Recombineering of Electroporated DNA (BRED) был удален ген-супрессор (45), что позволило увеличить эффективность. Третьим фагом оказался BPs и его «улучшенная копия» (BPsΔ33HTH), которые не обладали достаточной эффективностью по отношению к M. abscessus, но выделенные мутантные штаммы (HRM1 и HRM10) значительно превосходили оригиналы.
Сперва данный «коктейль» был введен в рану на груди, а через 24 часа бактериофаг начали вводить внутривенно каждые 12 часов на протяжении 32 недель в дозировке не менее 109 бляшкообразующих единиц (БОЕ) каждого фага. В течение первых двух дней пациент жаловался на потливость и покраснение кожи, но физикальных признаков лихорадки не было. Через 9 дней больной был выписан, терапия бактериофагами продолжалась амбулаторно. В течение 6 месяцев состояние больного стало улучшаться: послеоперационные раны зажили, уменьшилось число кожных проявлений, улучшились функции легких и печени. Повторное ПЭТ КТ-сканирование через 6 недель после лечения фагами показало уменьшение «горячих» очагов (рисунок 2).
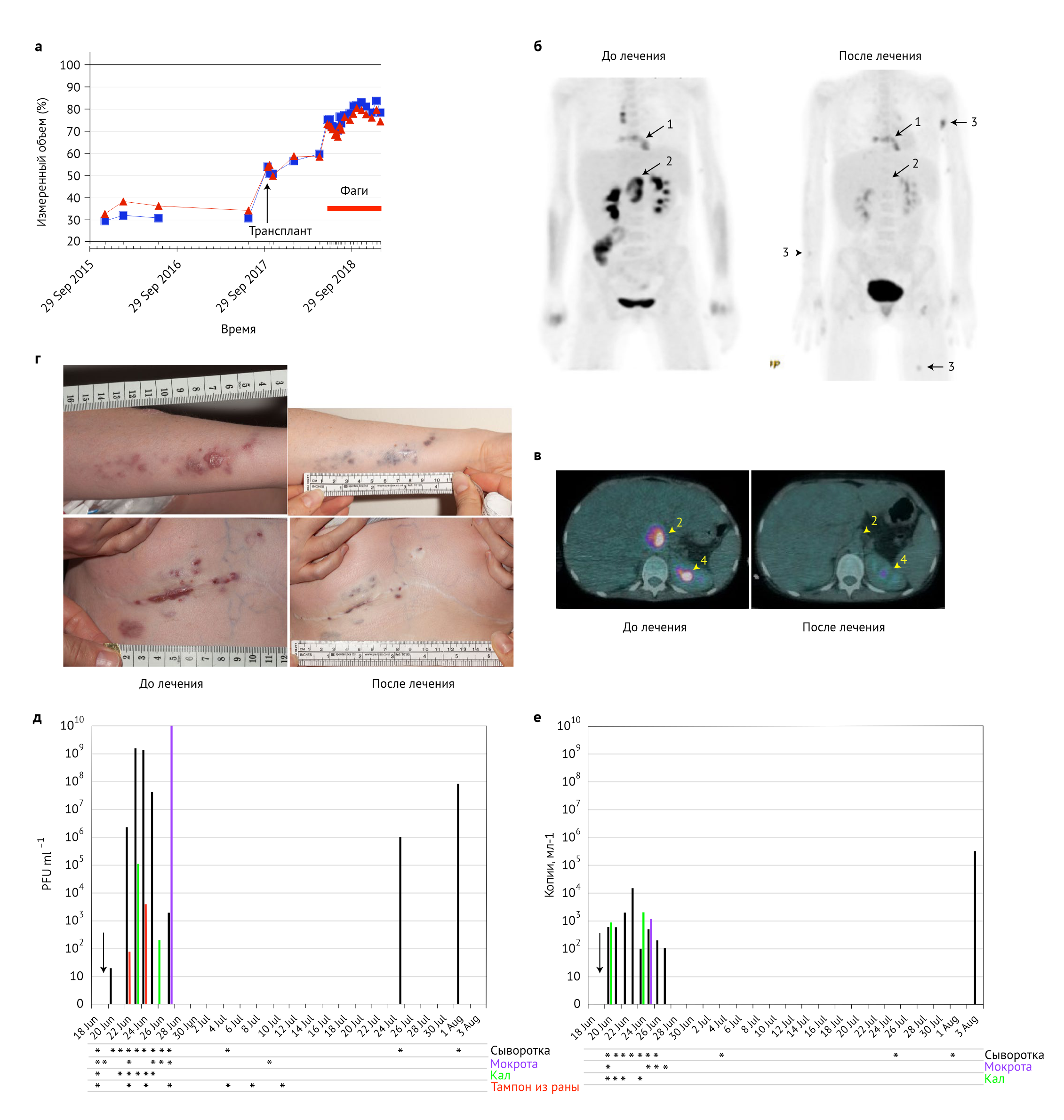
Рисунок 2. Состояние пациента до и после лечения
а: легочная функция ОФВ1 (синяя) и ФЖЕЛ (красная)
б, в: ПЭТ КТ во фронтальном (б) и поперечном сечении (в) за 12 недель до и через 6 недель после фаговой терапии. Стрелки показывают (1) область грудины и окружающие мягкие ткани, (2) лимфатические узлы в области воротной вены, и (3) узелки кожи. Стрелка (4) указывает на нормальную почечную экскрецию
г: левая рука и рана на груди до и через 6 месяцев после лечения
д, е: титры фагов, оцениваемые через БОЕ (д) или ПЦР (е) после введения фага (вертикальная стрелка). Сыворотка крови (черные полосы), мокрота (фиолетовая), кал (зеленая) и мазок из раны (красная) с указанием даты.
M. abscessus не выделялся из сыворотки крови или мокроты после начала лечения фагами, хотя бактерии высевались из мазков с воспалительных гранулем кожи в течение 1, 3, 4 и 5 месяцев. Сыворотка крови не показала признаков нейтрализации фагов, хотя наблюдался слабый ответ антител на фаговые белки в виде повышения уровня IFNy, IL-6 и IL-10 через 16 дней лечения, а также TNF, IL-6 и IL-10 через 1 месяц лечения и IL-6 через 3 и 4 месяца.
Фаги выявлялись в сыворотке крови через 1 сутки после начала лечения и достигали титров, превышающих 109 БОЕ на 1 мл. Образцы мокроты представляли собой преимущественно слюну, в них не обнаруживалась литическая активность, хотя в образце гнойной мокроты, собранном через 9 дней после начала лечения, был высокий титр фагов (1010 БОЕ на мл). Более низкие концентрации фагов были обнаружены в фекалиях через 4 и 6 дней после обработки и в раневых тампонах через 3 и 5 дней после обработки.
Конечно, нельзя исключать влияние принимаемых пациентом препаратов, но улучшение клинической картины после начала фаговой терапии внушает оптимизм.
Источник: Dedrick R. M. et al. Engineered bacteriophages for treatment of a patient with a disseminated drug-resistant Mycobacterium abscessus // Nature medicine. – 2019. – Т. 25. – №. 5. – С. 730.
