Эндометрий как биосенсор при рецидивирующей имплантационной недостаточности

Несмотря на впечатляющие достижения в области вспомогательных репродуктивных технологий, появление более эффективных методов отбора эмбрионов и использование криохранилищ, у части пациенток наблюдаются серии неудавшихся ЭКО. При этом параметры, определяющие успех процедуры, такие как количество и качество ооцитов и эмбрионов, могли быть весьма обнадеживающими.
Закономерно предположить, что в развитии рецидивирующей имплантационной недостаточности (РИН) играет роль функциональное состояние эндометрия.
РИН подразумевает отсутствие имплантации после трех и более переносов высококачественных эмбрионов или после размещения 10 или более эмбрионов в нескольких переносах, четкие критерии обсуждаются. Кафлен с соавт. определяют РИН как отсутствие наступления клинической беременности после 4 переносов эмбрионов хорошего качества (свежих или замороженных), по крайней мере в течение трех циклов переноса у женщин в возрасте до 40 лет [1]. Оценка качества эмбрионов основана на их морфологии. Наиболее часто используют бластоцисты (5 день развития), в которых определяют три параметра: размер полости бластоцисты, величину и компактность внутренней клеточной массы, количество и плотность расположения клеток трофоэктодермы. Клиническая беременность согласно определению Американского общества репродуктивной медицины (ASRM) считается развившейся после подтверждения с помощью ультразвукового (с обнаружением желточного мешка) или гистопатологического исследования [2].
Отдельно выделяют биохимическую беременность. Согласно Международному комитету мониторинга вспомогательных репродуктивных технологий и Всемирной организации здравоохранения, она представлена изолированным повышением ХГЧ в крови или моче без наступления последующих клинических признаков беременности [3]. Коулам определяет биохимическую беременность как наличие двух или более повышений значения ХГЧ, через 2 недели после фиксирования которых при трансвагинальном УЗИ не обнаруживается никаких признаков желточного мешка.
До недавнего времени основное внимание в этиопатогенезе РИН уделялось эмбриону и, в частности, влиянию анеуплоидии [1]. Также выделяют материнские факторы: возраст более 40 лет (в некоторых исследованиях и более 35 лет), высокий ИМТ (> 25 кг/м2), курение (также снижает мужскую фертильность), высокий уровень кортизола, мутации генов тромбофильных факторов (дефицит метилентетрагидрофолатредуктазы, фактора V Лейдена, протромбина, антитромбина III), наличие аутоиммунных заболеваний и аномалий развития матки, спаек в полости матки, хронического эндометрита [4]. Однако данные патологии крайне неспецифичны и обсуждаются также в рамках ненаступления беременности, не ассоциированной с использованием вспомогательных репродуктивных технологий.
Интересна концепция, которая рассматривает активную роль эндометрия в успехе имплантации эмбриона. Ранее употреблявшийся термин «восприимчивость эндометрия» подразумевает пассивность функции при имплантации. РИН рассматривалась в связке с асинхронным (смещенным) окном имплантации (implantation window — период максимальной восприимчивости эндометрия к имплантации бластоцисты: 5–10 день после овуляции, 20–24 день 28-дневного менструального цикла).
Децидуализационная трансформация (децидуализация) эндометрия в средней стадии фазы секреции необходима как для обеспечения восприимчивости к имплантируемому эмбриону, так и для создания поддерживающей и питательной среды после повреждения эпителия и до образования ранней плаценты. Морфологически в строме овальные фибробластоподобные клетки превращаются в крупные сферические децидуальные клетки (рис. 1) [5].
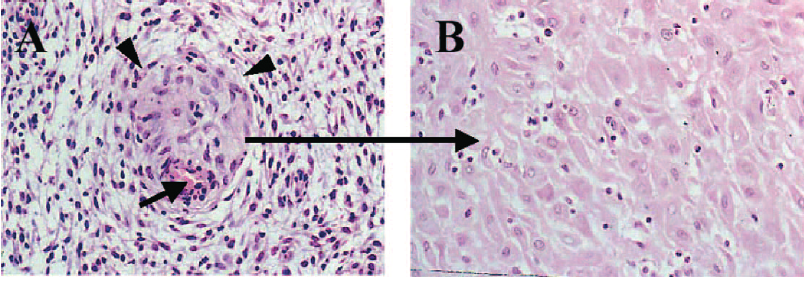
Рисунок 1 | Децидуальная трансформация стромальных клеток эндометрия in vivo и in vitro: (A) инициирование децидуализации в стромальных клетках вокруг терминальной части спиральной артерии на 23-й день цикла (стрелка); (B) обширная децидуальная трансформация стромы эндометрия в конце лютеиновой фазы цикла [5].
Необходимость такой функции биосенсора становится ясной, если принять во внимание теоретическую угрозу, которую имплантирующийся эмбрион представляет для будущей матери. В отличие от других видов, человеческие эмбрионы характеризуются высоким уровнем хромосомных нарушений. Большинству из них не удастся развиться в продолжающуюся беременность, несмотря на то, что они достаточно инвазивны для инициации имплантации. Так можно объяснить наличие активной стратегии организма матери по предотвращению «инвестиций» в эти инвазивные, но малоэффективные эмбрионы [6].
Если децидуализация не оптимальна, функция биосенсора также может быть нарушена. Следствием этого может быть отсутствие раннего отторжения «некачественных» эмбрионов, то есть эндометрий обеспечит нежизнеспособным эмбрионам наступление беременности, верифицируемой клинически, но в конечном итоге обреченной на неудачу. Постоянно снижающаяся селективность эндометрия может привести к периодическим преждевременным прерываниям беременности в сочетании с парадоксальной «сверхплодородностью». И наоборот: при избыточной избирательности частота выкидышей будет ниже (клиническая беременность не разовьется) — при ЭКО это может объясняться РИН (рис. 2) [6]
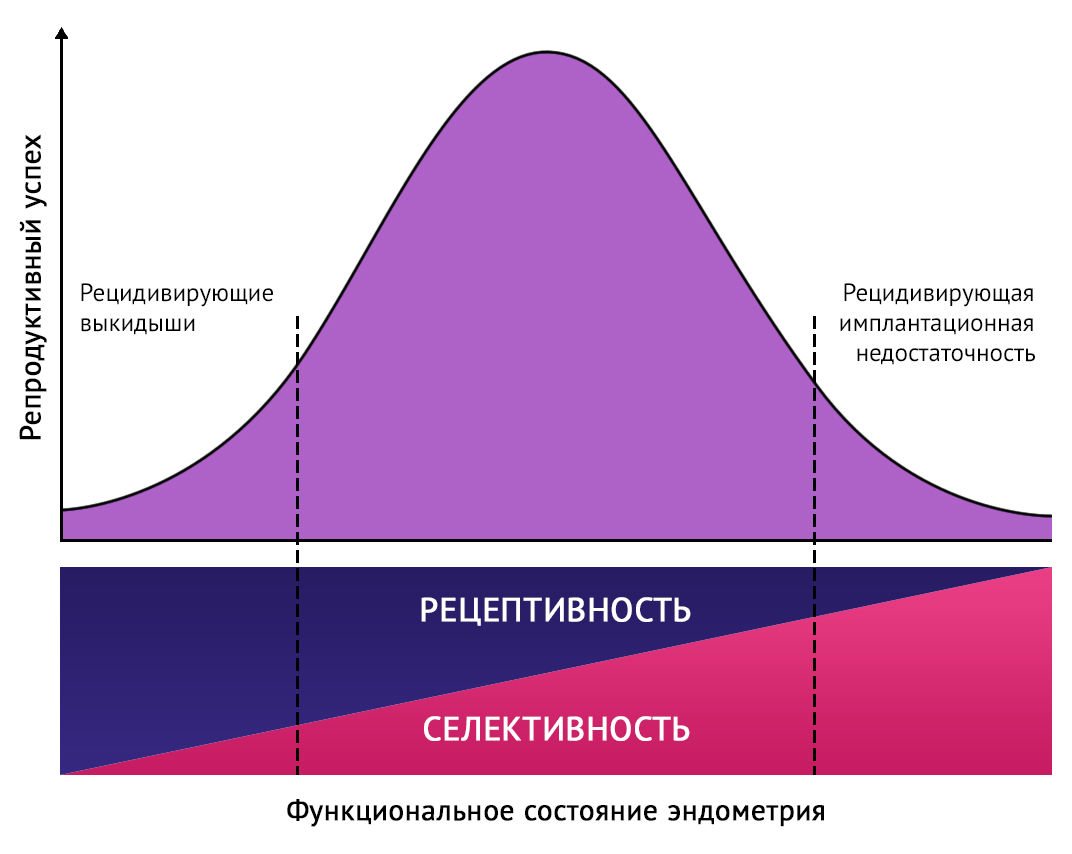
Рисунок 2 | Схематическое изображение возможных клинических последствий дисбаланса между избирательной и рецептивной функциями децидуализированного эндометрия. Чрезмерная восприимчивость и низкая селективность могут привести к неправильной имплантации мало- или нежизнеспособных эмбрионов, что может представлять собой основу рецидивирующей ранней потери беременности. В случае низкой восприимчивости, сочетающейся с чрезмерной избирательностью, могут наблюдаться рецидивы неудачных имплантаций эмбрионов [6].
До недавнего времени диагностические инструменты, предназначенные для выявления специфических нарушений функции эндометрия, были направлены на поиск возможных причин асинхронного окна имплантации и ограничивались ультразвуковой оценкой толщины и структуры или гистологическим исследованием степени созревания (датирование эндометрия по критериям Noyes). Гистологическое исследование основано на изучении микровыпячиваний (пиноподий) на апикальной поверхности эпителиоцитов. Они образуются в период, когда концентрация прогестерона максимальна (середина фазы секреции). Данный процесс соответствует по времени началу окна имплантации с максимальной рецепторной активностью эндометрия. При естественном менструальном цикле это происходит на 6–9-й день после овуляции (19–22-й день менструального цикла). При проведении ЭКО со строго контролируемой стимуляцией яичников образование зрелых пиноподий регистрируется на 18–20-й день. Созревание пиноподий ассоциируется с резким уменьшением количества рецепторов прогестерона (обнаруживается при иммуногистохимическом окрашивании биоптатов) на эпителиоцитах и установлением плато концентрации прогестерона в крови.
Тест ERA (Endometrial receptivity array), направленный на исследование рецептивности и зрелости эндометрия путем анализа 238 генов, представляет собой результат значительного прогресса, но основывается на допущении, что неудача при имплантации эндометриального происхождения возникает исключительно из-за недостаточного созревания [7]. Хотя это может быть важным фактором в некоторых случаях, это слишком узкий взгляд на проблему. Новые исследования расширяют спектр возможных диагностических тестов с учетом многогранного влияния эндометрия на процесс имплантации. Окно имплантации может быть не только асинхронным (смещенным), но и патологическим (нарушенным), причем эти варианты могут как сочетаться, так и наблюдаться в отдельности.
Источники:
1. Coughlan C., et al. Recurrent implantation failure: definition and management. Reprod BioMed Online. 2014;28(1):14–38.
2. Practice Committee of the American Society for Reproductive Medicine. Evaluation and treatment of recurrent pregnancy loss: a committee opinion. Fertil Steril. 2012;98(5):1103–11.
3. Maesawa Y., et al. History of biochemical pregnancy was associated with the subsequent reproductive failure among women with recurrent spontaneous abortion. Gynecol Endocrinol. 2015;31(4):306–308.
4. Bashiri A., Halper KI.., Orvieto R. Recurrent Implantation Failure-update overview on etiology, diagnosis, treatment and future directions. Reprod Biol Endocrinol. 2018;16(1):121.
5. Gellersen B., Brosens J. Cyclic AMP and progesterone receptor cross-talk in human endometrium: A decidualizing affair. The Journal of endocrinology. 2003; 178:357–72.
6. Macklon N. Recurrent implantation failure is a pathology with a specific transcriptomic signature. Fertility and Sterility. 2017; 108(1): 9–14.
7. Koot Y.E.M. et al. An endometrial gene expression signature accurately predicts recurrent implantation failure after IVF. Sci Rep. 2016;6:19411.
