Геномика рака мочевого пузыря

Создание генетических классификаций — приоритетное направление в онкологии. С распространением методов секвенирования нового поколения стал возможен крупномасштабный анализ генетического разнообразия опухолей.
Показателен с этих позиций рак мочевого пузыря — наиболее частая злокачественная опухоль мочевыводящих путей. Это заболевание имеет выраженную склонность к рецидивированию и прогрессированию, отличается тяжелым течением и высокой степенью инвалидизации. Традиционно выделяют поверхностные и мышечно-инвазивные новообразования мочевого пузыря, которые имеют выраженную биологическую неоднородность. Эти различия определяются не только морфологическим вариантом и степенью инвазии опухоли, но и молекулярным профилем, а также генетическими аберрациями.
Данные масштабных исследований Пекинского института геномики [1] и Атласа ракового генома (The Cancer Genome Atlas, TCGA) [2] позволили расширить представления о генетической основе мышечно-инвазивных карцином мочевого пузыря. В ходе канцерогенеза подвергаются мутациям в основном те гены, продукты которых регулируют клеточный цикл: TP53 (как же без вовлечения «хранителя генома») и RB1 (ген, кодирующий онкосупрессорный белок ретинобластомы), CDKN1A, CDKN2A (продукты этих генов — белки-ингибиторы циклинзависимых киназ 1А и 2А), CCND1 (кодирует циклин D1, регулятор клеточного цикла в период перехода от G1 к S-фазе), MDM2 (его продукт является р53-специфичной Е3-лигазой, осуществляющей негативную регуляцию р53 путем его протеасомной деградации и снижения транскрипционной активности) [1, 2]. Согласно данным TCGA, гены-«контролеры» клеточного цикла повреждаются в 93 % случаев опухолей этой локализации. Чаще всего под удар попадают TP53 и CDKN2A [2].
Обнаружена важная роль эффекта эпистаза (влияния мутаций друг на друга). В отсутствии эпистаза накопление канцерогенных мутаций напоминало бы собирательство по принципу «чем больше, тем лучше»: значимость новой мутации не зависит от уже присутствующих в геноме, так что порядок их возникновения не важен. При выраженном эпистазе роль каждой новой мутации определяется тем, какие мутации уже закрепились в геноме ранее. Новые аберрации идут по пути «разрешенных» траекторий, что повышает вероятность их предсказания. Некоторые генетические изменения оказались взаимоисключающими. Например, мутации генов CDKN2A и TP53, CDKN2A и RB1, TP53 и MDM2 [3].
Определенные участки генов характеризуются крайне высокой мутабельностью. При раке мочевого пузыря такие «горячие точки» выявляются в генах PIK3CA (фосфатидилинозитол-3-киназа) в 25 % случаев, EGFR (рецептор эпителиального фактора роста) в 9 %, HRAS в 6 % и NRAS в 2,4 % (гены семейства Retrovirus Associated DNA Sequences, кодируют белки суперсемейства малых гуанозинтрифосфатаз), PTEN (ген-супрессор опухолевого роста, его продукт — фермент липидная фосфатаза) в 6 % и FGFR3 (кодирует рецептор фактора роста фибробластов 3) в 19 %. Мутации FGFR3 часто регистрируются в мышечно-инвазивных карциномах мочевого пузыря на более ранних стадиях (21 % при pT2 (р — патологоанатомическая классификация) по сравнению с 10 % при pT3-T4) и ассоциированы с увеличением выживаемости пациентов [3].
Мутации и гиперэкспрессия онкогена ERBB2 (HER2/neu), кодирующего тирозинкиназный рецептор, обнаружены с высокой частотой (14 %).
Профиль мутационных изменений может стать основой для формирования принципов терапии. Например, чувствительность к терапии цисплатином увеличивается в опухолях с аберрантным ERBB2, а также при повреждении генов системы репарации ДНК, включая ген эксцизионной репарации ERCC2. Применение цисплатин-содержащих схем терапии позволит достичь лучшего лечебного патоморфоза опухоли и даже снизить частоту проведения радикальной цистэктомии у данной группы пациентов [4, 5].
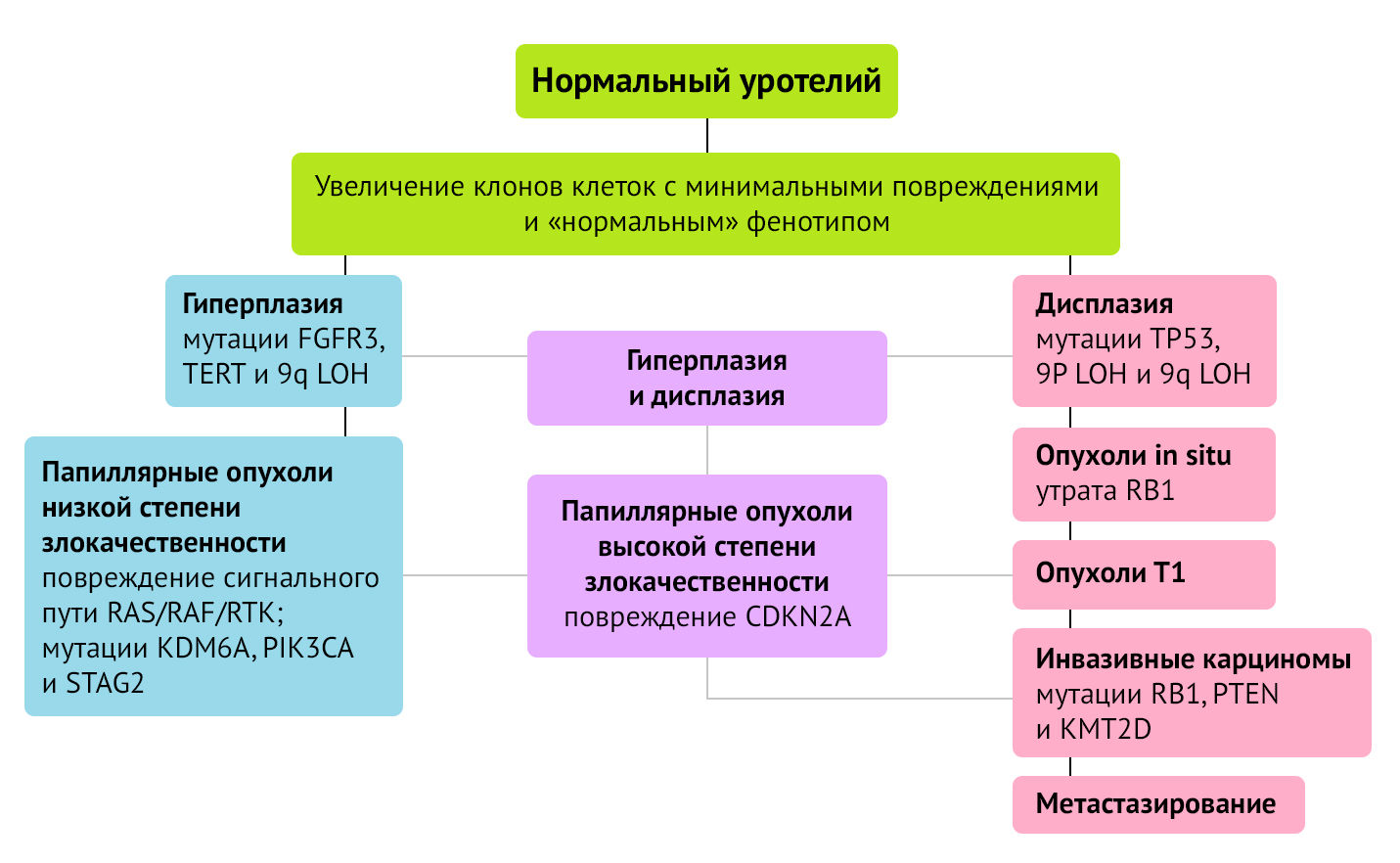
Классические мутации в TP53 отмечены при мышечно-инвазивном раке и метастатическом процессе, в то время как мутации в FGFR3 чаще встречаются при поверхностных формах рака мочевого пузыря. При обнаружении обоих типов мутаций закономерно предположить, что такие опухоли прогрессировали от неинвазивного к инвазивному раку, приобретая в процессе развития новые генетические аберрации (рис.1) [6, 7].
.
Инвазивный рак мочевого пузыря — с прорастанием в мышечный слой (≥рТ2).
При неинвазивных опухолях отмечена высокая частота мутаций FGFR3 и генов семейства RAS:
FGFR3 (fibroblast growth factor receptor 3) — ген, кодирующий рецептор фактора роста фибробластов 3. Его гиперэкспрессия при неинвазивном типе рака мочевого пузыря обеспечивает активность каскада RAS/RTK/RAF с усилением митогенных сигналов и пролиферацией клона клеток.
TERT — ген, кодирующий теломеразную обратную транскриптазу (TERT, telomerase reverse transcriptase), которая входит в состав фермента теломеразы. Высокая теломеразная активность приводит к стойкому выживанию клеток.
Потеря гетерозиготности (loss of heterozygosity — LOH) хромосомного района 9q. Суть LOH заключается в утрате (структурной или функциональной) одного из аллелей гетерозиготного генотипа. Потеря аллеля позволяет проявиться фатальным рецессивным мутациям в оставшемся аллеле.
RAS/RAF/RTK сигнальный путь — цепь протеинов и киназ: белок саркомы крыс (RAS), митоген активированная протеинкиназа (RAF), тирозинкиназные рецепторы ростовых факторов (RTK). Этот каскад контролирует клеточную пролиферацию, клеточный цикл и способность к миграции.
KDM6A — ген, кодирующий фермент — гистоновую деметилазу, которая отщепляет метильные группы у триметилированного и диметилированного лизина.
PIK3CA — фосфатидилинозитол-3-киназа, способствующая передаче AKT-сигналов (сигнальный путь клеточного выживания), усилению роста, белок-синтетической активности и устойчивости к апоптозу.
STAG2 — ген, кодирующий стромальный антиген 2 или субъединицу комплекса когезина. Он контролирует процесс разделения сестринских хроматид при клеточном делении.
CDKN2A — ингибитор циклин-зависимой киназы 2A.
TP53 — ген транскрипционного фактора TP53 с онкосупрессорной активностью.
Потеря гетерозиготности (loss of heterozygosity — LOH) хромосомного района 9p.
RB1 — ген, кодирующий белок ретинобластомы (онкосупрессор).
PTEN (гомолог фосфатазы и тензина) — ген, кодирующий супрессор опухолей. Его активность ингибирует путь клеточного выживания АКТ за счет дефосфорилирования сигнальных молекул.
KMT2D — ген, продуктом которого является гистоновая лизин N-метилтрансфераза 2D. Функция — эпигенетическая активация транскрипции [7, 8].
Источники:
- Guo G.et al. Whole-genome and whole-exome sequencing of bladder cancer identifies frequent alterations in genes involved in sister chromatid cohesion and segregation. Nat Genet. 2013; 45:1459–63.
- The Cancer Genome Atlas Research Network: Comprehensive molecular characterization of urothelial bladder carcinoma. Nature. 2014; 507: 315–22.
- Robertson A.G. et al. Comprehensive molecular characterization of muscle-invasive bladder cancer. Cell .2017: 1–43.
- Plimack E.R.et al. Defects in DNA repair genes predict response to neoadjuvant cisplatin-based chemotherapy in muscle-invasive bladder cancer. Eur Urol. 2015; 68:959–67.
- Van Allen E.M.et al. Somatic ERCC2 mutations correlate with cisplatin sensitivity in muscle-invasive urothelial carcinoma. Cancer Discov. 2014; 4:1140–53.
- Li H.T., Duymich C.E., Weisenberger D.J., Liang G. Genetic and Epigenetic Alterations in Bladder Cancer. Int Neurourol J. 2016; 20 (Suppl 2): S84–S94.
- Audenet F., Attalla K., Sfakianos J.P. The evolution of bladder cancer genomics: What have we learned and how can we use it? Urol Oncol. 2018 Jul; 36(7): 313-320.
- Tan T.Z et al. Molecular Subtypes of Urothelial Bladder Cancer: Results from a Meta-cohort Analysis of 2411 Tumors.Eur Urol. 2019; 75(3): 423-432.
