Роль интерлейкина-13 (ИЛ-13) в течении аллергии
Анафилаксия — это жизнеугрожающая аллергическая реакция, которая зависит от высокоаффинного к ней аллергенспецифического IgE. Гоутаман и соавторы продемонстрировали, что новый интерлейкин (ИЛ-13), который экспрессируется субпопуляцией Т-хелперов (Tfh), специфически стимулирует ответную реакцию при участии IgE. Данное открытие дает потенциальную возможность в применении новых стратегий для лечения аллергии.
Атопические и аллергические заболевания влияют на миллионы людей в США, а их рост за последние 30–40 лет носит эпидемический характер. Аллергические реакции могут приводить к анафилаксии — жизнеугрожающей форме аллергического иммунного ответа, при котором возможно резкое снижение артериального давления и нарушение функций органов. Пищевая аллергия, особенно на арахисовые белки, часто сопровождается анафилактическими реакциями.
Во время фазы инициации аллергической иммунной реакции Т-хелперы продуцируют интерлейкин-4 (ИЛ-4), что в свою очередь активирует выработку В-клетками антиген-специфических антител IgE. Затем большинство IgE прочно связывается Fcε-рецепторами тучных клеток. IgE с низким аффинитетом к белковому аллергену не способны спровоцировать активацию тучных клеток и вызвать анафилаксию (рис. 1А). Однако взаимодействие белков аллергена с высокоаффинными аллерген-специфическими IgE на поверхности тучных клеток способствует сшиванию Fce-рецепторов, запускающему каскад сигналов. Это приводит к дегрануляции тучных клеток и высвобождению медиаторов воспаления, которые образуются заранее и хранятся в виде гранул в цитоплазме. К ним относятся гистамин, протеазы, цитокины, хемокины (рис. 1Б). Выброс медиаторов воспаления во время системного ответа приводит к тяжелой аллергической реакции.
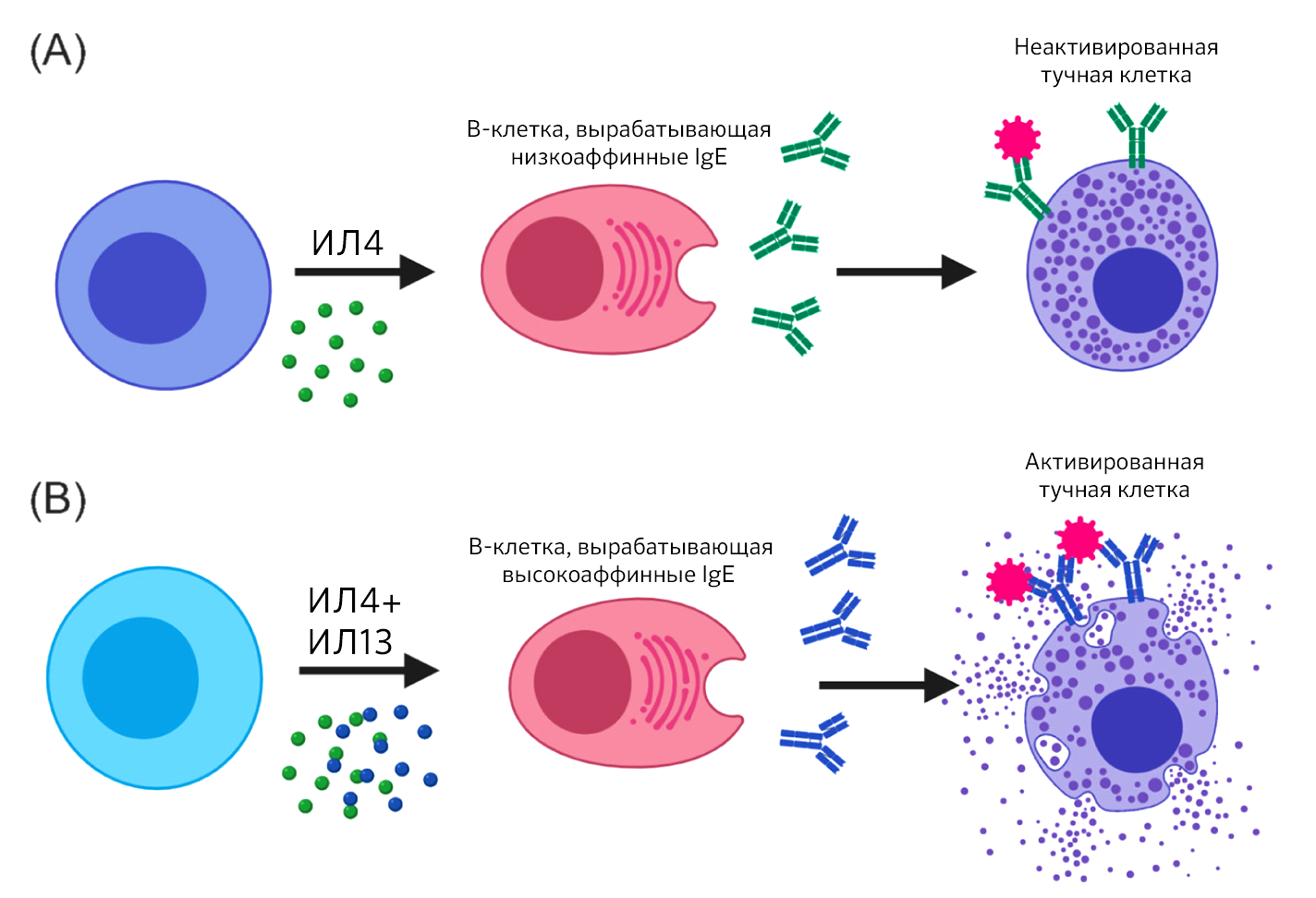
Гоутаман и соавторы показывают, как Tfh2 помогают В-клеткам продуцировать низкоаффинные IgE посредством секреции ИЛ-4 (А), в то время как Tfh13 помогают В-клеткам вырабатывать высокоаффинные IgE посредством секреции ИЛ-4 и ИЛ-13 (Б).
Недавние исследования показали, что в культуре клеток, взятой из герминативного центра лимфоидной ткани, специализированные фолликулярные Т-хелперы, продуцирующие ИЛ-4, необходимы для выработки IgE активированными В-клетками. Данное открытие расширило представление ученых о механизмах, которые контролируют развитие аллергии. Несмотря на то, что ключевым звеном в анафилактическом ответе является IgE, имеющий сродство к аллергену, вопрос о том, каким образом он образуется в герминативном центре, остался неясным. В настоящее время, исследователи из Йельского университета и Лаборатории медицинской геномики Джексона под руководством Стефани Айзенбарт обнаружили особый интерлейкин-13 (ИЛ-13), который продуцируется Т-хелперами, ответственными за индукцию выработки IgE. Данный интерлейкин может способствовать развитию анафилактических реакций. Это открытие проливает новый свет на диагностику и, возможно, лечение опасных для жизни аллергий.
Известно, что пациенты с дефектами гена цитокина-8 (DOCK8) обычно страдают от гипер-IgE-синдрома, тяжелых аллергий и астмы. Гоутаман вместе с командой начали свое исследование путем характеристики аллергического ответа у мышей, которые имели дефект DOCK8 в Т-клетках. Они заметили, что фенотип гипер-IgE-синдрома был найден у мышей после первой иммунизации, при котором не должна была происходить активация выработки IgE. Эти результаты показали, что фенотип гипер-IgE-синдрома с недостатком цитокина-8 развивался при помощи Т-клеток. Затем с помощью пассивной анафилаксии авторы показали, что IgE от мышей с T-DOCK8 ^-/- способствовали ее развитию. Тем не менее, частота и общее количество Т-клеток, которые необходимы для продукции IgE, были сопоставимы с количеством у мышей с T-DOCK8 ^-/- и диких мышей. В связи с этим авторами был произведен более детальный анализ Т-клеток у мышей с T-DOCK8 ^-/-, в результате которого они обнаружили новую субпопуляцию Т-клеток (Tfh13), которые экспрессировали ИЛ-13. В отличие от Tfh , Tfh13 действуют вне герминативного центра. Гоутаман и его команда обнаружили Tfh13 у диких мышей без мутаций, у которых была индуцирована аллергия дыхательных путей или пищевая аллергия. Это отразило связь Tfh13 с развитием аллергических болезней. Важно отметить, что в момент активности Tfh13 уровень высокоаффинных IgE увеличивался, что опосредовало анафилаксию у диких мышей.
Используя секвенирование одноцепочечной РНК, авторы показали, что Tfh13 являются уникальным клетками, отличными от Tfh и Th2, но в то же время имеющими некоторые свойства, характерные для них. В отличие от обычных Tfh, Tfh13 экспрессируют главный фактор транскрипции Th2-клеток — Gata3, а также продуцируют три цитокина, характерных для Th2: ИЛ-5, ИЛ-4 и ИЛ-13. Tfh13 также экспрессируют главный фактор транскрипции Tfh, Bcl6, который вызывает репрессию Gata3 и транскрипцию генов Th2, отвечающих за выработку цитокинов. Tfh13, вероятно, поддерживают баланс между достаточным количеством Bcl для стимулирования фенотипа Tfh и количеством Gata3 для транскрипции цитокинов Th2. Однако важный вопрос о том, как развиваются Tfh13, остается все еще без ответа. Отличаются ли Tfh13 от Th2, или от обычных Tfh при действии сильной поляризации на Th2, или непосредственно от CD4 T-клеток?
Команда Гоутамана показала, что Tfh13 были необходимы для выработки высокоафинных IgE и, предположительно, ИЛ-4, производимых субпопуляцией Tfh-клеток, называемых Tfh2, которые способствовали выработке низкоаффинных IgE (рис. 1А). Дальнейшая работа показала, что для выработки анафилактических IgE необходим ИЛ-13, вырабатываемый Tfh13 (рис. 1Б). Учёные также имели намерения спроецировать данные результаты на людей, поскольку они обнаружили более высокий уровень Tfh13 среди циркулирующих Tfh у пациентов с повышенным уровнем специфического арахисового IgE. Эти выводы помогли устранить давнее несоответствие между иммунологией человека и мыши, когда было известно, что ИЛ-13 запускает выработку IgE в человеческих B-клетках, но не запускает в мышиных. Для подтверждения роли ИЛ-13, команда Гоутамана продемонстрировала субпопуляцию активированных мышиных B-клеток в герминативном центре, которые экспрессировали рецепторы к ИЛ-13 и могли бы индуцировать выработку IgE в присутствии ИЛ-13.
Ученые также заметили, что уровень высокоаффинных IgE был значительно выше в случае с T-DOCK8 ^-/- мышами, в то время как уровень IgG1+ клеток памяти с высоким сродством был ниже по сравнению с контрольной группой. Как показали недавние исследования, плазматические клетки, продуцирующие высокоаффинные IgE, могут дифференциироваться в IgG1+ клетки памяти при повторном воздействии аллергенов. Снижение уровня высокоаффинных IgG1+ в случае с T-DOCK8 ^-/- мышами указывает на то, что Tfh13 провоцируют IgG1+ клетки памяти превращаться в плазматические клетки, секретирующие IgE. Ключевой вопрос заключается в том, какую роль играет ИЛ-13, производимый Tfh13 клетками, в превращении IgG1+ клеток памяти в плазматические клетки. Однако вопрос о том, превращаются ли высокоафинные IgG1+ клетки памяти в плазмоциты, не изучался. Если IgG1+ клетки памяти имеют повышенную экспрессию рецепторов к ИЛ-13, то это может быть механизмом данного селективного ответа
Интересно, что гельминтные инфекции не индуцировали выработку высокоаффинных IgE Tfh13, хотя развивались сильные ответы Th2. Таким образом, клеточные ответы Th2 не всегда коррелируют с клеточными ответами Th13. Каковы механизмы и почему гельминтные инфекции отличаются от аллергических реакций с точки зрения индукции клеток Tfh13? Решение данного вопроса поможет нам лучше понять аллергии, а также разработать специфическую терапию для различных Th2-опосредованных заболеваний, таких как астма и атопический дерматит.
В настоящее время, единственное лечение, которое может предотвратить дегрануляцию тучных клеток, приводящую к анафилактическому шоку, включает в себя неспецифическую терапию снижения уровня IgE с использованием омализумаба. Это моноклональное антитело, которое ингибирует связывание IgE с тучными клетками. Методы лечения, в основе которых лежит специфическое подавление выработки IgE, могут стать альтернативной терапевтической стратегией для борьбы с аллергическими реакциями и анафилаксией. Поскольку Tfh13 экспрессируют высокие уровни GATA3, использование ДНК-фермента, расщепляющего Gata3, с последующим подавлением Tfh13 и выработки IgE, может иметь терапевтическую пользу при сильной аллергии.
Авторы отметили, что клинические испытания ДНК-фермента показали эффективность в уменьшении эозинофилии, но о подавлении Tfh13 или IgE ничего не известно.
В конечном счете, понимание механизма стимулирования В-клеток для получения высокоаффинного IgE при атопическом заболевании является клинически важной областью иммунологического исследования. Айзенбарт и его коллеги сделали прорыв в этом важном вопросе, раскрыв, как новая популяция Т-клеток, Tfh13, важна в отношении выработки IgE. Эти выводы положили основу для более глубокого понимания регуляции выработки IgE и анафилаксии, а также обеспечили возможность создания более точной иммунотерапии атопических заболеваний.
