Система Grade: как упорядочить хаос
Генри Миллер писал: «Хаос — это порядок, который нам непонятен». Трансформация клеток с последующим безудержным ростом опухолевой массы представляет, на первый взгляд, участок анархии в организме, но изучение биологии канцерогенеза постепенно формирует понимание связей и законов опухолевой системы. В клинической практике переход от периода «смуты» выражается в совершенствовании классификаций опухолей. Одной из очевидных, но далеко не самых простых характеристик неоплазий является морфологическая картина. Она позволяет судить о «темпераменте» опухоли, определяющем степень ее злокачественности.
Градация (Grade) — категория степени гистологической злокачественности, основанная на том, как атипичные клетки и опухолевая ткань в целом выглядят при световой микроскопии.
Количество градаций варьирует от 3 до 4 в зависимости от типа опухоли. Если злокачественно трансформированные клетки и структурная организация опухолевой ткани близки к нормальным, опухоль является «хорошо дифференцированной» (Grade 1). Эти опухоли имеют тенденцию расти и метастазировать медленнее, чем «мало/плохо дифференцированные» (Grade 2 и/или Grade 3) или «недифференцированные» (Grade 3 или 4). Более высокий Grade сочетается с увеличением агрессивности опухоли и ухудшением прогноза.
Основываясь на этих и других различиях в микроскопической картине, патологоанатомы вычисляют числовую «оценку» большинства онкологических заболеваний. Факторы, используемые для определения степени злокачественности опухоли, различаются в зависимости от локализации.
Степень злокачественности опухоли не совпадает со стадией. Стадия определяется комбинацией значений T, N, M, описывающих размер первичной опухоли, поражение регионарных лимфатических узлов и наличие метастазов и их характеристику. Валидные гистологические системы классификации достаточно длительно используются при верификации рака молочной железы [1], предстательной железы [2], эндометрия [3], сарком мягких тканей [4] и опухолей почек [5].
Для некоторых опухолей для определения градации используют уникальные по гистологическому строению участки. Например, низкодифференцированные кластеры (poorly differentiated clusters, PDCs) рассматриваются в качестве гистопатологического предиктора рака прямой кишки. PDCs состоит из пяти и более раковых клеток, которые формируют инвазивный компонент при отсутствии железистой паренхимы опухоли (рис.1) [6].
.
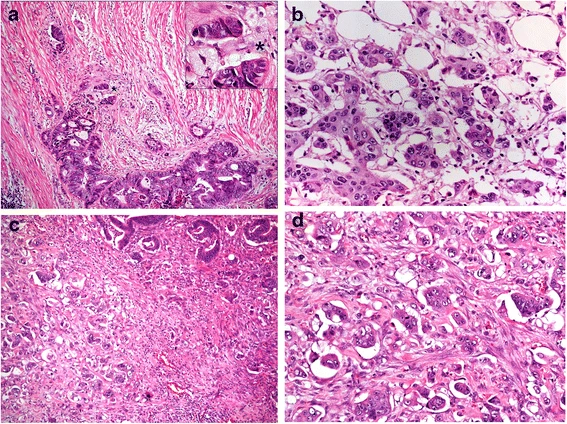
b — Grade 2: 5–9 PDC
c — Grade 3: ≥ 10 PDC
d — Grade 3: те же кластеры при большом разрешении [6]
Рассмотрим для примера определение гистологической градации при раке молочной железы. Для объективизации процесса и унификации используется полуколичественная оценка морфологических характеристик опухоли. В настоящее время она представлена Ноттингемской модификацией системы Скарфа-Блума-Ричардсона или Ноттингемской градирующей системой, принятой во всем мире. Кратко ее пункты отражены в таблице 1 (и пусть вас не запутает мнемоника, основанная на аналогии с Tumor/Nodulus/Metastasis).
.

Разберем составляющие ингредиенты гистологической градации.
Оценка железистых структур проводится во всех участках доставленного материала. В зависимости от доли фрагментов с наличием таких элементов выставляется определенное число баллов:
- 1 балл – более 75 % опухолевого поля формируют железистые/тубулярные структуры
- 2 балла — от 10 % до 75 % опухолевого образца
- 3 балла – менее 10 % опухолевого образца.
Не всякая щель в препарате – железа, могут быть и артифициальные повреждения материала. Нам нужны только структуры с четко определяемым центральным просветом, окруженным поляризованными злокачественно трансформированными клетками.
Ядерный полиморфизм – морфологическое проявление опухолевой дифференцировки на цитологическом (клеточном) уровне. Это визуальный паттерн генетических поломок в опухолевой клетке: анеуплоидии, генетической нестабильности и изменения транскрипции.
Индивидуальность во взглядах делает нас особенными личностями, но, к сожалению, в морфологической оценке выражается в субъективизме, особенно при рассмотрении ядер клеток.
Ядерный полиморфизм оценивается по балльной системе:
- 1 балл — ядра маленькие, незначительно увеличены по сравнению с клетками эпителия нормальных структур, с правильными очертаниями, моноформным ядерным хроматином, невыраженной разницей в размерах
- 2 балла — клетки больше, чем нормальные эпителиоциты, с везикулярными ядрами, выраженными ядрышками, умеренными различиями в размерах и форме.
- 3 балла — везикулярные ядра, часто с заметными ядрышками, значимые различия по форме и размеру, зачастую с причудливыми формами.
Количество митозов указывает на уровень пролиферативной активности опухоли. Поэтому справедливо отдать лавры самого прогностически значимого компонента гистологической градации букве «М».
Митоз или не митоз — вот в чем вопрос… Для подсчета используют только достоверные фигуры митоза, отражающие различные его стадии. Этот показатель невероятно капризен и реагирует на качество фиксации материала. Поэтому в спектр компетенций патологоанатома включается также и взаимодействие с лабораторией, чтобы осознавать возможные «помехи» и при необходимости запрашивать повторную подготовку опухолевого материала.
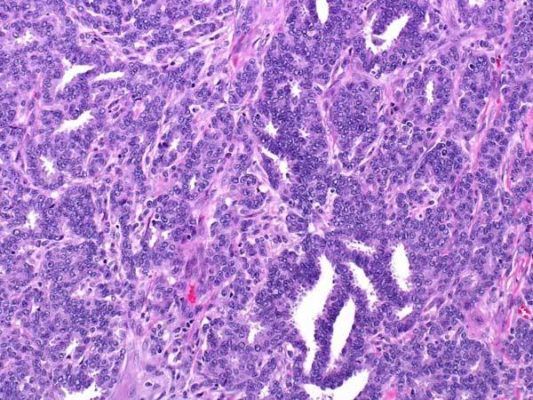
Рисунок 2. Grade 1: инвазивная протоковая карцинома состоит из небольших желез с достаточно однотипными ядрами. Карциномы G1 менее агрессивны и имеют лучший прогноз, чем менее дифференцированные. Они также чаще ER-положительные (иммуногистохимический показатель — экспрессия рецепторов эстрогена на опухолевых клетках), что является еще одной особенностью, связанной с более благоприятным прогнозом.
.
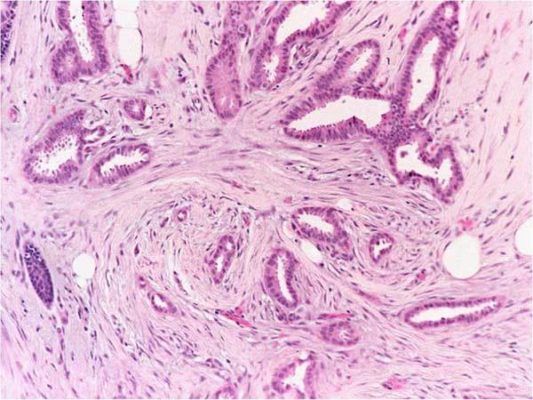
Рисунок 3. Grade 2: некоторые участки этой инвазивной протоковой карциномы образуют структуры наподобие трубчатых желез, но другие области представлены плохо сформированными железами с гнездными скоплениями клеток, содержащих умеренно атипичные ядра. Карциномы G2 имеют промежуточный прогноз.
.
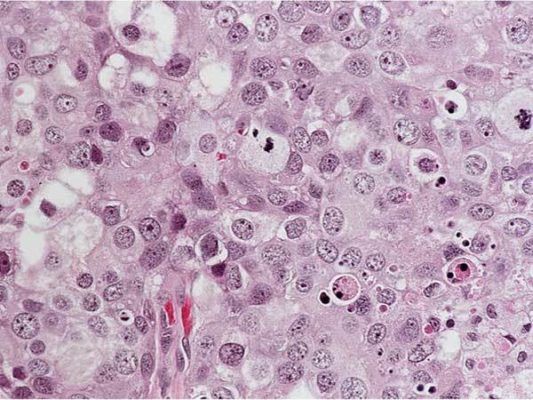
Рисунок 4. Grade 2: эта инвазивная протоковая карцинома состоит из отдельных и гнездно расположенных атипичных клеток с выраженным ядерным полиморфизмом и высокой митотической активностью. Карциномы G3 имеют максимально неблагоприятный прогноз. Молекулярный подтип таких опухолей чаще трижды негативный (отсутствует экспрессия рецепторов эстрогена, прогестерона, отрицательный HER2), что ассоциировано с агрессивным поведением опухоли и худшим прогнозом.
Опухолевая гетерогенность проявляется и в пролиферативной активности. Для максимально точной оценки подсчет проводят в 10 HPF (high-power field, поле зрения при большом увеличении микроскопа) по периферии опухолевого узла, где ожидается наибольшее число пролиферирующих клеток. Важным аспектом являются характеристики используемого микроскопа. Количество определяемых митозов зависит от площади поля зрения. Патологоанатом должен знать объем поля зрения на окуляре и показатели объектива своего верного «помощника».
.

А — объектив Nikon или Labophot с кратностью увеличения в 40 раз (40x) или сопоставимый с диаметром поля 0,44 мм;
В — объектив Leitz или Ortholux 25x или сопоставимый с диаметром поля 0,59 мм;
С — объектив Leitz или Diaplan 40x или сопоставимый с диаметром поля 0,63 мм.
Итоговая оценка Grade основана на подсчете суммы 3 вышеуказанных компонентов:
- I степень злокачественности (Grade 1, G1) = от 3 до 5 баллов
- II степень злокачественности (Grade 2, G2) = 6–7 баллов
- III степень злокачественности (Grade 3, G3) = 8–9 баллов
Введение в онкологическую практику оценки степени злокачественности опухоли подчеркивает важность биологических свойств атипичных клеток. Потенциал к неконтролируемому агрессивному росту, инвазии и метастазированию можно оценить по визуальным характеристикам отдельных клеток и особенностям сформированных ими структур. Для различных локализаций новообразований разрабатываются собственные системы оценки, которые непрерывно совершенствуются. Но даже самый точный, идеально сконструированный алгоритм не будет работать при отсутствии достаточной компетенции специалиста. Сохранить ясный взгляд, педантичность и скрупулезность в течение каждого, даже самого тяжелого рабочего дня крайне важно для онкоморфологов. Их кропотливый труд завершается распечаткой листа с надписью «результаты патологоанатомического исследования», на котором в нескольких строках в графе «заключение» расписаны ориентиры для клиницистов, определяющие судьбу пациента.
Источники:
- Rakha E.A. et al.Breast cancer histologic grading using digital microscopy: concordance and outcome association. J Clin Pathol. 2018 Aug;71(8):680—686.
- Humphrey P.A. Histopathology of Prostate Cancer. Cold Spring Harb Perspect Med.2017;7(10). pii: a030411.
- Pandita P., Wang X., Jones D.E, Collins K., Hawkins S.M. Unique Molecular Features in High-Risk Histology Endometrial Cancers. Cancers (Basel). 2019;11(11). pii: E1665.
- Сowan M.L., Thompson L.D., Leon ME., Bishop J.A. Low-Grade Fibromyxoid Sarcoma of the Head and Neck: A Clinicopathologic Series and Review of the Literature. Head Neck Pathol. 2016;10(2):161–6.
- Dagher J. et al. Clear cell renal cell carcinoma: validation of World Health Organization/International Society of Urological Pathology grading. Histopathology. 2017;71(6):918-925.
- Reggiani Bonetti L. et al. Poorly differentiated clusters (PDC) in colorectal cancer: what is and ought to be known. Diagn Pathol 2016;11:31.
- https://pathology.jhu.edu/
