Паразитарное ложе твоего разума

Насколько мы руководствуемся собственными предпочтениями в принятии решений? На данный момент существует множество теорий, так или иначе объясняющих воздействие различных факторов на выбор, который мы делаем, однако рассмотрим ту, которая кажется наименее очевидной. Настолько, что не видна невооруженным глазом. В данном случае вместо «насколько мы свободны в принятии решений?» следует спросить: «насколько мы одиноки в принятии собственных решений?». Воздействия микроскопических сожителей зачастую кажутся нам незаметными, но отсутствие стандартных симптомов заболевания вовсе не делает вас свободным от нитей кукловодов из микромира. Их цель — выжить, источник их выживания — вы. Их пищевые привычки станут вашими привычками, их инстинкт размножения станет вашей необходимостью социального взаимодействия.
Но для начала давайте немного отойдем от человека (столь сложной модели) и обратимся к более простым в контексте неврологического развития примерам. Начнем с тех, без кого не обходится ни один летний денек.
Часть I. Примеры паразитической нейрорегуляции в мире насекомых
Наиболее простой классификацией воздействия паразита на поведение хозяина будет следующая: паразитизм внутри мозга, внутри тела, вне тела и на расстоянии.
Те ужасы, которые мы видели в кинофильмах, для некоторых насекомых — печальная участь.
На данный момент, благодаря игре «The last of us», наиболее известным паразитом среди муравьев является гриб рода кордицепс. Споры гриба, попадая на кутикулы муравья, прикрепляются к ним, прорастая и проникая в тело муравья, распространяясь через трахею. Затем грибковые филаменты, называющиеся мицелием, растут, поедая органы хозяина, за исключением жизненно важных. Высвобождая определенные вещества, они влияют на навигацию муравья, обусловливая, к примеру, его стремление подняться повыше на дерево, закрепившись там. Если гриб готов к формированию спор, он сжирает мозг хозяина, прекращая страдания насекомого. Плодовые тела гриба затем прорастают кутикулу и освобождаются от капсулы, начиненной спорами. Капсула, подхваченная ветром, разрывается, распространяя споры, которые, попадая на кутикулы муравьев, повторяют цикл (рис. 1).
.

Рисунок 1 | Примеры из жизни куда менее устрашающие, учитывая тот факт, что на человека они не распространяются
Немного интереснее обстоят дела с мигрирующей от тела к мозгу муравья ланцетовидной двуусткой (Dicrocoelium dendriticum). Попадая в гемолимфу муравья из пищеварительного тракта, двуустки дрейфуют в организме хозяина некоторое время. Один из паразитов проникает к мозговому ганглию муравья, секретируя субстанции, влияющие на навигацию хозяина. Как только наступает вечер и снижается температура воздуха, муравей покидает колонию и забирается вверх по травинке. Там он закрепляется и ожидает, пока траву вместе с муравьем употребит пастбищное животное. Если этого не происходит, с наступлением утра и повышением температуры окружающего воздуха поведение муравья приходит в норму и он возвращается к обычной деятельности. Вечером все повторяется (рис. 2).
.

Рисунок 2 | Слева направо: муравей закрепился на травинке; месторасположение ланцетовидной двуустки в организме муравья [1]
Еще более интересный случай наблюдается при паразитизме внутри социальной группы другого вида. Так, паразитом выступает гусеница (Maculinea rebeli), которая маскируется под муравьев (Myrmica schencki), выделяя определенные соединения и издавая звуки, которые муравьи используют для общения. Таким образом гусеница проникает в муравьиную колонию, где лакомится личинками муравьев. Но карма беспощадна: иронично, что эта гусеница является хозяином для паразитирующей осы (Ichneumon eumerus). Оса находит колонии муравьев и секретирует особые вещества, которые заставляют муравьев вести себя агрессивно. Воспользовавшись суматохой, оса находит гусеницу, жалит и внедряет в ее тело свои яйца (рис. 3).
.

Рисунок 3 | Слева направо: гусеница Maculinea rebeli, маскируясь, словно шпион, проникает в стан муравьев, однако терпит крах от другого агента — паразитирующей осы Ichneumon eumerus [2]
Интересным, возможно, покажется пример паразитизма между эусоциальными бумажными осами (Polistes dominula) и эндопаразитом (Xenos vesparum). Личинка выжидает свою жертву, а затем нападает на нее, проникая под кутикулу и внедряясь в брюшко осы (рис. 4). Внедрение паразита имеет долгоиграющие последствия для всей колонии.
Являясь эусоциальными насекомыми, бумажные осы формируют высокоорганизованные колонии со строгим делением на две касты: способные к репродукции и неспособные. Колонии состоят из одной или нескольких королев, которые строят гнездо и выводят потомство самок-рабочих (из касты нерепродуктивных). Как правило, представители одной касты не в состоянии демонстрировать поведенческие черты другой касты. Однако зараженные осы начинают вести себя неподобающим для социального насекомого образом. Так, рабочая оса демонстрирует поведение репродуктивной особи, покидая колонию для встречи с другими зараженными осами. Мужские и женские особи паразитоида спариваются. Если оса была инфицирована мужской особью, она умирает. Если женской, начинает вести себя как королева, питается и растет, пока не вернется в свою колонию, либо другую, распространяя паразитов дальше.
Данные РНК-секвенирования, используемые для характеристики паттернов экспрессии генов полового поведения в нейронах у инфицированных и неинфицированных самок ос демонстрируют экспрессию генов, отвечающих за репродуктивное поведение. Эти данные свидетельствуют о том, что паразитоид воздействует на своего хозяина, используя фенотипическую пластичность, связанную с социальной кастой, изменяя естественное социальное поведение так, что это выгодно паразитоиду.
.

Рисунок 4 | Слева направо: здоровая и зараженная Xenos vesparum особь
Для демонстрации внешней нейрорегуляции стоит привести пример взаимодействия между некоторыми гусеницами и муравьями: выделение гусеницей секрета с содержанием сахара активирует у муравьев систему вознаграждения. «Нектар» делает муравьев зависимыми и агрессивными, их деятельность со временем сводится к защите гусеницы и употреблению нектара (рис. 5). Мутуализм постепенно переходит в паразитизм, муравьи не в силах отказаться от нектара. У них выявляется повышенный уровень дофамина, в то время как другие моноамины в норме [3,4]. Как и в случае с попытками признать сахар наркотиком для человека, такие работы имели место быть, хотя они и достаточно спорны [5].
.

Рисунок 5 | Гусеница Narathura japonica, окруженная муравьями, деятельность которых направлена на употребление нектара и защиту гусеницы от любых посягательств извне
В целом, существует куда больше примеров паразитизма. И суицидальное поведение сверчков при инвазии волосатиков, которые направляют их в воду, откуда затем волосатики вырываются в водное пространство, и яростная оборона гусеницей личинок осы во вред себе, и многое другое (рис. 6).
.

Рисунок 6 | Иллюстрации поведения насекомых, суицидальная наклонность которых обусловлена репродуктивной пользой для паразитических организмов
Вирусные заболевания также могут воздействовать на поведение хозяев. Так, бакуловирус контролирует поведение личинок чешуекрылых, заставляя их оставаться на открытой листве деревьев, подавляя линьку и окукливание, вызывая смерть и разложение, что способствует распространению вируса.
Некоторые другие вирусы могут потенцировать у своих хозяев агрессию, как, например, при заражении РНК-вирусом деформированного крыла медоносных пчел.
Агрессию у животных, в том числе человека, может вызывать вирус бешенства. Причиной данного явления считают нарушение деятельности никотиновых a2b4 рецепторов в ЦНС и снижение плотности серотонинергических рецепторов.
Несмотря на то что влияние этого вируса на поведение зараженного индивида существенно, основной целью данной статьи является рассмотрение возможности воздействия микроорганизмов на человека без выраженной симптоматики какого-либо заболевания.
Итак, приступим.
Часть II
Пищевое поведение
В принципе, любые микроорганизмы могут иметь необходимость влиять на пищевое поведения хозяина с целью удовлетворения собственных нужд. Но следует разделять влияние, опосредованное побочными механизмами энергозатрат и дефицита калорий, и влияние паразита непосредственно на ЦНС.
Инфекционное ожирение — это ожирение, обусловленное влиянием инфекционного агента. У человека чаще всего выявляют Аденовирус-36 (у детей — Аденовирус-5), реже обнаруживают ассоциации с ЦМВ-инфекцией или случаи серопозитивного носительства токсоплазмы [6].
Основная причина развития ожирения при инфекции Аденовируса-36 закодирована в гене белка E4orfl, необходимого для репликации вируса, который приводит к активации дифференцировки преадипоцитов в адипоциты. Само собой, лица, серопозитивные по Аденовирусу-36, имеют больший шанс оказаться за гранью нормальной массы тела. Но здесь не все так просто. Лица с аденовирусным ожирением не имеют повышенного уровня холестерина и триглицеридов, свойственного людям с обычным ожирением. Ожирение при инфектоожирении — подкожное, а не абдоминальное. В чем причина?
Белок E4orfl в целях осуществления репликативной функции способствует активации GLUT-1-рецептора, деактивации IRS (insulin receptor substrate, субстрат инсулинового рецептора) и активации GLUT-4-рецептора через путь RAS-PI3K, таким образом предотвращая инсулинорезистентность. В основном глюкоза абсорбируется преадипоцитами, адипоцитами и миобластами. Снижение уровня холестерина и триглицеридов может быть обусловлено повышением уровня apoB и секрецией адипокинов жировыми клетками, инфицированными Аденовирусом-36. [7,8]
.
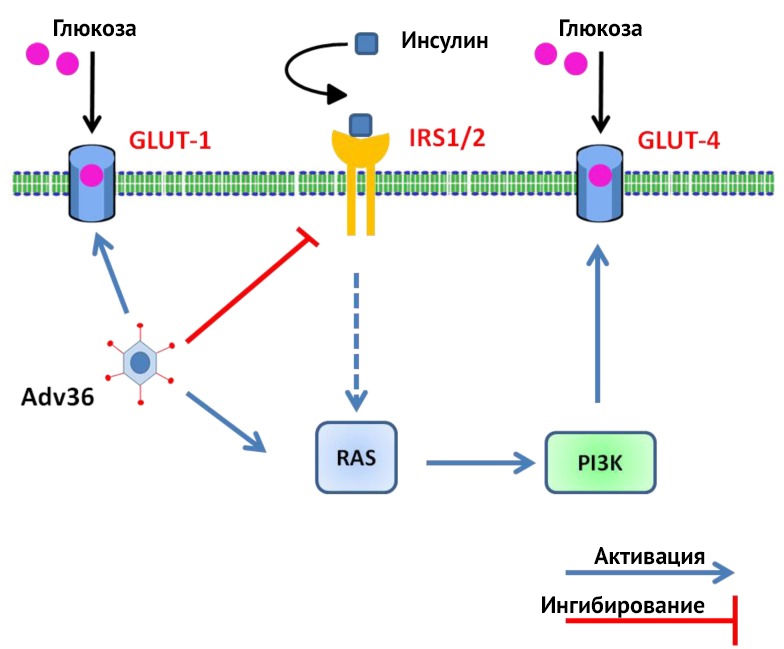
Рисунок 7 | Механизм профилактики инсулинорезистентности при инфицировании Аденовирусом-36 (Adv36)
Несмотря на эти положительные эффекты, инфекция остается хронической. Сниженное количество CD8+ и снижение/повышение количества CD4+ T-клеток приводит к нарушению элиминации возбудителя и поддержанию воспаления. Известно, что жировая ткань представляет собой не просто скопление жировых клеток, также в ее состав входит большое количество иммунных и соединительнотканных элементов. Аденовирус-36 способствует активации провоспалительных макрофагов М1. Также он активирует MCP-1 (макрофагальный хемоаттрактантный протеин-1), который опосредует инфильтрацию макрофагами адипоцитов и способствует секреции провоспалительных факторов и цитокинов. MCP-1 обусловливает ожирение, инсулинорезистентность и стеатоз. Миграция M1-макрофагов в жировую ткань поддерживает воспаление через активацию NF-kB (фактор транскрипции, вызывающий образование цитокинов и хемоаттрактантов, подавляющий апоптоз клеток), что приводит к прогрессированию ожирения.
С увеличением количества жировой ткани увеличивается и количество лептина, который секретируют адипоциты. Лептин подавляет голод через активацию ПОМК-нейронов на аркуатном ядре, увеличивая секрецию альфа-меланоцитстимулирующего гормона (aМСГ), и активирует меланоцитстимулирующий рецептор-4 (MC-4R), оказывая анорексигенный эффект.
В случае Аденовирус-36-ассоциированного ожирения уровень лептина снижен, как и уровень норэпинефрина, что тоже может способствовать активации поведения, направленного на поиск пищи, через снижение активности парабрахиального ядра (рис. 8) [9] .
.
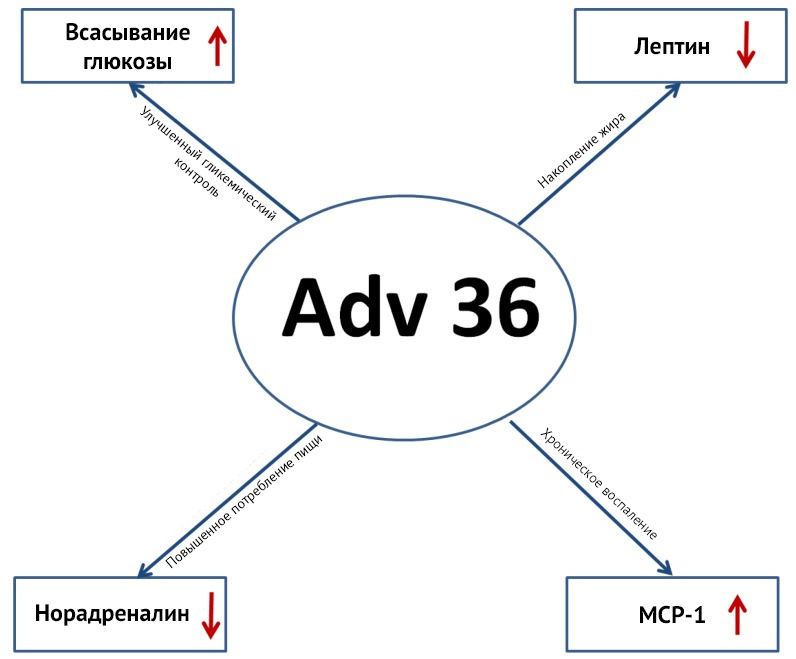
Рисунок 8 | Негативные проявления хронического персистирования в макроорганизме Аденовируса-36
Вирус Герпеса 1 типа и ЦМВ-инфекция действует похожим образом: длительное пребывание вирусов в адипоцитах способствует развитию воспаления, активации IFN каскада и подавлению выработки лептина [10].
Влиянию бактериофагов и микробиома кишечника на ЦНС посвящено множество исследований. Состояние микробиома отчасти влияет на развитие множества заболеваний, таких как депрессия, расстройства аутического спектра (РАС), тревожные расстройства, ожирение, функциональные гастроинтестинальные расстройства, синдром хронической усталости, воспалительные заболевания и т. д. [11] Продуктами метаболизма микробиоты являются нейромедиаторы и нейротропные факторы, способные воздействовать на ЦНС, что также подразумевает возможность микробиоты кишечника модулировать проницаемость интестинального барьера и ГЭБ. В некоторой степени воздействие на нейроэндокринную и нейроиммунную системы возможно через вагусную стимуляцию афферентных окончаний внутренностных нервов [12]. Здоровый биоценоз способствует сохранению когнитивных функций за счет поддержания постоянства концентрации BDNF (brain-derived neurotrophic factor, нейротрофический фактор мозга) в мозге, вероятно, путем передачи сигнала через афференты блуждающего нерва [13].
Учитывая наличие обратной связи, стрессорные факторы способны дестабилизировать микробиом и целостность интестинального барьера. Основной вклад в нарушение целостности интестинального барьера и развитие дисбиоза вносит КРГ (кортикотропин-рилизинг гормон) и его рецепторы — КРГР-1 и КРГР-2. Повышенная проницаемость кишечного барьера приводит к провоспалительному состоянию микробиоты, что в свою очередь ведет к высвобождению множества цитокинов, серотонина, MAMPs (микроб-ассоциированные молекулярные паттерны), активации TLR и последующего воспалительного каскада. Стоит отметить, что хотя серотонин и приводит к усилению локального воспаления и повышению проницаемости интестинального барьера, его концентрация значительно снижается ввиду перехода метаболизма триптофана на кинурениновый путь (рис. 9).
.
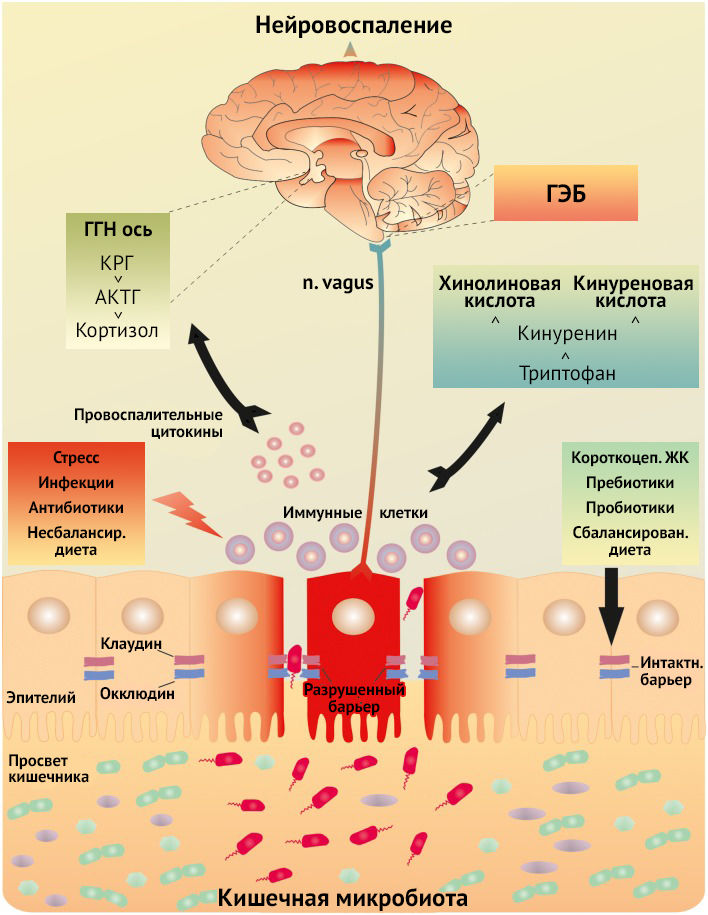
Рисунок 9 | Повышение проницаемости гематоинтестинального барьера и реализация провоспалительного каскада реакций, нарушение нормального функционирования связи кишечник-мозг
Микробиом кишечника различается в зависимости от пищевых привычек человека. К примеру, бактерии рода Prevotella лучше всего растут на углеводах, пищевые волокна обеспечивают рост и развитие Bifidobacteria, а Bacteroides предпочитают определенные жиры. Некоторые специализированные бактерии, например, муцин-деградирующие Akkermansia mucinophila, процветают на секретируемых клетками хозяина углеводах. Другие — бутират-продуцирующие микробы, такие как Roseburia spp, куда лучше растут при употреблении в пищу полисахаридных субстратов. Определенные микробы, переваривающие водоросли, были найдены только у лиц, проживающих в Японии. Африканские дети, питающиеся сорго, имеют уникальные бактерии, расщепляющие целлюлозу.
Бактерии способны управлять пищевым поведением человека [14]. Это может быть обусловлено высвобождением нейромедиаторов и/или передачей сигнала по афферентам блуждающего нерва, что приводит к активации орексигенных центров. Стоит отметить, что отдельные исследования отмечают снижение массы тела в случае патологического ожирения при блокаде афферентных волокон n. vagus. Возможно, это как-то связано с моделированием сигнала от нарушенной микробиоты, при котором не формируется отвращения к еде. Кроме того, управление пищевым поведением обусловлено активацией системы вознаграждения через высвобождение продуктов метаболизма (дофамина и серотонина) определенными бактериями при употреблении определенного вида пищи (рис. 10).
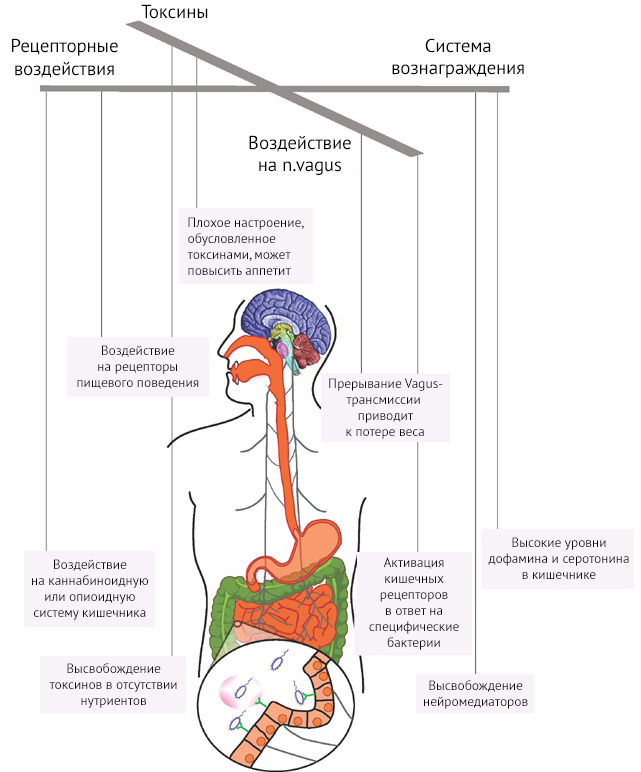
Рисунок 10 | Механизмы воздействия микробиома кишечника на ЦНС
Следующий персонаж не подает внешних поводов для беспокойства. Угроза может быть пушистой и милой, либо лысой и несимпатичной (субъективное мнение автора). Сами того не ведая, они становятся распространителями паразитов, случайным образом забредших в организм человека.
Наверняка уже все понятно. Речь пойдет о токсоплазме.
Токсоплазмоз
Способность этого паразита специфически воздействовать на поведение хозяина, в том числе человека, привлекает внимание множества ученых и обывателей, следящих за научными открытиями.
Конечно, кроме токсоплазмы, другие латентные инфекции тоже способны воздействовать на поведение человека, повышать вероятность развития психических заболеваний, снижать когнитивные функции. Но наибольший интерес вызывает именно специфическое воздействие токсоплазмы гонди, формирующей полезное для себя поведение хозяина. А может, это вовсе не паразитизм, а нечто взаимовыгодное?
Я довольно негативно отозвался о кошках, ведь в принципе токсоплазма способна паразитировать на всех теплокровных животных в большей или меньшей степени. Однако именно кошки, поедая зараженных мышей, становятся постоянными хозяевами паразита, выделяя с фекалиями ооцисты, которые могут попасть в организм человека.
Токсоплазма способна вызывать у своего промежуточного хозяина повышенную двигательную активность, агрессивное поведение, уменьшение страха, а также формировать тропность крысы к запаху кошачьей мочи, тем самым увеличивая вероятность быть съеденной (чтобы паразит смог попасть в кишечник окончательного хозяина).
Удивительно и то, что механизмы, лежащие в основе такого поведения, повышают шансы зараженных самцов на спаривание. У крыс токсоплазмоз передается еще и половым путем. Общий механизм, ведущий как к снижению уровня страха, так и к росту привлекательности среди самок — повышенный уровень тестостерона.
Токсоплазма способствовала экспрессии рецепторов лютеинизирующего гормона на клетках Лейдига, приводя к повышению уровня тестостерона у крыс, но не у мышей, у которых, напротив, уровень тестостерона снижался относительно здоровых особей (рис. 11) [15].
В ЦНС у животных, в частности у крыс, токсоплазму обнаруживают в области миндалевидного тела. Эта структура ответственна за реакцию на стресс («бей или беги»), а также за запоминание стрессора. Паразит находится в астроцитах и нейронах, пораженные нейроны синтезируют большее, нежели у здоровых особей, количество дофамина [16]. Латентная инфекция приводит к нарушениям в работе цикла вознаграждения, стимулируя зараженного к поиску новых ощущений, увеличивая риск импульсивного поведения и суицида [17].
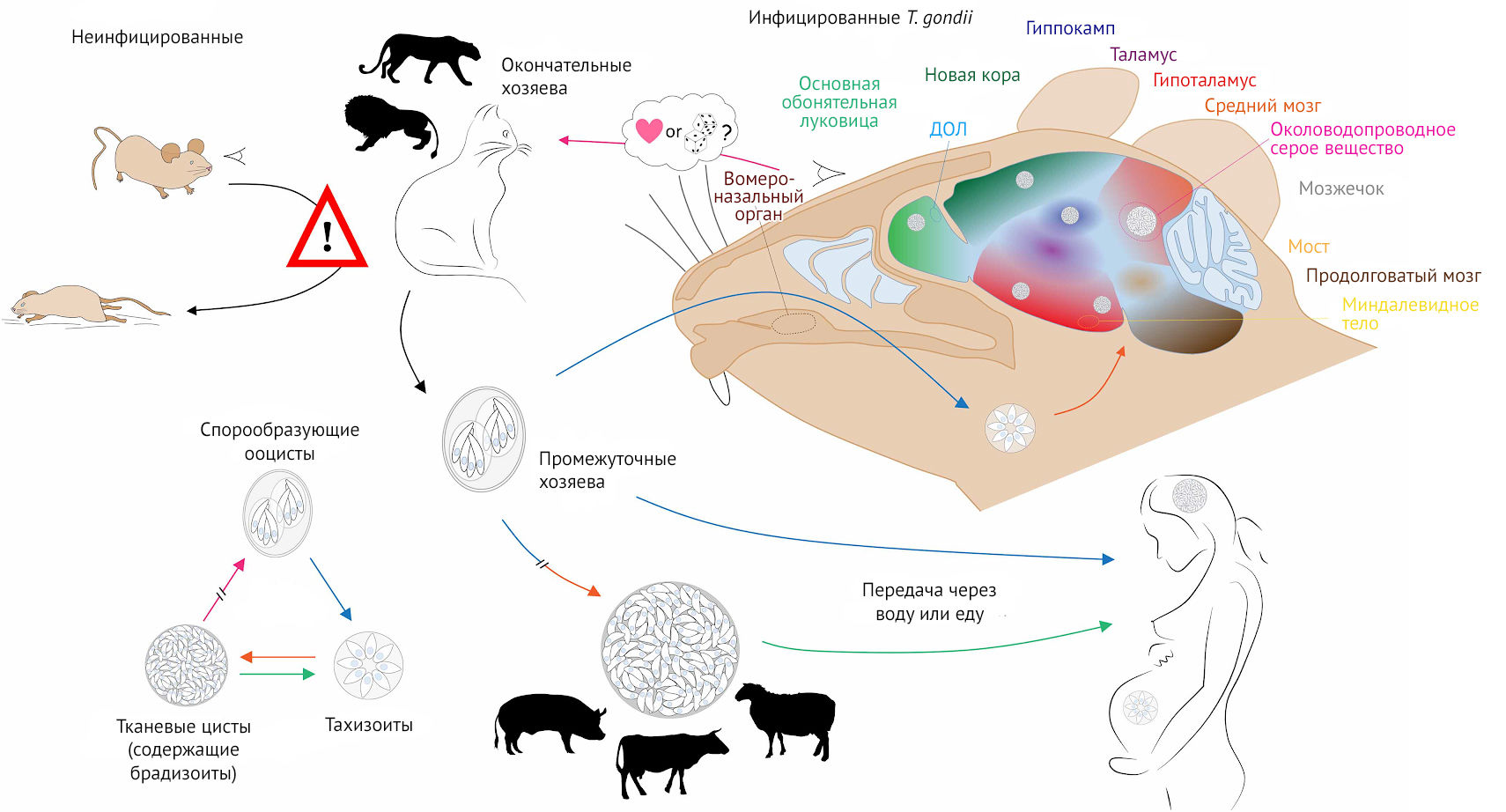
Рисунок 11 | Как видно из иллюстрации, цисты в головном мозге распределены случайно, высокая плотность часто отмечается в коре, гиппокампе, миндалине и дополнительной обонятельной луковице (ДОЛ). Гиппокамп ответственен за пространственное и контекстуальное обучение, миндалина — за формирование страха и тревоги, а ДОЛ участвует в обонянии
Хотя для токсоплазмы человек является тупиком (ибо домашнему коту все же трудно съесть человека), в случае с приматами дело обстоит иначе. Шимпанзе, у которых определяется носительство токсоплазмы, чаще, чем здоровые особи, попадают в пасть леопардам. Объясняется это тем же, чем и поведение крыс, зараженных токсоплазмой (они двигаются на запах мочи кошек). Поедая больных приматов, леопарды становятся постоянными хозяевами для токсоплазм [18].
Заключение
Поскольку человеческий мозг достаточно сложен, некорректно воспринимать воздействие микроорганизмов на него как такую же манипуляцию в мире насекомых. Пищевое поведение может быть скорректировано силой воли, импульсивность и агрессивное поведение — сдержанностью, рационализацией, тщательным анализом ситуации. Однако вышеописанные микроорганизмы не вошли бы в список манипуляторов, если бы не изменяли поведение человек в свою пользу.
Стоит понимать, что для непосредственного управления поведением необходимо длительное взаимодействие определенного вида микроорганизма с определенным видом макроорганизма. Конечно, в долгосрочной перспективе токсоплазмоз, дисбаланс микрофлоры кишечника, латентная вирусная инфекция приводят к негативным последствиям, а врожденные состояния либо болезнь матери во время беременности повышают риск развития множества заболеваний (в т. ч. психических и неврологических) [19]. Однако достоверно неизвестно, могли ли во времена древнего человека, в краткосрочной перспективе проявиться признаки, ведущие к повышению выживаемости вида (как у некоторых млекопитающих, о которых мы говорили ранее).
Источники:
- https://www.londonntd.org/
- https://ferrebeekeeper.wordpress.com/
- David P. Hughes et al. Neuroparasitology of Parasite–Insect Associations //Annual Review of Entomology. - January 2018.
- Frederic Libersat, Maayan Kaiser, Stav Emanuel. Mind Control: How Parasites Manipulate Cognitive Functions in Their Insect Hosts // Frontiers in Psychology. - 2018.
- James J DiNicolantonio, James H O’Keefe, William L Wilson. Sugar addiction: is it real? A narrative review // British Journal of Sports Medicine. - 2018.
- Voss JD, Dhurandhar NV. Viral Infections and Obesity // Current obesity reports. - 2017.
- Dhurandhar EJ, Krishnapuram R, Hegde V, Dubuisson O, Tao R, Dong XC, Ye J, Dhurandhar NV. E4orf1 improves lipid and glucose metabolism in hepatocytes: a template to improve steatosis & hyperglycemia // PLoS One. - 2012
- Eleonora Ponterio and Lucio Gnessi. Adenovirus 36 and Obesity: An Overview // Viruses. - 2015.
- Wellman PJ. Norepinephrine and the control of food intake // Nutrition. - 2000.
- Yu L, Liu P, Liu Z, Zhu W, Yan K, Chen Q, Han D. p204-Mediated innate antiviral responses in mouse adipose cells and their effects on cell functions // Immunology and cell biology. - 2015.
- Glenda MacQueen, Michael Surette and Paul Moayyedi. The gut microbiota and psychiatric illness // Journal of psychiatry & neuroscience. - 2017.
- Kelly, J. R., Kennedy, P. J., Cryan, J. F., Dinan, T. G., Clarke, G., & Hyland, N. P.. Breaking down the barriers: the gut microbiome, intestinal permeability and stress-related psychiatric disorders // Frontiers in cellular neuroscience. -2015.
- Maqsood R, Stone TW. The Gut-Brain Axis, BDNF, NMDA and CNS Disorders // Neurochemical research. - 2016.
- Alcock, J., Maley, C. C., & Aktipis, C. A. Is eating behavior manipulated by the gastrointestinal microbiota? Evolutionary pressures and potential mechanisms // BioEssays : news and reviews in molecular, cellular and developmental biology - 2014.
- Ajai Vyas. Parasite-augmented mate choice and reduction in innate fear in rats infected by Toxoplasma gondii // Journal of Experimental Biology. - 2013.
- Ann-Kathrin Stock, Danica Dajkic, Hedda Luise Köhling, Evelyn Heintschel von Heinegg, Melanie Fiedler & Christian Beste. Humans with latent toxoplasmosis display altered reward modulation of cognitive control // Nature Scientific Reports. - 2017
- Thomas B.Cook, et al. «Latent» infection with Toxoplasma gondii: Association with trait aggression and impulsivity in healthy adults // Journal of Psychiatric Research. -
2015. - Poirotte C, Kappeler PM, Ngoubangoye B, Bourgeois S, Moussodji M, Charpentier MJ. Morbid attraction to leopard urine in Toxoplasma-infected chimpanzees // Current Biology. - 2016.
- Hadar R, et al. Deep brain stimulation during early adolescence prevents microglial alterations in a model of maternal immune activation // Brain, behavior and immunity. - 2017.
