Онкологические аспекты гиперпластических процессов эндометрия

Гиперплазия — это увеличение количества клеток без увеличения их размеров. Гиперпластические процессы могут предшествовать развитию онкологического заболевания. Гиперплазия эндометрия — одна из форм патологических пролиферативных изменений эндометрия, с преимущественной пролиферацией железистого компонента по сравнению со стромальным компонентом [1].
Существует гистологическая классификация гиперпластических процессов эндометрия, предложенная ВОЗ (2014) [2]:
- гиперплазия без атипии (железисто-кистозная гиперплазия эндометрия);
- атипичная гиперплазия: аденоматоз, диффузная или очаговая аденоматозная гиперплазия, аденоматозные полипы;
- полипы эндометрия: железистые, железисто-кистозные, железисто-фиброзные.
Гиперплазия эндометрия без атипии — это пролиферация с изменением строения желез и клеток, но без клеточной атипии. Изменения в строении обычно видны при малом увеличении, но важной особенностью, которая определяет прогноз и возможность малигнизации — это клеточная атипия. Все типы гиперплазии характеризуются увеличением отношения железы к строме, неравномерностью формы железы и изменением размера железы (рис. 1 а и б). При гиперплазии без атипии железистый эпителий напоминает пролиферирующий эндометрий (рис. 1 б). Клетки столбчатые с амфофильной цитоплазмой и имеют псевдостратифицированные ядра, ориентированы к базальной мембране и имеют овальную форму с гладкими контурами, равномерно распределенный хроматин и небольшие незаметные ядрышки. Митотическая активность может быть переменной и может быть меньше, чем в пролиферирующем эндометрии. Частота митоза не влияет на диагноз [5].
Как правило, гиперплазия диффузная, но может быть очаговой из-за локальных различий в содержании рецепторов эстрогена и прогестерона в эндометрии. При простой гиперплазии присутствует строма в значительном объеме. Строение стромы напоминает нормальное, характерное для пролиферативной фазы, строма состоит из маленьких овальных клеток со скудной цитоплазмой. Как и в железах, в строме отмечена митотическая активность. Когда гиперплазия является полипоидной, строма может содержать артерии с толстой стенкой, подобные тем, которые наблюдаются в полипах. По мере прогрессирования гиперплазии железы располагаются более тесно. Обычно железы плотно прилегают друг к другу, хотя всегда присутствует небольшое количество стромы между ними [5].
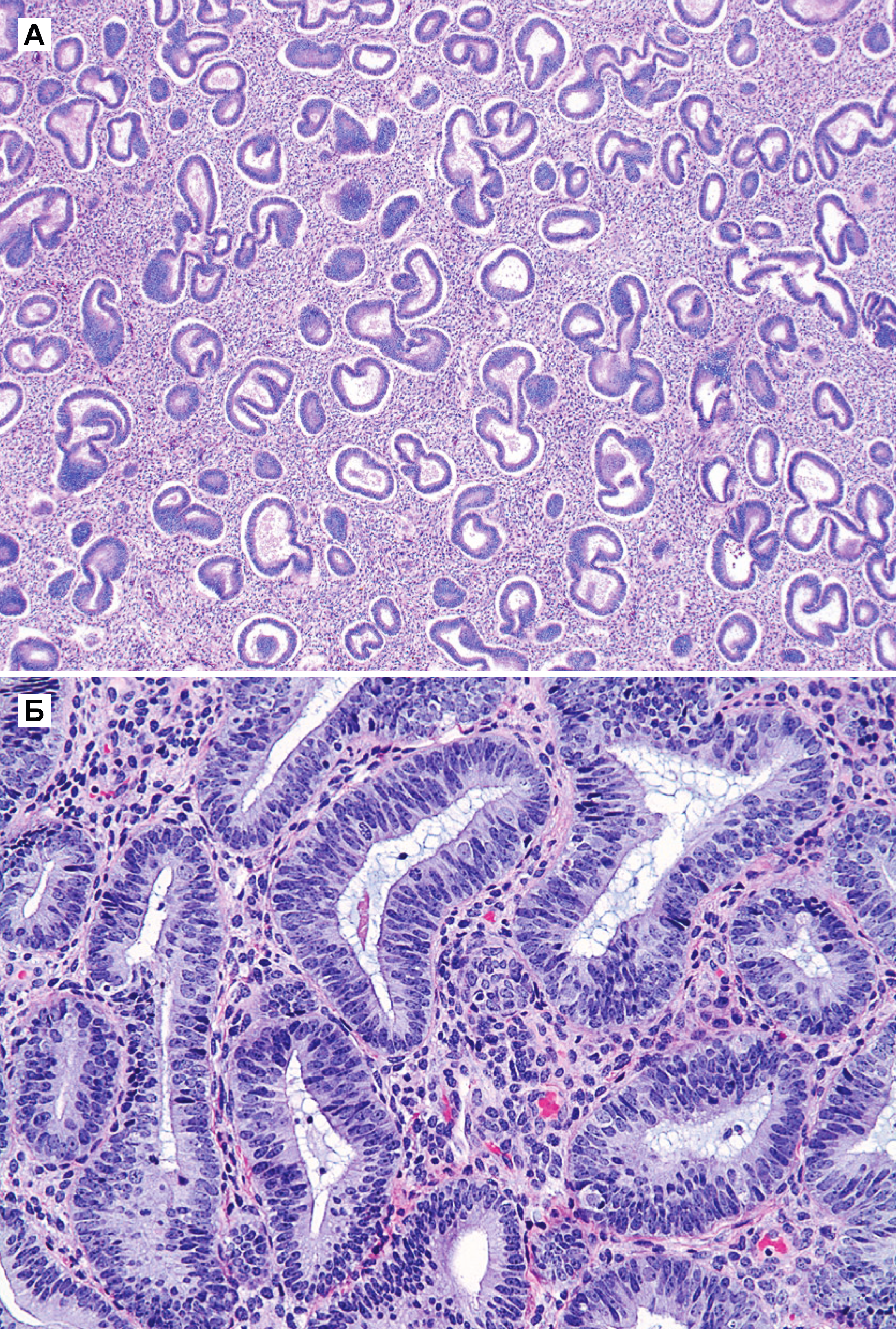
б) Ядра железистых клеток имеют овальную форму, псевдостратифицированы и с однородными контурами, признаков клеточной атипии нет, ядра ориентированы к базальной мембране. Ядрышки нечеткие. Как железистые, так и стромальные клетки имеют сходное строение с клетками эндометрия в пролиферативной фазе. Видно несколько митотических фигур.
К предраковым заболеваниям эндометрия относятся [2]:
- атипическая гиперплазия эндометрия (аденоматоз и аденоматозные полипы);
- рецидивирующая железистая гиперплазия эндометрия.
Эндометрий — мишень половых гормонов, так как эта ткань имеет специфические рецепторы. Клетки эндометрия обновляются ежемесячно под влиянием гормональной регуляции. Нарушение гормонального статуса женщины может изменять рост и дифференцировку клеток. Поэтому могут возникнуть гиперпластические процессы [2].
Причины [2]:
- нарушение центральной регуляции репродуктивной системы, вызывающие недостаточность лютеиновой фазы и ановуляция;
- гиперпластические процессы и гормональные опухоли яичников;
- нарушения тканевой рецепции и метаболизма половых гормонов;
- болезни обмена и эндокринной системы (СД, ожирение);
- заболевания гепатобиллиарной системы, ЖКТ, иммунной системы и щитовидной железы.
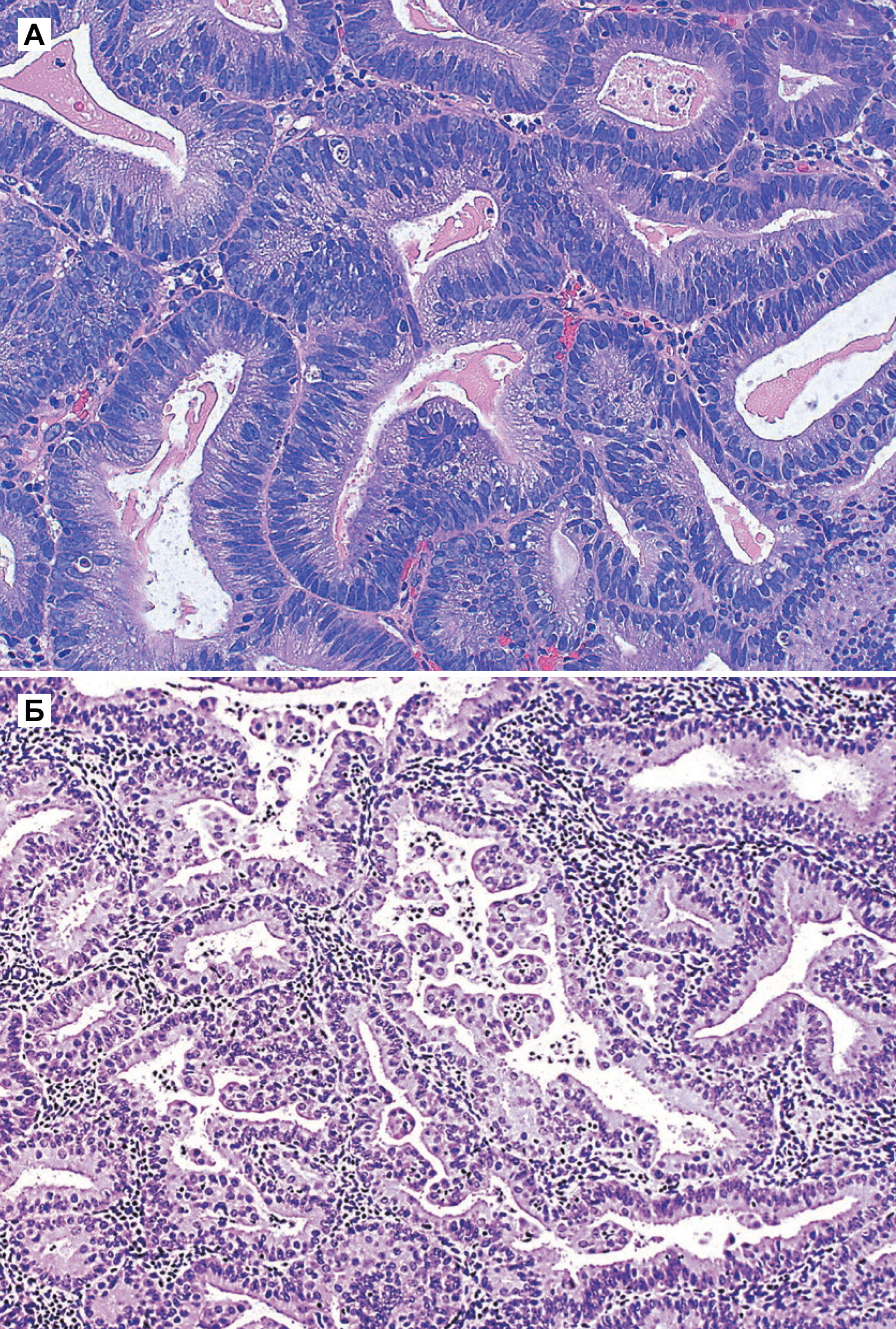
б) Железы близко расположены, но каждая железа окружена стромой с базальной мембраной. Папиллярные пучки эозинофильных клеток проецируются в просвет многих желез. В строме отмечается плотный воспалительный инфильтрат.
Атипичная гиперплазия отличается наличием ядерной атипии и сложным строением с тесно расположенными железами. Железы обычно неправильной формы и размера. Каждая железа имеет базальную мембрану, окруженную тонким слоем стромы, отделяющей его от соседних желез. Однако в некоторых случаях железы расположены далеко друг от друга. Встречаются как железы без клеточной атипии, так и атипичные [5].
Специфические особенности при атипичной гиперплазии включают: стратификацию, увеличение размера ядер с измененным хроматином и ядрышками. В ядрах отмечена истинная стратификация (2–4 слоя), и потеря ориентирования к базальной мембране [5].
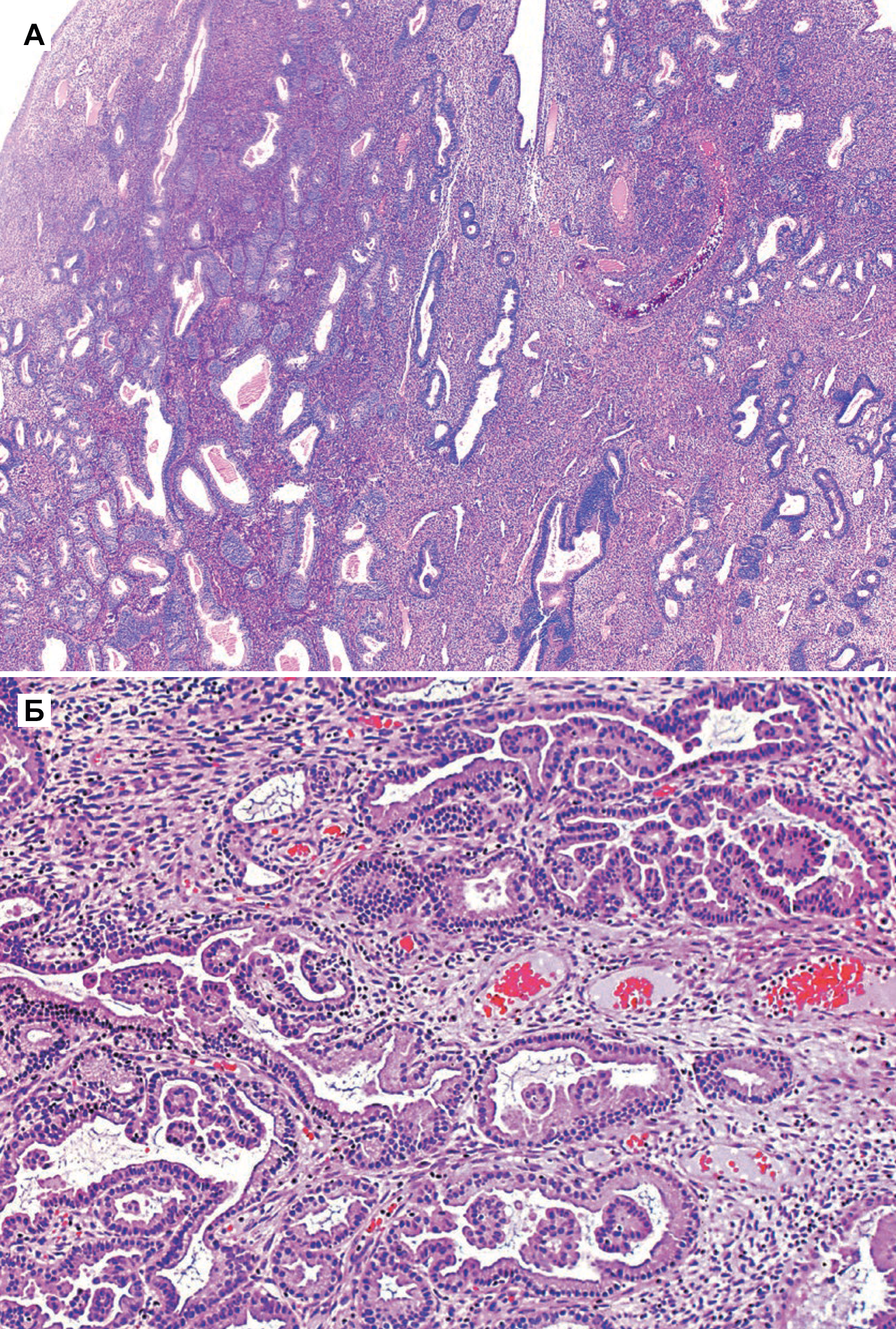
б) Очаговая пролиферация в доброкачественном полипе эндометрия. В просвете небольшие папиллярные пучки. Атипии нет.
На фоне гиперпластических процессов в эндометрии, возникающих при длительной пролиферации желез эндометрия без перехода их в секреторную фазу, может развиваться рак тела матки (РТМ) — это злокачественная опухоль, происходящая из слизистой оболочки тела матки (эндометрия). Чаще всего РТМ носит спорадический характер, и в 5 % случаев РТМ ассоциирован с наследственными синдромами, например, с синдромом Линча. Среди факторов риска: гиперэстрогения, ранние менархе, отсутствие родов в анамнезе, поздняя менопауза, возраст старше 55 лет, применение тамоксифена [3].
Эпидемиология РТМ
РТМ — самая частая злокачественная опухоль женских половых органов в развитых странах и вторая по частоте после рака шейки матки злокачественная опухоль женских половых органов в мире. В США в 2015 г. зарегистрировано более 54800 новых случаев заболевания РТМ, и более 10150 смертей от этого заболевания. В России ежегодно регистрируется более 21 тысячи больных РТМ. В структуре заболеваемости женского населения в России в 2016 г. РТМ занимал 3-е ранговое место (7,7 %). Средний возраст заболевших РТМ в России составляет 62,6 года [3,4].
Патогенез
Развитие РТМ обусловлено гиперэстрогенией, основной причиной которой является нарушение овуляции. Клиническое изучение метаболических нарушений у больных раком тела матки и морфологические особенности рака эндометрия позволили обосновать концепцию о двух основных патогенетических вариантах заболевания [2].
I тип (более частый). Опухоль развивается в более молодом возрасте, в отличие от пациенток II патогенетического варианта, на фоне длительной гиперэстрогении и гиперплазии эндометрия. У больных РТМ I патогенетического типа часто наблюдаются ожирение, сахарный диабет и гипертоническая болезнь, возможны эстрогенсекретирующие опухоли яичников или синдром склерокистозных яичников. Опухоли I патогенетического варианта, как правило, высокодифференцированные, имеют более благоприятный прогноз [2].
II тип. Опухоли эндометрия обычно низкодифференцированные, имеют менее благоприятный прогноз. Опухоли II патогенетического типа возникают в более старшем возрасте, в отсутствие гиперэстрогении, на фоне атрофии эндометрия. Примерно у 80% больных РТМ диагностируют эндометриоидную аденокарциному [2].
Выделяют три степени дифференцировки аденокарциномы эндометрия [2]:
G1 — высоко дифференцированная;
G2 — умеренно дифференцированная;
G3 — низко дифференцированная или недифференцированная.
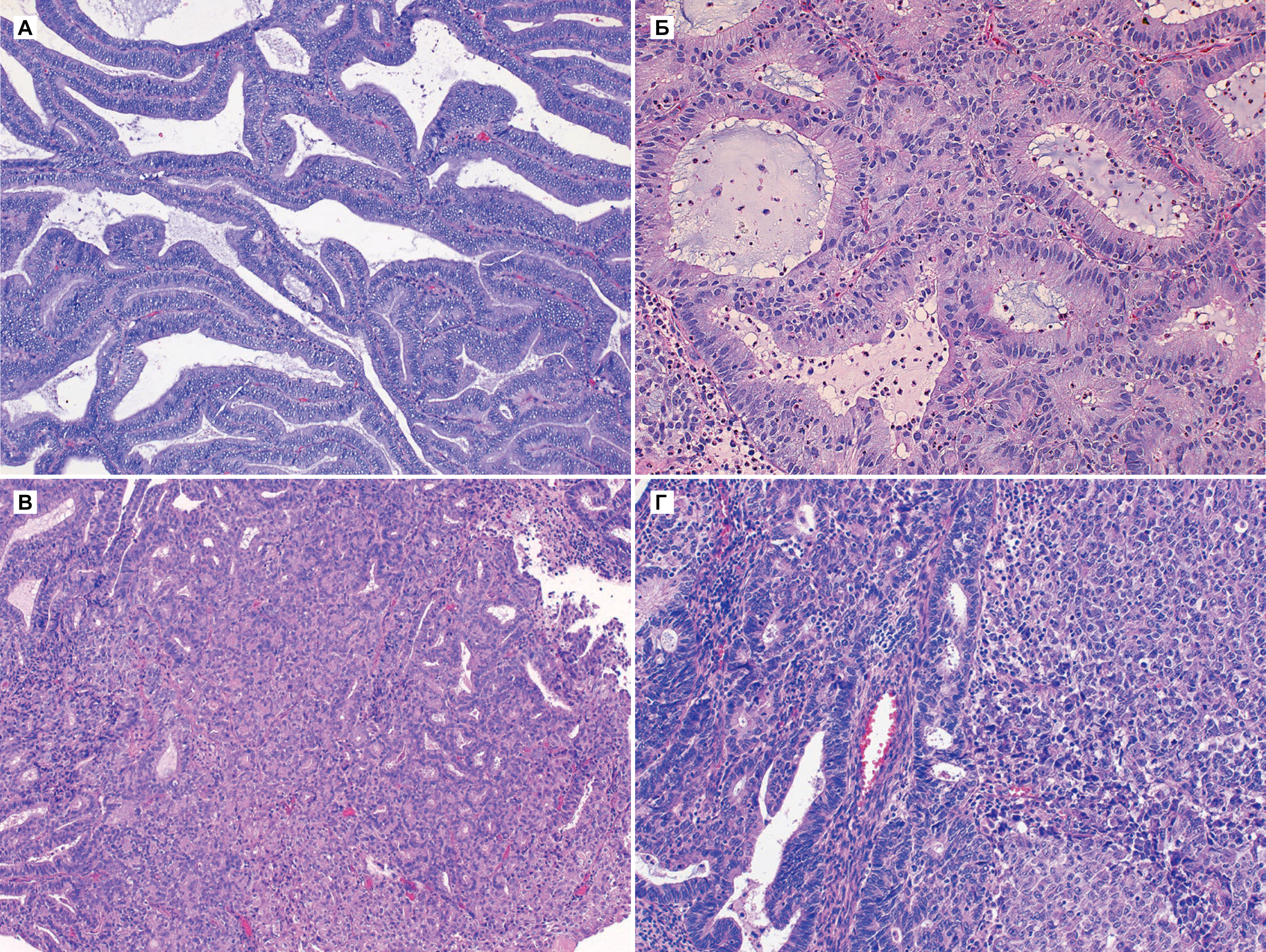
В новообразовании видны хорошо сформированные железы, иногда они сливаются. Ядра с минимальным плеоморфизмом, небольшими ядрышками и низкой скоростью митоза.
б) Железы смыкаются, хотя контуры некоторых желез все еще можно проследить. Это свидетельствует о нарушении стромы
в) Эндометриоидная карцинома, G2. Несмотря на то, что прослеживается дифференцирование желез, в значительной части (примерно 30 %) опухоли наблюдается устойчивый рост.
г) Эндометриоидная карцинома, G3. Присутствует несколько желез, более 50 % клеток опухоли характеризуются устойчивым ростом злокачественных эпителиальных клеток.
Клиника
Ранний симптом прогрессирования рака эндометрия — появление жидких водянистых белей, нередко с примесью крови, и зуда наружных половых органов. Кровянистые выделения из половых путей бывают в виде мажущих серозно-кровянистых выделений, которые становятся порой обильными. Кровотечение, как правило, контактное или появляется после физической нагрузки [2].
Возможны боли внизу живота, которые на ранних стадиях рака носят схваткообразный характер. Это связано с сокращениями эндометрия и опорожнением матки от скопившейся в ней крови или гноевидной жидкости (гематометра, пиометра), отток которой в результате обтурации внутреннего зева затруднен. После таких схваткообразных болей появляются обильные выделения из матки — гной и кровь. При поздних стадиях боли постоянные, особенно интенсивные по ночам, связаны со сдавлением раковым инфильтратом нервных сплетений в малом тазу. При переходе процесса на мочевой пузырь и прямую кишку появляются симптомы нарушения функционирования этих органов [2].
Хирургическое вмешательство рекомендуется как наиболее эффективный метод лечения РТМ независимо от стадии как самостоятельно, так и в комбинации с другими методами [6].
Список литературы:
- Gallos I. D. et al. Management of Endometrial Hyperplasia. Green-top Guideline No. 67. – 2016.
- Радзинский В.Е. Гинекология// под ред. В.Е. Радзинского, А.М. Фукса — М.:ГЭОТАР-Медиа, 2016. — 1000 с.
- Siegel RL., Miller KD., Jemal A. Cancer statistics, 2015. // CA Cancer J Clin. – 2015. – V. 65, N 1. – P. 5–29.
- Каприн А.Д., Старинский В.В., Петрова Г.В. Злокачественные новообразования в России в 2016 г. (заболеваемость и смертность) // М.: МНИОИ им. П.А.Герцена – филиал ФГБУ «НМИЦ радиологии» Минздрава России, 2018. 250 с.
- Murdock T. A. et al. Precursors of Endometrial Carcinoma //Diagnosis of Endometrial Biopsies and Curettings. – Springer, Cham, 2019. – С. 225-259.
- Amanta F., Mirzab M., Creutzbergc C. FIGO cancer report 2012. Cancer of the corpus uteri. // Int J Gynecol Obstet. – 2012. – V. 119, S 2. – P. S110–S117.
