Cancer survivors: беременность после противоопухолевой терапии
Прошли времена, когда диагноз онколога становился смертным приговором. Выживаемость среди онкобольных растет, и стало возможным то, что еще несколько десятилетий назад казалось чудом — девочки доживают до репродуктивного возраста, а женщины после лечения злокачественных новообразований вынашивают и рожают детей. Но не стоит забывать, что агрессивная терапия так или иначе воздействует на все органы и системы, включая репродуктивную, а риск рецидива во время вынашивания ребенка выше, чем в любой другой период жизни женщины. Так чем же станет беременность: радостным событием или новым испытанием?
Изначально следует определиться с исходными данными: возрастом пациентки, характеристиками опухолевого процесса, характером и объемом полученной терапии.
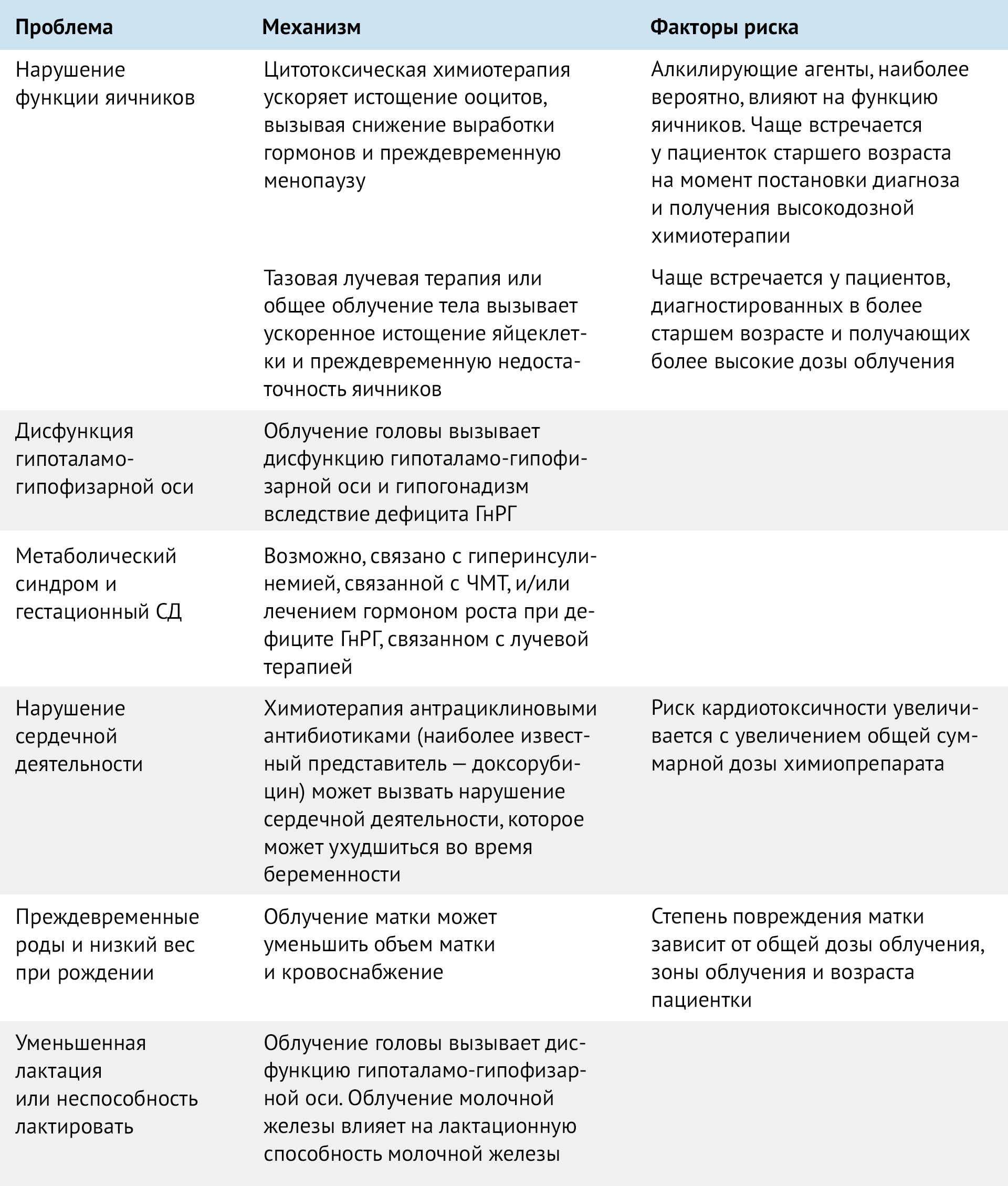
Облучение матки в детском возрасте может привести к нарушениям ее роста и кровообращения, при этом тяжесть нарушений коррелирует с возрастом девочки — чем она младше, тем тяжелее повреждения. Кроме того, облучение брюшной полости в детском возрасте увеличивает риск осложнений и неблагоприятных исходов беременности, что связывают уменьшенным размером матки, нарушением маточного кровотока и сократимости миометрия. Облучение яичников и токсическое воздействие химиопрепаратов сокращают овариальный резерв, а облучение головного мозга повреждает гипоталамо-гипофизарную систему, что приводит к задержке полового развития и нарушению менструального цикла.
Фертильность пациенток старше 30 лет снижается даже на фоне полного здоровья женщины за счет естественного истощения овариального резерва. Химиотерапия и лучевая терапия для этой группы женщин являются отягчающим фактором, приводящим к бесплодию. В целом, по сравнению с общей популяцией, у женщин на 38 % меньше вероятность забеременеть после диагностики и лечения рака, причем все диагностические группы рака связаны со снижением вероятности последующих беременностей.
Таблица 1 | Механизмы снижения фертильности после лечения ЗНО
Минимизируем риск
В случае с опухолями яичников следует оценить возможность сохранения овариальной ткани. Для опухолей с низким потенциалом злокачественности допустимо использование цистэктомии, т.е иссечение измененного участка яичника. В некоторых случаях возможно проведение односторонней овариоэктомии, однако данные об эффективности данного метода для сохранения фертильности противоречивы. Не стоит забывать о том, что любое хирургическое вмешательство может повлечь за собой развитие спаечного процесса, что негативно повлияет на репродуктивную функцию.
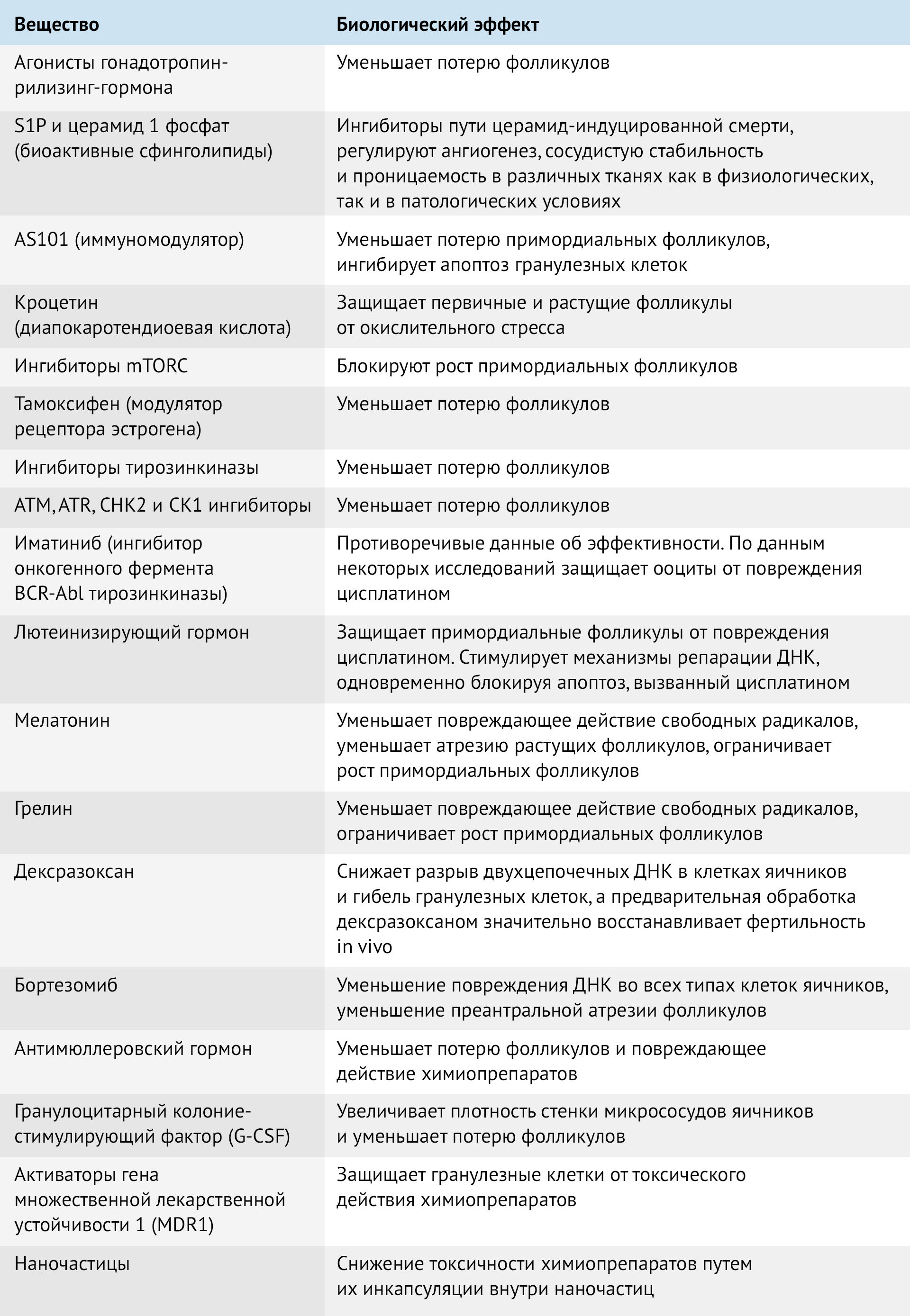
Активно ведутся исследования препаратов, защищающих репродуктивную систему во время химиотерапии. Большинство находится на стадии исследования на животных моделях и лишь немногие применяются в клинической практике. Агонисты гонадотропин-рилизинг-гормона хорошо проявили себя в период терапии рака молочной железы, способствуя сохранению примордиальных фолликулов и функции яичников.
.
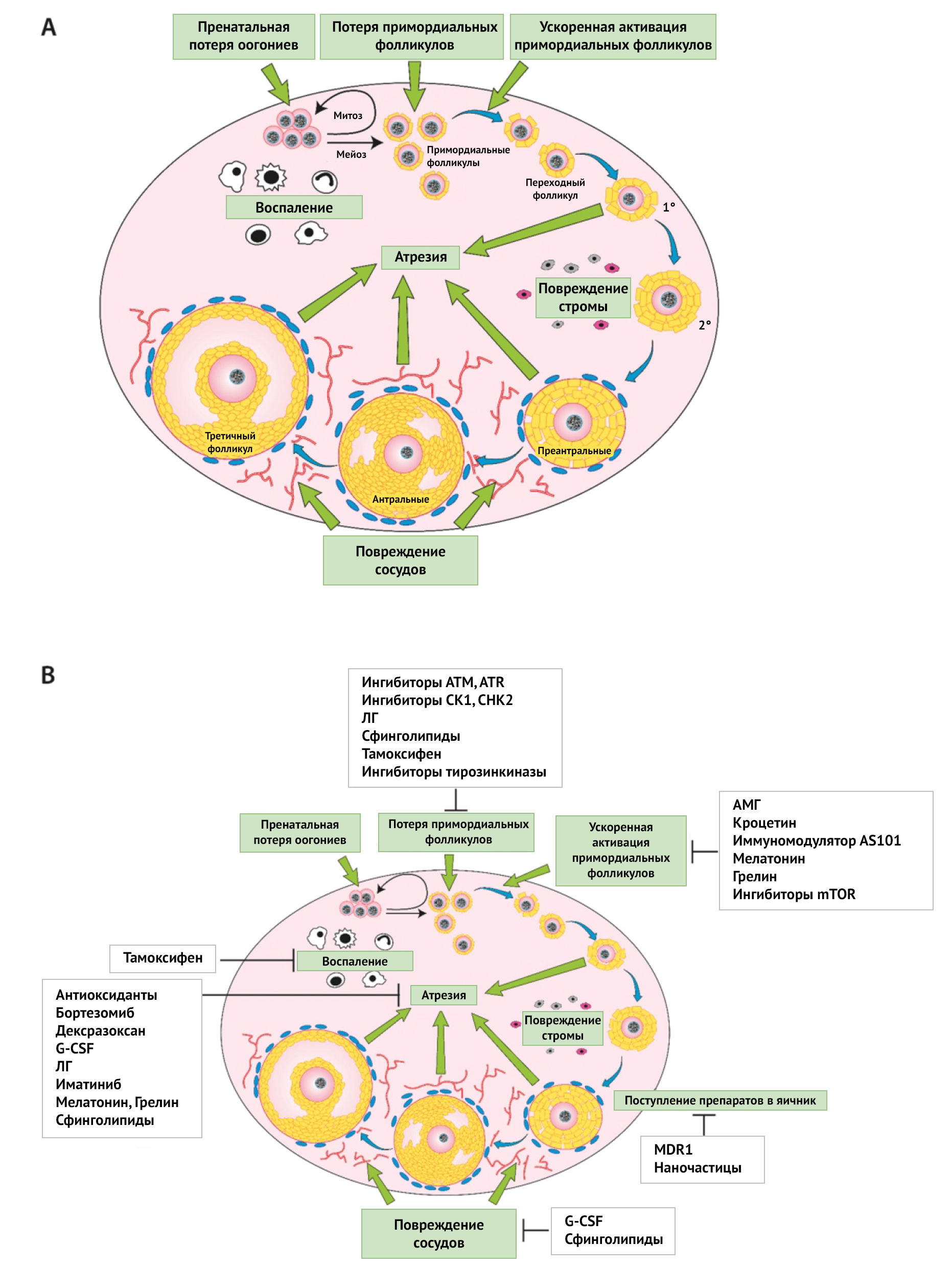
Рисунок 1 | Повреждающее действие химиотерапевтических препаратов на яичники и потенциальные защитники от повреждения
Таблица 2 | Биологические эффекты препаратов для улучшения фертильности у женщин с ЗНО
Важная роль вспомогательных репродуктивных технологий
Когда речь идет о лечении взрослых женщин, самым надежным методом сохранить фолликулярный резерв является криоконсервация фолликулов или ткани яичника перед началом терапии. Тактика зависит от особенностей опухоли, если мы имеем дело с гормон-зависимой опухолью, например, раком молочной железы, использование протокола стимуляции яичника перед заморозкой ооцитов может стимулировать рост опухоли за счет повышения уровня эстрадиола. Для пациенток с гормон-зависимых опухолями существуют отдельные, «мягкие» протоколы стимуляции гонадотропинами вместе с ингибиторами ароматазы или антагонистами гонадотропин-рилизинг-гормона (ГнРГ), что позволяет получить необходимое количество фолликулов с минимальным повышением уровня эстрогенов. Следует учитывать, что проведение стимуляции занимает в среднем 2-4 недели, в течение которых пациентка не будет получать лечение, что в некоторых случаях является непозволительной роскошью.
Для всех женщин, независимо от особенностей опухоли, доступна криоконсервация коркового слоя яичника, полученного с помощью лапароскопии. Криоконсервация ткани яичника с целью будущей трансплантации не требует применения протоколов стимуляции и может быть выполнена немедленно. Этот способ позволяет сохранить пул примордиальных фолликулов и восстановить функцию яичников путем аутотрансплантации. Методика до сих пор находится в статусе экспериментальной, но есть данные об удачной беременности после трансплантации, в том числе беременности в естественном цикле.
Для детей препубертатного возраста единственным вариантом сохранить фертильность является криоконсервация ткани яичника, ввиду невозможности проведения у них стимуляции овуляции, девочкам старшего возраста доступны любые способы.
.
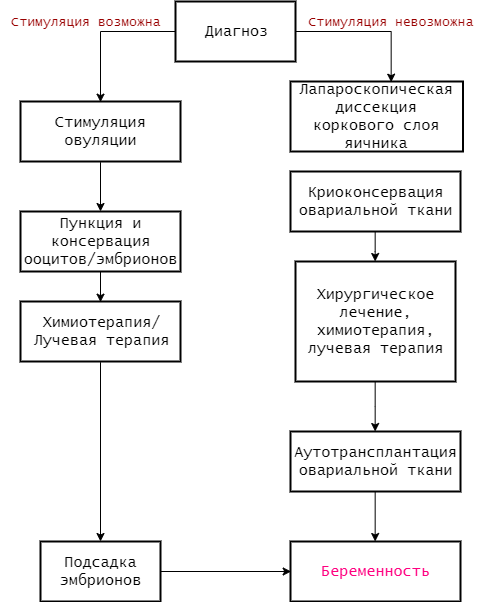
Рисунок 2 | Возможности вспомогательных репродуктивных технологий у пациенток с диагностированным злокачественным новообразованием
Ждать ли рецидива?
Несмотря на существующий стереотип, что беременность повышает риск рецидива, множество исследований неоднократно его опровергли. Беременность, отягощенная злокачественным новообразованием, считается довольно редкой проблемой, встречающейся в 1 случае на 1000 беременных. Ввиду неосведомленности, беременность у таких пациенток часто прерывается, несмотря на возможность выносить и родить ребенка совместно с лечением.
В случае рецидива возможно ведение беременности совместно с противоопухолевой терапией. Беременной женщине доступны все варианты хирургического лечения, тем не менее стоит учитывать повышенный риск выкидыша в первом триместре и преждевременных родов.
Лучевая терапия допустима в случае нарушения кровоснабжения в бассейне верхней полой вены, компрессии спинного мозга, метастазов в ЦНС. При тщательном планировании возможно использование ЛТ в области головы, шеи, конечностей и груди, при условии адекватного экранирования.
Большинство химиотерапевтических средств имеют низкую молекулярную массу и проникают через плаценту, оказывая тератогенное действие на плод. Использование ХТ в течение первых двух недель после зачатия может повлиять на имплантацию и привести к выкидышу, однако, поскольку клетки плода в этот период не дифференцированы и тотипотентны (период «все или ничего»), наиболее вероятно, что он будет развиваться без существенных отклонений. Со второй по восьмую неделю беременности происходит органогенез, критическая фаза, с быстрой дифференцировкой и высокой уязвимостью тканей к тератогенам. Воздействия в этот период вызывают серьезные пороки развития чаще, чем в любой другой период беременности, поэтому ХТ должна быть отложена до второго триместра. Химиотерапия во втором и третьем триместре считается относительно безопасной. Несмотря на отсутствие увеличения частоты пороков развития, акушерские и неонатальные осложнения могут возникать чаще, и следует проводить тщательный мониторинг беременности и жизнеспособности плода.
Если необходимо срочно начать лечение, следует рассмотреть возможность прерывания беременности и надлежащим образом уведомить мать о высоком риске тератогенности в случае, если она решит пролонгировать беременность.
Источники:
- van de Loo L. E. X. M. et al. Uterine function, pregnancy complications, and pregnancy outcomes among female childhood cancer survivors //Fertility and sterility. – 2019. – Т. 111. – №. 2.
- Woodruff T. K. Textbook of Oncofertility Research and Practice: A Multidisciplinary Approach. – Springer, 2019.
- Spears N. et al. Ovarian damage from chemotherapy and current approaches to its protection //Human reproduction update. – 2019. – Т. 25. – №. 6.
- Hepner A. et al. Cancer During Pregnancy: The Oncologist Overview //World journal of oncology. – 2019. – Т. 10. – №. 1. – С. 28.
- Tang M., Webber K. Fertility and pregnancy in cancer survivors //Obstetric medicine. – 2018. – Т. 11. – №. 3.
- Oktay K. et al. Fertility preservation in patients with cancer: ASCO clinical practice guideline update //J Clin Oncol. – 2018. – Т. 36. – №. 19.
- Hickman L. C. et al. Preservation of gonadal function in women undergoing chemotherapy: a systematic review and meta-analysis of the potential role for gonadotropin-releasing hormone agonists //Journal of assisted reproduction and genetics. – 2018. – Т. 35. – №. 4.
- Jadoul P. et al. Efficacy of ovarian tissue cryopreservation for fertility preservation: lessons learned from 545 cases //Human Reproduction. – 2017. – Т. 32. – №. 5.
- Феськов А. М. и др. Онкофертильность при раке грудной железы. Алгоритм принятия решения перед началом лечения //Клиническая онкология. – 2014. – №. 3.
- Hoellen F. et al. Cancer in pregnancy. Part I: basic diagnostic and therapeutic principles and treatment of gynecological malignancies //Archives of gynecology and obstetrics. – 2012. – Т. 285. – №. 1.
