Временные профили вирусной нагрузки в образцах отделяемого с задней стенки ротоглотки и выработка сывороточных антител при COVID-19

Краткая история вопроса
Коронавирусная болезнь 2019 (COVID-19) вызывает серьезные внебольничные и внутрибольничные (нозокомиальные) вспышки. Подробные данные о серийной респираторной вирусной нагрузке и выработке сывороточных антител у пациентов, инфицированных коронавирусом 2 (SARS-CoV-2), сопряженным с тяжелым острым респираторным синдромом, пока отсутствуют. Мазки из носоглотки и горла обычно используются в качестве образцов для определения серийной вирусной нагрузки, но их забор может вызывать дискомфорт у пациентов, а также подвергать риску медицинских работников.
Нашей целью было установить серийную респираторную вирусную нагрузку SARS-CoV-2 в образцах с задней стенки ротоглотки (глубоких отделов глотки / нижних отделов глотки) пациентов с COVID-19 и выработку сывороточных антител.
Методы
Проведено когортное исследование в двух больницах в Гонконге. Были включены пациенты с лабораторно подтвержденным COVID-19.
Получены образцы крови, мочи, образцов с задней стенки ротоглотки, а также ректальные мазки. Серийную вирусную нагрузку определяли с помощью количественной ПЦР с обратной транскрипцией (ОT-кПЦР). Уровни антител к внутреннему нуклеопротеину (NP) SARS-CoV-2 и рецептор-связывающему домену шиповидных белков (RBD) измеряли с использованием иммуноферментного анализа (ИФА). Чтобы идентифицировать возможные мутации, возникающие во время инфекции, было проведено полногеномное секвенирование.
Результаты
В период с 22 января 2020 года по 12 февраля 2020 года было обследовано 30 пациентов, из которых 23 были включены в исследование (медианный возраст 62 года [диапазон 37–75]). Медианная вирусная нагрузка в слюне c задней стенки ротоглотки или в других представленных респираторных образцах составила 5,2 log10 копий на мл (межквартильный размах (IQR) 4,1–7,0). Вирусная нагрузка в слюне была самой высокой в течение первой недели после появления симптомов и впоследствии снижалась со временем (наклон –0,15, 95 % ДИ –0,19 до –0,11; R2 = 0,71). У одного пациента вирусная РНК была обнаружена через 25 дней после появления симптомов. Пожилой возраст коррелировал с более высокой вирусной нагрузкой (ρ Спирмена = 0,48, 95 % ДИ 0,074–0,75; р = 0,020). Для 16 пациентов с доступными образцами сыворотки через 14 или более дней после появления симптомов показатели серопозитивности составили 94 % для анти-NP IgG (n = 15), 88 % для анти-NP IgM (n = 14), 100 % для анти-NP-IgG (n = 14) IgG RBD (n = 16) и 94 % для IgM против RBD (n = 15). Уровни IgG против SARS-CoV-2-NP или против SARS-CoV-2-RBD коррелировали с титром нейтрализации вируса (R2 > 0,9). В серийных образцах не было обнаружено мутаций генома.
Интерпретация
Взятие образца с задней стенки ротоглотки представляет собой неинвазивное исследование, что более приемлемо для пациентов и медицинских работников. В отличие от тяжелого острого респираторного синдрома (SARS), пациенты с COVID-19 имели самую высокую вирусную нагрузку уже при начальных проявлениях симптомов, что может объяснять природу быстрого распространения этой эпидемии. Это открытие подчеркивает важность строгого инфекционного контроля и раннего использования сильнодействующих противовирусных препаратов (по отдельности или в комбинации) для лиц с повышенным риском. Для диагностики серологический анализ может быть дополнен ОT-кПЦР.
Введение
Коронавирусная болезнь 2019 года (COVID-19), вызванная коронавирусом 2 тяжелого острого респираторного синдрома (SARS-CoV-2), впервые была зарегистрирована в Китае в декабре 2019 года. Хотя инфекции, вызванные коронавирусом ближневосточного респираторного синдрома (MERS-CoV) и коронавирусом тяжелого острого респираторного синдрома (SARS-CoV), имеют более высокую смертность, чем COVID-19, SARS-CoV-2 распространяется гораздо быстрее, чем MERS-CoV и SARS-CoV. Для проведения противовирусной терапии, инфекционного контроля, эпидемиологических мер, вакцинации срочно понадобились надежные данные по профилям вирусной нагрузки и титров антител.
Пиковая вирусная нагрузка у пациентов с инфекциями MERS-CoV и SARS-CoV наступает примерно через 7–10 дней после появления симптомов, что может быть связано с внутрибольничными вспышками с участием работников здравоохранения. Клинические исследования противовирусных препаратов при ОРВИ показали, что вирусная нагрузка значительно уменьшалась одновременно с успехом лечения.
Нет систематического исследования этих двух важных переменных с помощью статистического анализа для SARS-CoV-2, хотя были опубликованы предварительные описательные исследования.
В большинстве исследований респираторных вирусных инфекций для мониторинга вирусной нагрузки используется серия мазков из носоглотки или зева. Однако забор мазков из носоглотки или зева может вызвать кашель и чихание, что приводит к образованию аэрозоля и представляет потенциальную опасность для здоровья работников здравоохранения. Забор мазков из горла также требует непосредственного осмотра задней стенки глотки и миндалин пациента. Кроме того, забор образцов из носоглотки является относительно инвазивной и дискомфортной процедурой, которая может даже вызвать кровотечение. Нежелание пациентов предоставлять образец может объяснить нехватку временных точек в исследованиях вирусной нагрузки респираторных вирусных инфекций.
Результаты предыдущих исследований показали высокую степень конкордантности между слюной и аспиратом носоглотки в качестве образцов для лабораторной диагностики респираторных вирусов. Мы сообщали об использовании образцов с задней стенки ротоглотки (глубокие отделы глотки) для диагностики и мониторинга вирусной нагрузки в когорте из 12 пациентов с COVID-19. Здесь мы сообщаем об использовании для мониторинга вирусной нагрузки самостоятельно собранных образцов с задней стенки ротоглотки пациентов с COVID-19, что позволяет избежать тесного контакта между работниками здравоохранения и пациентами. Также мы контролировали серийные уровни сывороточных антител пациентов.
Методы
Пациенты
Мы включили в список пациентов с лабораторно подтвержденным COVID-19, которые были госпитализированы в больницы Princess Margaret Hospital и Queen Mary Hospital в Гонконге. В Гонконге пациенты были протестированы на SARSCoV-2 на основе клинических и эпидемиологических критериев, как указано управлением больницы. Первоначальное лабораторное подтверждение было сделано с использованием образцов с носоглотки или мокроты в Лабораторном центре общественного здравоохранения Гонконга. Мы исключали пациентов, если архивных образцов слизи или сыворотки было недостаточно для тестирования.
Это исследование было одобрено Институциональным контрольным советом Университета Гонконга / Администрацией больницы Западного кластера Гонконга. Поскольку использовались архивные образцы, письменное информированное согласие не применялось. Ранее сообщалось о 12 из 23 пациентов, включенных в это исследование, но об их клинических данных, вирусной нагрузке по количественному анализу гена РНК-зависимой РНК-полимеразы-хеликазы, иммунном ответе с образованием антител или анализе вирусного генома ранее не сообщалось.
Процедуры
Для мониторинга вирусной нагрузки всем пациентам было предложено произвести ранний утренний сбор отделяемого с задней стенки ротоглотки (то есть откашляться путем прочистки горла) перед чисткой зубов и завтраком, потому что выделения из носоглотки перемещаются кзади, а бронхолегочные выделения перемещаются при помощи цилиарной активности в заднюю ротоглоточную область при нахождении пациентов в положении лежа на спине во время сна. Пациенты были проинструктированы и контролировались медсестрами. Вирусную транспортную среду добавляли к образцу слюны. Если пациенты были интубированы, мы получали эндотрахеальный аспират вместо слизи с задней стенки ротоглотки. Наш первоначальный опыт показал, что такие образцы являются перспективными для мониторинга вирусной нагрузки у пациентов с COVID-19. Мы также получили остатки сыворотки крови от образцов крови, взятых для рутинных биохимических исследований, и охладили эти образцы до –20 °C до проведения анализа на антитела.
Клинические данные были внесены в предварительно разработанную базу данных, включающую историю болезни и физическое обследование пациента, а также результаты гематологических, биохимических, рентгенологических и микробиологических исследований. Тяжелая форма заболевания определялась в случае потребности в дополнительном кислороде, поступления в отделение интенсивной терапии (ICU) или смерти.
Проведена внутренняя количественная ПЦР с обратной транскрипцией (ОT-кПЦР), нацеленная на область гена РНК-зависимой РНК-полимеразы-хеликазы SARS-CoV-2. Также выполнен ИФА на нуклеопротеин SARS-CoV-2 (NP) и рецептор-связывающий домен шиповидных белков (RBD), как описано, но с модификациями. Рекомбинантный нуклеопротеин (NP) и рецептор-связывающий домен шиповидных белков (RBD) SARS-CoV-2 использовали для ИФА.
Оценена чистота NP и RBD методом электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия, а также вестерн-блоттингом (рис. 1A, B). Положительный образец был включен в каждый прогон в качестве положительного контроля. В качестве отрицательного контроля использовался архивный анонимный образец 2018 года. В качестве порогового уровня серопозитивности было установлено среднее значение для 93 анонимных архивных образцов сыворотки 2018 года плюс 3 стандартных отклонения. Мы проверили достоверность ИФА с помощью конкурентного ИФА и вестерн-блоттинга, используя образцы сыворотки пациентов (рис. 1C, D).
Проведена реакция микронейтрализации и культивирование вируса. Также проведено полногеномное секвенирование с использованием анализатора Oxford Nanopore MinION (Oxford Nanopore Technologies, Oxford, UK).
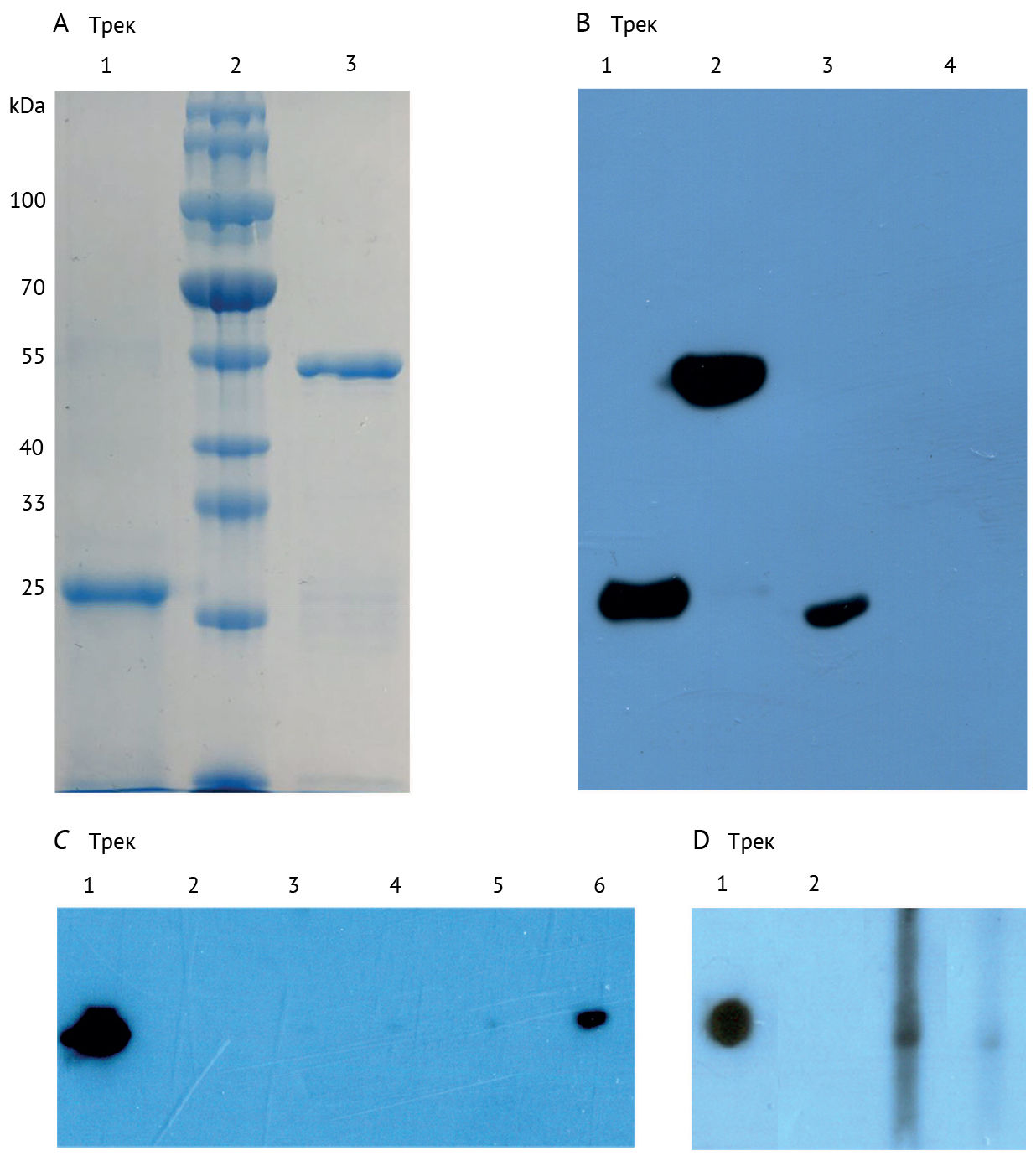
Моноклональные анти-His антитела в треке 1, сыворотка неинфицированного пациента в треке 2, сыворотка двух пациентов с COVID-19 в треках 3 и 4 (титр 1 к 100).
NP — нуклеопротеин
RBD — рецептор-связывающий домен
His — полигистидин
GST — глютатион-S-трансфераза
COVID-19 — коронавирусная болезнь 2019
Статистический анализ
Статистический анализ проведен при помощи SPSS версия 26.0 или PRISM версия 6.0. Категориальные переменные сравнивались с помощью точного критерия Фишера, а непрерывные переменные — с помощью U-критерия Манна-Уитни. Чтобы оценить связь между возрастом и вирусной нагрузкой, использовалась корреляция Спирмена. Значение p менее 0,05 было оценено как статистически значимое.
Роль источника финансирования
Спонсоры не участвовали в разработке исследования, сборе, анализе и интерпретации данных или написании отчета. Автор, отвечающий за переписку, имел полный доступ ко всем данным в исследовании и нес окончательную ответственность за решение представить для публикации.
Результаты
С 22 января по 12 февраля 2020 года на предмет включения в исследование были обследованы 30 пациентов, из которых были включены 23 пациента (13 мужчин и 10 женщин). У 10 пациентов была тяжелая форма COVID-19, все они нуждались в кислородной поддержке, еще 13 пациентов имели легкую форму болезни. Медианный возраст пациентов был 62 года (от 37 до 75 лет). 11 (48 %) из 23 пациентов имели хронические заболевания, самыми частыми сопутствующими диагнозами были гипертензия у шести (26 %) пациентов и диабет у четырех (17 %). Хронические болезни чаще встречались у пациентов с тяжелой формой COVID-19 (семь [70 %] пациентов с тяжелой формой против четырех [31 %] с легкой формой), хотя эта разница не была значимой (таблица 1).
Пять пациентов были переведены в отделение интенсивной терапии, включая троих, нуждавшихся в интубации. Двое пациентов умерли.
Таблица 1 | Характеристики пациентов относительно тяжести заболевания
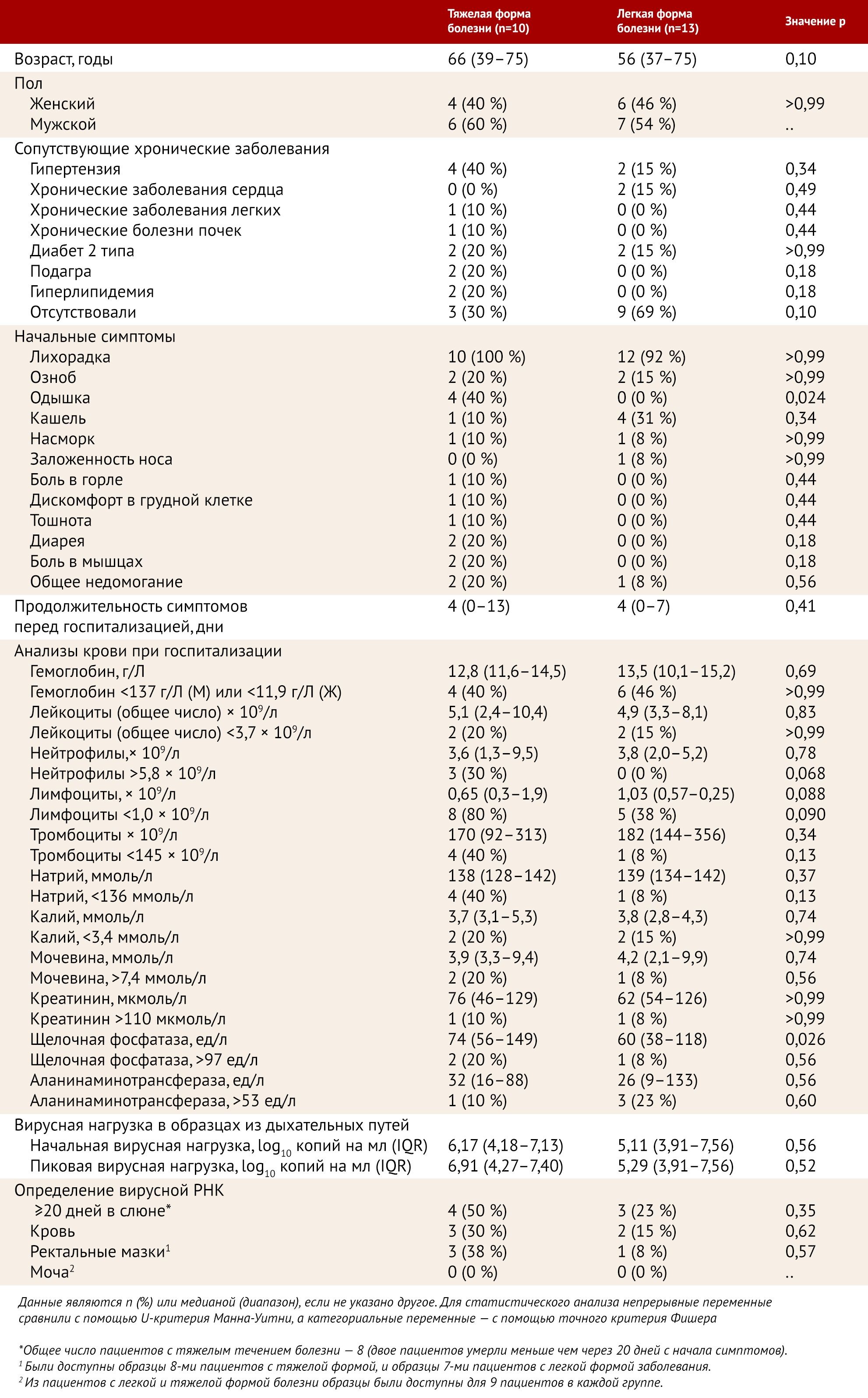
Средний интервал между появлением симптомов и госпитализацией был 4 дня (от 0 до 13 дней). Самыми частыми симптомами были лихорадка у 22 пациентов (96 %), сопровождаемая кашлем у пяти (22 %), ознобом у четырех (17 %), и одышкой у четырех (17 %; таблица) пациентов. Одышка значительно чаще встречалась среди десяти пациентов с тяжелым течением болезни, чем среди пациентов с легким заболеванием (четыре [40 %] из десяти против ни одного [0 %] из 13; р = 0,024). Сывороточная щелочная фосфатаза была значительно выше у пациентов с тяжелой формой, чем у пациентов с легким течением (74 ед/л [диапазон 56–149] против 60 ед/л [38–118]; р = 0,026). Количество лимфоцитов было ниже среди пациентов с тяжелым заболеванием, чем среди пациентов с легким заболеванием (0,65 × 10⁹ клеток на л [диапазон 0,30–1,90] против 1,03 [0,57–2,25]), но эта разница не была значимой (р = 0,088).
Лимфопения и нейтрофилия присутствовали у большей части пациентов с тяжелым течением заболевания, в отличие от пациентов с легкой формой, но различия не были значимыми (р=0,090 и р=0,068 соответственно). Патологические изменения при рентгенологическом обследовании грудной клетки наблюдались у 15 (65 %) пациентов. На КТ у 17 (74 %) пациентов наблюдались мультифокальные уплотнения по типу «матового стекла». РНК SARS-CoV-2 была обнаружена в образцах крови у пяти (22 %) пациентов и в ректальных мазках у четырех (27 %), но частота выявления между тяжелыми и легкими случаями не отличалась (p = 0,62 и p = 0,57 соответственно; таблица). РНК SARS-CoV-2 не была обнаружена ни в одном из образцов мочи. Лопинавир-ритонавир с рибавирином или интерфероном β 1b или без него назначался 18 (78 %) пациентам в различные моменты времени после появления симптомов.
В общей сложности было получено 173 образца из дыхательных путей от 23 пациентов (в среднем 7,5 образцов на пациента). Медианная вирусная нагрузка составила 5,2 log10 копий на мл (IQR 4,1–7,0). В слюне трех (13 %) пациентов РНК SARS-CoV-2 не было обнаружено. Образцам с неопределяемой вирусной нагрузкой было присвоено значение 1 log10 копий на мл. Не было отмечено корреляции между количеством дней после появления симптомов и начальной вирусной нагрузкой (ρ Спирмена = 0,48; p = 0,97). Вирусная нагрузка в образцах с задней стенки ротоглотки была самой высокой в течение первой недели после появления симптомов, а затем постепенно снижалась (наклон –0,15, 95 % ДИ –0,19 до –0,11; R2 = 0,71; рисунок 2).
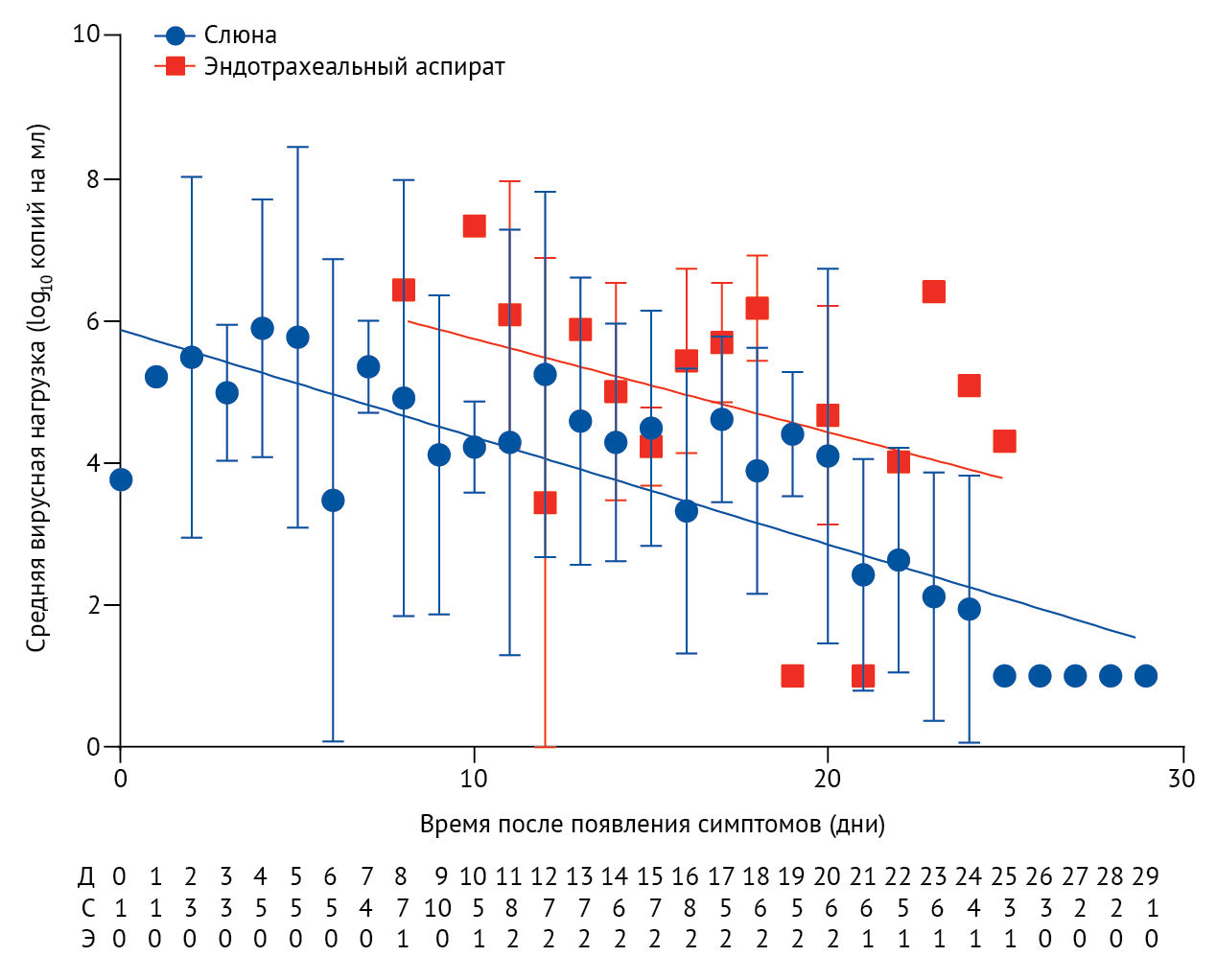
Точки данных обозначают среднее; столбики ошибок указывают стандартные отклонения; наклон представляет собой лучшую линию подгонки. Количество пациентов, предоставивших образцы за каждый день, указано в таблице ниже графика. Д — дни после появления симптомов, С — слюна, Э — эндотрахеальный аспират.
Вирусная нагрузка в эндотрахеальном аспирате определялась с 8-го дня после появления симптомов и снижалась незначительно (наклон –0,13, 95 % ДИ –0,31 до 0,04; R2 = 0,15). Из 21 выжившего пациента у семи (33 %) вирусная РНК обнаруживалась в течение 20 или более дней после появления симптомов. Не было обнаружено связи между длительным выявлением вирусной РНК (≥ 20 дней после появления симптомов) и тяжестью заболевания (p = 0,35)
У одного из пациентов вирусная РНК обнаруживалась до 25 дня после появления симптомов; у другого пациента вирусная нагрузка не определялась на 21 и 22 дни после появления симптомов, но произошло восстановление вирусной нагрузки на 23 и 24 дни, после чего последовали 5 дней неопределяемой вирусной нагрузки.
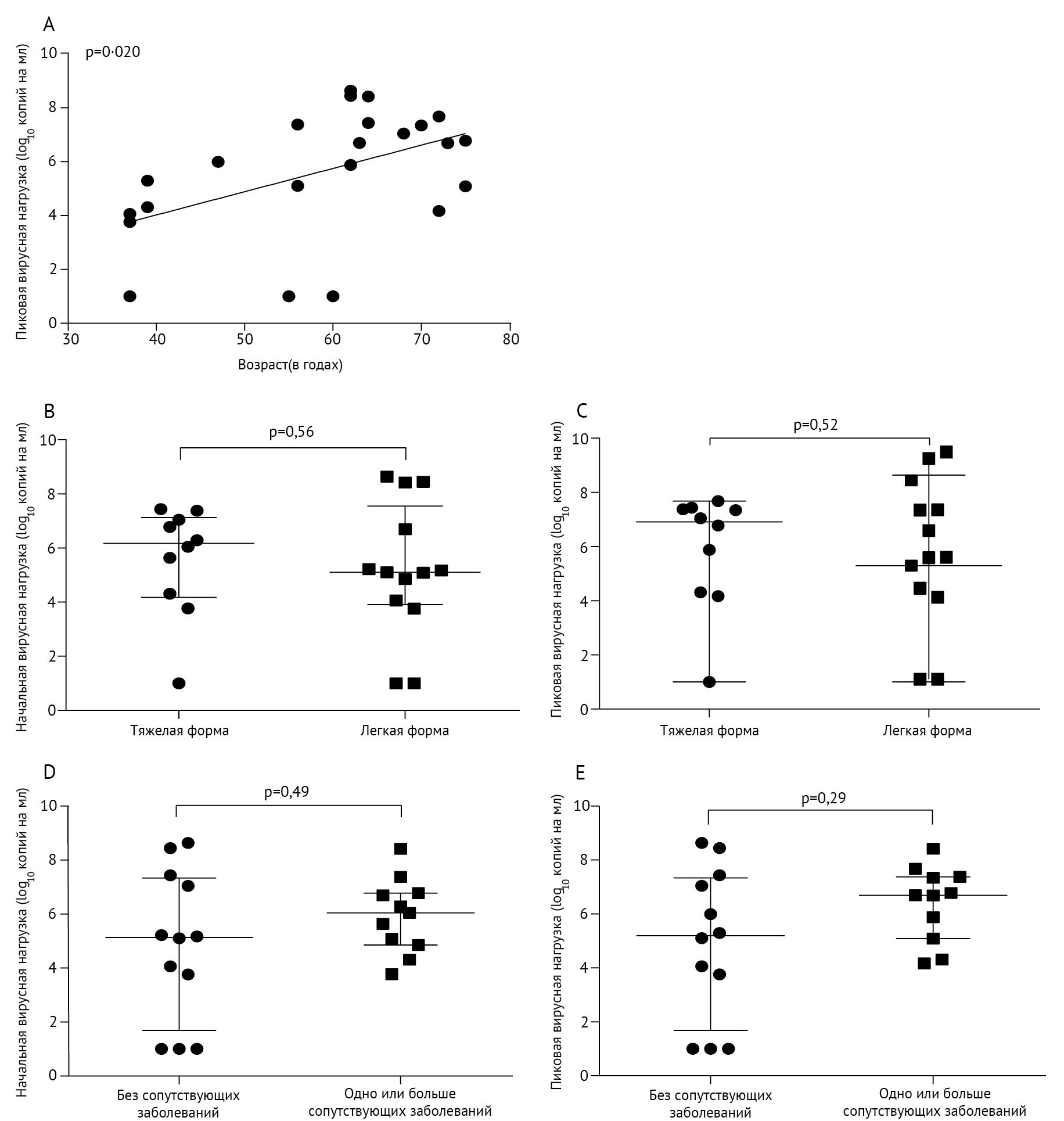
Была отмечена значимая положительная корреляция между возрастом и пиковой вирусной нагрузкой (ρ Спирмена = 0,48, 95 % ДИ 0,074–0,75; р = 0,020; рис. 3А). Медианная начальная (p = 0, 56) и пиковая (p = 0,52) вирусная нагрузка в тяжелых случаях была примерно на 1 log10 выше, чем в легких случаях, хотя разница не была значимой (рисунок 3B, C). Начальная (p = 0,49) и пиковая (p = 0,29) вирусная нагрузка не отличались между пациентами без сопутствующих заболеваний и пациентами с сопутствующими заболеваниями (рис. 3D, E). Для пациентов с вирусной нагрузкой и результатами анализа антител, доступными на 1-й или 3-й неделе, медианная вирусная нагрузка составляла 6,70 log10 копий на мл (диапазон 4,17–8,64), а сопутствующая медианная оптическая плотность (OП) для антинуклеопротеинового IgG была 0,13 (диапазон 0,10–1,83) на первой неделе, тогда как на третьей неделе медианная вирусная нагрузка составляла 4,91 log10 копий на мл (диапазон 3,99–8,94), и сопутствующая медианная OП для анти-NP IgG была 2,59 (диапазон 2,12–2,65).
Было получено 108 образцов сыворотки крови от 23 пациентов (в среднем 4,7 образцов сыворотки на пациента). Было отмечено увеличение уровней антител IgG или IgM к NP или RBD для большинства пациентов через 10 дней или позже после появления симптомов, как свидетельствуют значения ОП в ИФА (рис. 4). При сравнении появления серопозитивности между анти-RBD и анти-NP больше пациентов имели более раннюю серопозитивность к анти-RBD, чем анти-NP для обоих IgG (десять [43 %] из 23 для RBD ранее против двух [9 %] из 23 для NP ранее) и IgM (шесть [26 %] из 23 для RBD ранее против четырех [17 %] из 23 NP ранее). При сравнении начала серопозитивности между IgG и IgM больше пациентов имели более раннюю сероконверсию для IgG анти-NP, чем для IgM (шесть [26 %] из 23 для IgG ранее против одного [4 %] из 23 для IgM ранее) и анти-RBD (13 [57 %] из 23 для IgG ранее против одного [4 %] из 23 для IgM ранее). Для 16 пациентов с образцами сыворотки, доступными в течение 14 дней или дольше после появления симптомов, уровень серопозитивности составил 94 % для анти-NP IgG (n = 15), 88 % для анти-NP IgM (n = 14), 100 % для IgG против RBD (n = 16) и 94 % для IgM против RBD (n = 15).

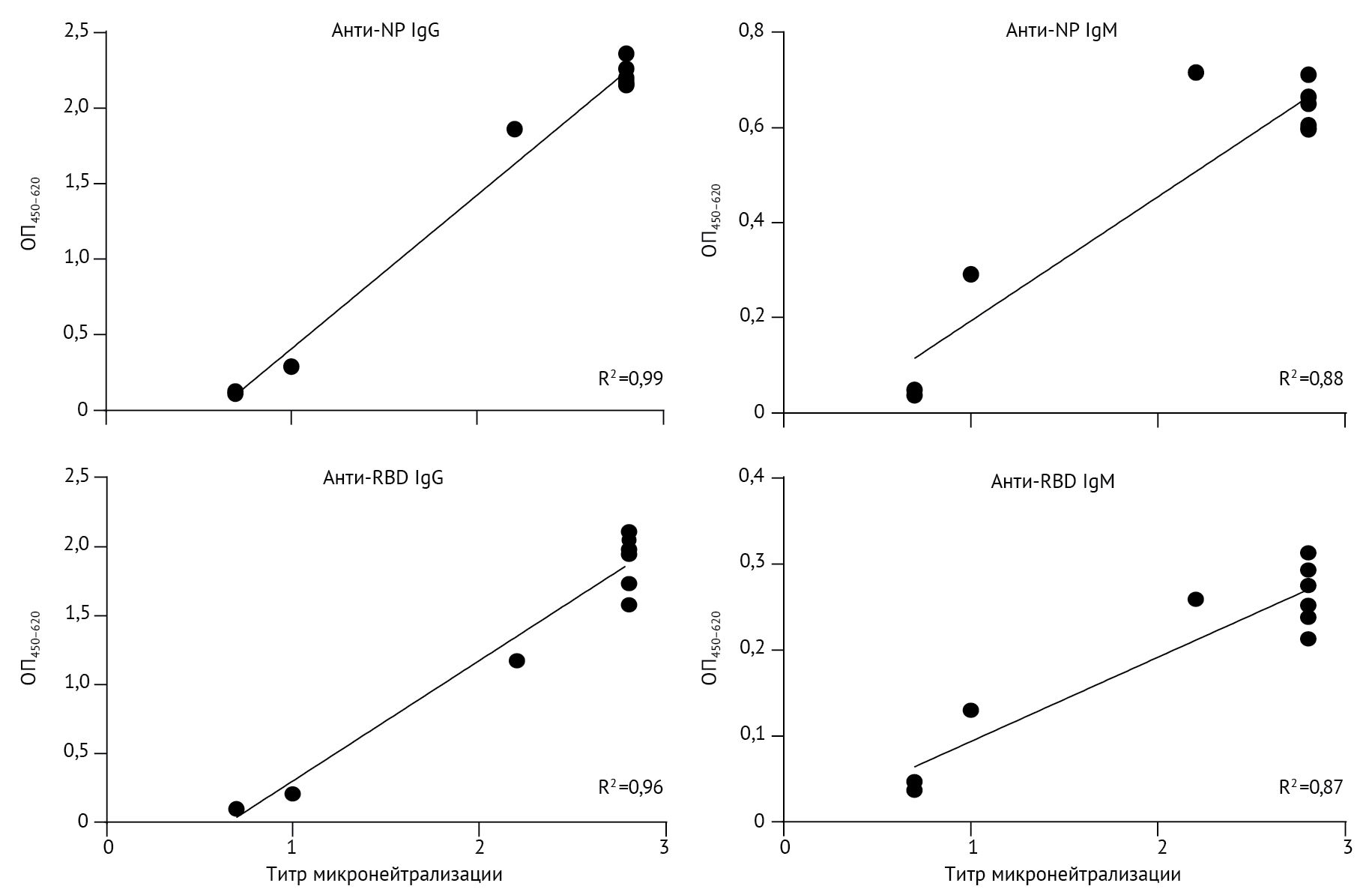
NP — нуклеопротеин. RBD — рецептор-связывающий домен. OП450–620 — оптическая плотность на 450–620 нм
Чтобы оценить факторы восприимчивости, которые влияют на титр антител, была проанализирована корреляция между самым высоким значением OП в период реконвалесценции (третья неделя после появления симптомов) и возрастом или сопутствующими заболеваниями. Пациенты с сопутствующими заболеваниями имели более низкую OП анти-RBD IgG, чем пациенты без сопутствующих заболеваний, хотя разница не была значимой (медиана OD, 0,65 против 1,32; p = 0,15). Не было обнаружено никакой связи между сопутствующей патологией и значениями OП анти-NP IgG или IgM, или между возрастом и значениями ОП анти-NP IgM или IgG или анти-RBD IgM или IgG.
Образцам с титрами реакции микронейтрализации менее 10 присваивалось значение 5, а образцам с титрами реакции микронейтрализации более 320 — значение 640. У одного пациента была проведена реакция микронейтрализации антител с десятью серийными образцами. Корреляция между титрами микронейтрализации и анти-NP IgG (R2 = 0,99) или анти-RBD IgG (R2 = 0,96) была сильнее, чем между титрами микронейтрализации и анти-NP IgM (R2 = 0,88) или анти-RBD IgM R2 = 0,87; рис. 5).
Нанопоровое секвенирование было успешным для парных образцов от четырех пациентов. Интервал между первым и вторым экземплярами составлял 1–3 дня. Мутаций вируса между парными образцами от отдельных пациентов выявлено не было.
Обсуждение
Проанализирована серийная вирусная нагрузка, кинетика антител и вирусный геном пациентов с COVID-19 в Гонконге. Для большинства пациентов вирусная нагрузка SARS-CoV-2 была очень высокой на момент разгара клинической картины и неуклонно снижалась. Несмотря на выработку антител против поверхностных и внутренних белков SARS-CoV-2, вирусная РНК все еще может быть обнаружена в образцах с задней стенки ротоглотки (глубоких отделов глотки) трети пациентов в течение 20 дней или дольше. Пиковая вирусная нагрузка положительно коррелировала с возрастом. У большинства пациентов выработка антител наблюдалась через 10 дней или позже после появления симптомов. Полногеномное секвенирование вируса в парных образцах от четырех пациентов не выявило каких-либо однонуклеотидных полиморфизмов.
Высокая вирусная нагрузка при клинической картине COVID-19 была зарегистрирована в нашей когорте даже у пациентов, которые были госпитализированы вскоре после появления симптомов. Используя мазок из носа и мазок из зева, Zou и коллеги также сообщили о высокой вирусной нагрузке вскоре после появления симптомов. Однако в этом исследовании сообщалось только о пороговых значениях цикла (не о точных вирусных нагрузках), и не проводился статистический или корреляционный анализ с такими клиническими переменными, как возраст, сопутствующие заболевания, тяжесть заболевания и реакция антител.
Профиль вирусной нагрузки SARS-CoV-2 аналогичен профилю гриппа, который достигает пика примерно во время появления симптомов, но отличается от SARS-CoV, для которого пик наступает примерно через 10 дней, и от MERS-CoV, пик вирусной нагрузки которого приходится на вторую неделю после начала симптомов. Высокая вирусная нагрузка, сопряженная с клиническими признаками, позволяет предположить, что SARS-CoV-2 может легко передаваться, даже если симптомы относительно умеренные. Этот вывод может объяснить эффективную передачу от человека к человеку, отмеченную в общественных условиях и в учреждениях здравоохранения. Часто сообщалось о груповых инфицированиях в семьях, на рабочих местах, на религиозных собраниях и в продовольственных магазинах.
Профиль вирусной нагрузки важен для проведения противовирусной терапии. Поскольку вирусная нагрузка уже достигла пика ко времени госпитализации, риск возникновения резистентности к противовирусным препаратам может быть аналогичен риску возникновения резистентности при лечении гриппа каким-либо одним препаратом из группы адамантанов, ингибиторов кислотной полимеразы и ингибиторов нейраминидазы. Тем не менее наше предыдущее клиническое исследование лечения гриппа показало, что комбинация трех противовирусных препаратов может значительно улучшить клинический исход, снизить профиль вирусной нагрузки, а также предупредить появление устойчивых квази-видов вируса.
В настоящее время нет стандарта лечения для COVID-19. Что касается инфекции SARS-CoV, наше предыдущее исследование показало, что комбинация лопинавир-ритонавира и рибавирина приводила к значительно меньшему числу осложнений (например, таких как острый респираторный дистресс-синдром) или смертельных исходов, чем сообщалось в исторических контрольных группах, получавших рибавирин. Лопинавир-ритонавир или интерферон β 1b также снижал повреждение легких и уменьшал вирусную нагрузку в модели MERS-CoV на приматах. Лопинавир является ингибитором протеазы с активностью in vitro против SARS-CoV и MERS-CoV. Однако идея о том, что SARS-CoV 3C-подобная протеаза является противовирусной мишенью лопинавира, была основана исключительно на связывании при компьютерном моделировании.
Другие ингибиторы протеаз и аналоги нуклеотидов (например, ремдесивир) являются потенциальным вариантом лечения. Требует исследования применение комбинации противовирусных препаратов и лекарственных средств, влияющих на организм инфицированного с целью улучшения клинического исхода.
Исследования SARS-CoV показали, что высокая исходная вирусная нагрузка была ассоциирована со смертью. Однако наше исследование показало, что медианная вирусная нагрузка была только на 1 log10 выше в тяжелых случаях, чем в легких, и разница не была значимой. Все же пожилой возраст был связан с более высокой пиковой вирусной нагрузкой. В предыдущем исследовании пациентов, инфицированных SARS-CoV, пожилой возраст был независимым фактором, связанным с более высокой вирусной нагрузкой, как и ожидалось с учетом старения иммунной системы, которое ухудшает врожденные и адаптивные иммунные ответы.
РНК SARS-CoV-2 можно было обнаружить в нашей группе в течение 20 дней или дольше у трети выживших пациентов, а у одного пациента РНК SARS-CoV-2 выявлялась в течение 25 дней. Длительное обнаружение вирусной РНК в течение 20 дней или дольше также обычно наблюдается у пациентов с инфекциями MERS-CoV или SARS-CoV.
Длительное обнаружение вирусной РНК является проблемой, которая ограничивает доступность больничных изоляторов, поскольку пациенты не могут быть выписаны, пока вирусная РНК в респираторных образцах не будет неопределяемой. Необходимы дальнейшие исследования чтобы выяснить, выделяют ли пациенты живой вирус, путем вирусной культуры пролонгированных ОТ-ПЦР-положительных образцов, полученных от пациентов с сопутствующей серопозитивностью, когда выделенные вирионы покрыты антителами хозяина, что делает их неинфицирующими.
Критерием прекращения мер предосторожности, основанным на механизмах передачи, является отрицательный результат ОT-ПЦР из двух образцов мазков из носоглотки и из зева. В текущем исследовании один пациент с полным разрешением симптомов снова получил положительный результат на SARS-CoV-2 после двух дней отрицательных результатов. Наши результаты показывают, что SARS-CoV-2 может выделяться в незначительных количествах, несмотря на клиническое выздоровление. Таким образом, при принятии решений о мерах по контролю за инфекцией следует учитывать как мониторинг серийной вирусной нагрузки, так и титры антител, поскольку в данном исследовании вирусная нагрузка, по-видимому, была обратно пропорциональна уровням антител сыворотки.
Профиль антител имеет жизненно важное значение для своевременного назначения серологических исследований и интерпретации результатов теста на антитела. Серологический диагноз важен для пациентов с поздними клиническими проявлениями и очень низкой вирусной нагрузкой, ниже предела обнаружения тестов ОТ-ПЦР. Поскольку у большинства пациентов титры антител повышаются через 10 дней после появления симптомов, сбор серийных образцов сыворотки в фазе выздоровления был бы более полезным. Количество IgG в сыворотке может возрасти в то же время или раньше, чем IgM против SARS-CoV-2. По сравнению с результатами исследования IgM и IgG методом ИФА, в котором больше пациентов были серопозитивными в отношении IgG, чем IgM, в день 0 и на 5 день госпитализации, у большей части пациентов в текущем исследовании также был более высокий уровень сероконверсии IgG, чем IgM. Тем не менее этот результат также может быть объяснен более низкой чувствительностью ИФА IgM, что требует проведения исследований с большим количеством пациентов.
Уровни сывороточных антител не коррелировали с тяжестью клинического течения. Примечательно, что у одного пациента с тяжелым течением болезни наблюдалось раннее повышение уровня антител через 6 дней после появления симптомов. У умерших пациентов, инфицированных SARS-CoV, наблюдалось более быстрое достижение пиковых уровней антител к шиповидным белкам, по сравнению с пациентами, которые выздоровели и имели впоследствии пониженный B-клеточный иммунитет с нарушенной нейтрализующей способностью. В модели SARS-CoV на макаках IgG против шиповидных белков стимулировал легочные провоспалительные реакции и вызывал острое повреждение легких. Вредоносный эффект IgG против шиповидных белков был обусловлен опосредованным воздействием на ранозаживляющие макрофаги через рецептор Fcγ.
Наши результаты, показывающие корреляцию между уровнем антител, определенным с помощью ИФА, и титром нейтрализации вируса, особенно важны для разработки вакцин и использования реконвалесцентной плазмы или терапевтических моноклональных антител, которые могут улучшить клинический исход или парадоксально вызвать иммунопатологическое повреждение реципиента.
Полногеномное секвенирование на парных образцах от четырех пациентов было успешным и не показало различий в индивидуально парных последовательностях генома. Однако с использованием метода таргетного секвенирования выяснилось, что в период госпитализации по поводу инфекции MERS-CoV у вируса возникают однонуклеотидные полиморфизмы. Дальнейшие исследования с большим количеством пациентов и образцами, полученными с более длительными интервалами, могут быть более информативными.
Высокая вирусная нагрузка в смывах из горла и слюне (до 108 копий на мл РНК SARS-CoV) была зарегистрирована у 17 пациентов с SARS. В китайской модели SARS-CoV на макаках протоки слюнных желез были ранними мишенями SARS-CoV, и следовательно были вероятным источником вирионов, найденных в слюне пациентов, в частности в раннем периоде инфекции.
Учитывая эти важные данные, в нашем исследовании для определения временных профилей вирусной нагрузки использовалась слюна с задней стенки ротоглотки, полученная путем откашливания при прочистке горла. Задняя стенка ротоглотки является местом «встречи» выделений, исходящих из заднего отдела носоглотки и слюнных желез, а также отделяемого из трахеобронхиального дерева.
Тестирование отделяемого с задней стенки ротоглотки может показать выделение вируса как из слюнных желез, так и из верхних и нижних дыхательных путей. Более того, так как забор образцов с задней стенки ротоглотки является более приемлемым для пациента, чем мазок из носоглотки или горла, мы получили для тестирования 7,5 образцов из дыхательных путей на пациента. Таким образом, наш временной профиль вирусной нагрузки может быть проанализирован статистически, в отличие от предыдущих клинических исследований вирусной кинетики инфекций, вызванных высокопатогенными бета-коронавирусами. Необходимы дальнейшие исследования, чтобы выяснить, могут ли слюнные железы быть инфицированы SARS-CoV-2.
Наше исследование имеет несколько ограничений. Во-первых, мы могли включить только несколько пациентов, и данные о вирусной нагрузке и титре антител не были ежедневно доступны. Это ограничение является распространенной проблемой в исследованиях недавно возникших инфекций, таких как SARS-CoV и MERS-CoV. Количество зарегистрированных пациентов не позволяет корректировать потенциальные сопутствующие факторы, которые могут повлиять на вирусную нагрузку или реакцию антител.
Во-вторых, 48 % зарегистрированных пациентов имели хронические заболевания, что значительно больше, чем доля таких пациентов в больших клинических выборках (24 %). Хотя более низкий уровень анти-RBD IgG и был отмечен среди пациентов с сопутствующими заболеваниями, оправданы дальнейшие исследования с большим количеством пациентов.
В-третьих, образцы отделяемого задней стенки ротоглотки не позволяют дифференцировать, происходит ли вирус из носоглотки или же из секрета нижних дыхательных путей; Таким образом, наше исследование не может указать, имеет ли SARS-CoV-2 склонность к поражению верхних и нижних дыхательных путей. Более того, некоторые пациенты могут недостаточно эффективно прочищать горло, чтобы выкашливать слюну из глубоких отделов горла, что может снизить чувствительность теста по сравнению с чувствительностью мазков из носоглотки, особенно у пациентов с преобладающим поражением верхних дыхательных путей или легкими симптомами. Наконец, наиболее широко экспрессируемый внутренний нуклеопротеин может иметь некоторую перекрестную антигенность между SARS-CoV-2 и SARS-CoV (90 % гомологии аминокислот) и иногда OC43-CoV (38 % гомологии аминокислот). Таким образом, менее обильно экспрессируемый поверхностный шиповидный белок RBD, специфичный для SARS-CoV-2 и являющийся прямой мишенью для нейтрализации антител, использовался для защиты специфичности наших двойных анализов антител.
COVID-19 — это зарождающаяся инфекция со многими неизвестными. Это исследование пролило свет на вирусную кинетику и реакцию антител у пациентов и предоставляет научные доказательства для руководства политикой инфекционного контроля и терапией. Для понимания инфекции SARS-CoV-2 необходимы дальнейшие вирусологические и иммунологические исследования; меры по борьбе с инфекцией следует пересматривать сообразно с быстрым изменением эпидемиологии COVID-19.
Контекст исследования
Доказательная база данного исследования
Мы провели поиск в PubMed 24 февраля 2020 года без ограничений по дате начала с терминами «COVID-19», «коронавирус», «антитело» и «вирусная нагрузка»; наш поиск был ограничен статьями на английском языке.В результате нами не обнаружено каких-либо сообщений о клиническом прогрессировании коронавирусной болезни 2019 (COVID-19) в соотношении с временной вирусной нагрузкой и профилями сопутствующих сывороточных антител. Мы нашли одну соответствующую публикацию по вирусной нагрузке без статистического анализа и еще одну статью с несколькими случаями выработки антител.
Актуальность исследования
Мы представляем результаты обсервационного когортного исследования временного профиля вирусной нагрузки при тяжелом остром респираторном синдроме коронавируса 2 (SARS-CoV-2) в образцах с задней стенки ротоглотки, а также выработки сывороточных антител, датированных относительно времени появления симптомов в корреляции с клиническими данными. Выше всего вирусная нагрузка в отделяемом была на протяжении первой недели после появления симптомов и затем снижалась со временем. Иммуноферментный анализ IgG и IgM к внутреннему вирусному нуклеопротеину и рецептор-связывающему домену шиповидных белков показывает корреляцию между титрами антител и титром нейтрализации антител.
Итоговые данные
Слюна с задней стенки ротоглотки является приемлемым для пациентов образцом, ее получение является неинвазивным методом и может использоваться для начальной диагностики и дальнейшего мониторинга вирусной нагрузки при COVID-19. Раннее нарастание вирусной нагрузки серьезно влияет на распространение SARS-CoV-2 в обществе и внутри больниц. Иммуноферментный анализ IgG и IgM к внутреннему вирусному нуклеопротеину и рецептор-связывающему домену шиповидных белков может использоваться у пациентов с поздней манифестацией симптомов или в качестве ретроспективной диагностики легких случаев. Так как положительный титр антител в ИФА коррелирует с титром нейтрализации антител, необходимы дальнейшие исследования его значения в иммунопатологии или антивирусной терапии.
