История пандемий: как мы пришли к COVID-19

Краткое резюме
Инфекционные заболевания, распространенные среди людей и животных, вызываются патогенами, которые однажды произошли от других организмов: животных-хозяев. Помимо уже известных, периодически возникают и новые инфекционные заболевания. В наиболее тяжелых случаях они могут вызвать пандемии, такие как COVID-19, в иных случаях возникают «тупиковые» инфекции или небольшие эпидемии. Известные и уже описанные заболевания также могут возникать повторно, например, в результате географического расширения, увеличения случаев передачи или роста патогенности. Возникновение инфекционных болезней отражает динамические равновесия и дисбалансы в сложных, глобально распределенных экосистемах, включающих людей, животных, самих патогенов и окружающую среду. Понимание этих переменных — необходимый шаг в борьбе с грядущими вспышками разрушительных эпидемий.
▶ Читать по теме: Чума в Сан-Франциско: крысы, расизм и реформы
Введение
Еще несколько месяцев назад невозможно было представить себе, как надвигающаяся пандемия COVID-19 перевернет всю нашу жизнь, поставив под сомнение прошлые предположения и пошатнет уверенность в будущем. COVID-19 обладает одновременно тремя характеристиками, которые позволили ему нанести исторический удар по человечеству, запустив глобальный виртуальный «локдаун», как единственное оружие против его неконтролируемого распространения. COVID-19 сочетает в себе характеристики вируса, который, насколько нам известно, никогда раньше не заражал людей на постоянной основе, вместе с его чрезвычайной эффективностью в отношении передачи от человека к человеку и относительно высоким уровнем заболеваемости и смертности, особенно среди пожилых людей и лиц с сопутствующими заболеваниями. Это самый настоящий «идеальный шторм» надвигающейся инфекционной болезни.
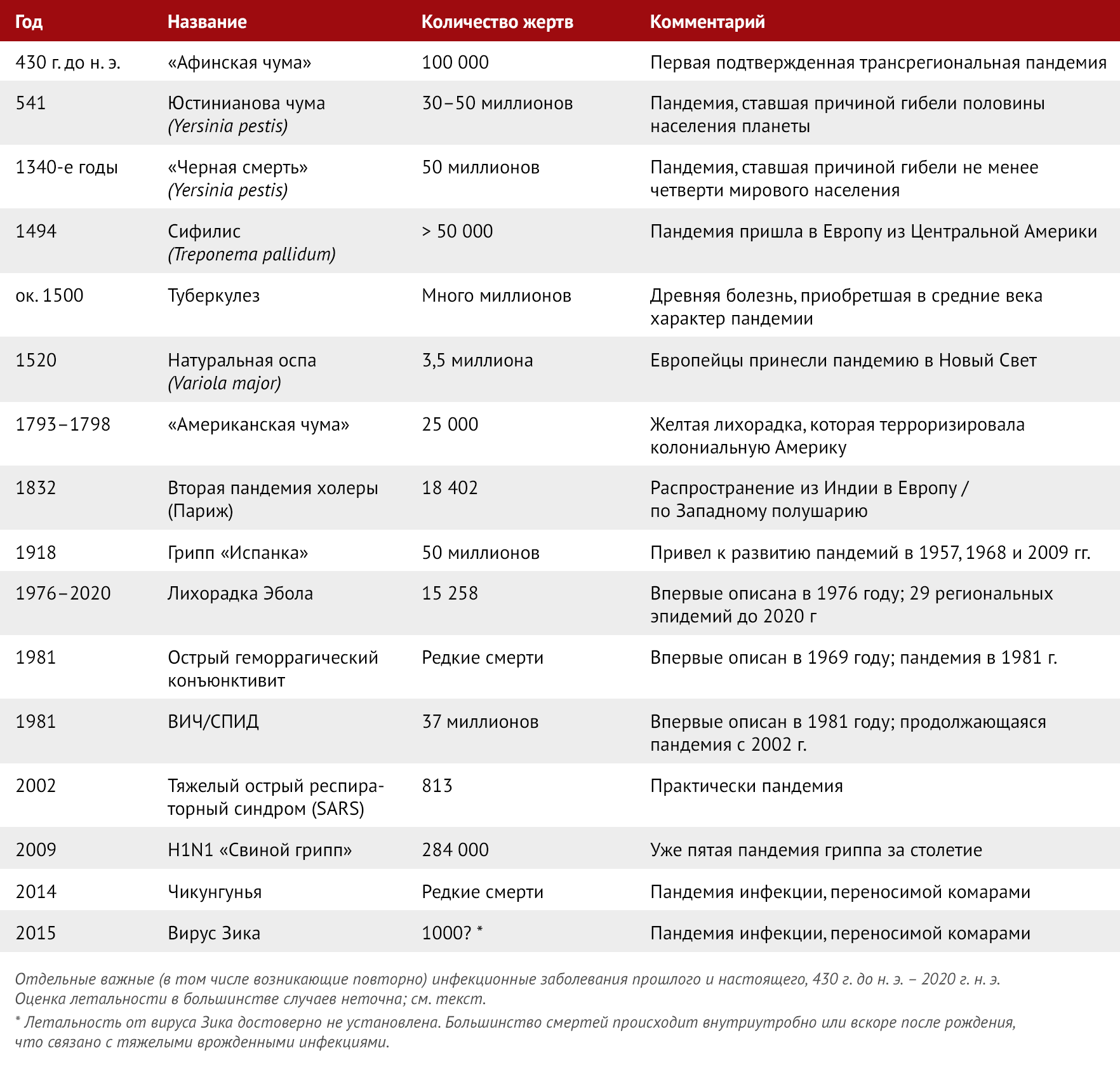
Тем не менее, такие пандемии, как COVID-19, не такое уж и новое явление. Новые (и вновь возникающие) инфекционные заболевания угрожают людям со времен неолита (12 000 лет назад), когда люди (охотники-собиратели) поселились в деревнях, начали приручать животных и выращивать урожай (Dobson and Carper, 1996; Morens et al., 2020b ; Morens et al., 2008a). Это было началом приручения и самыми ранними шагами в систематическом и широко распространенном манипулировании природой. Древнейшие зоонозы (см. Вставку 1), такие как оспа, тропическая малярия, корь и бубонная/легочная чума, имеют смертельные исходы. Некоторые, например, Юстинианская чума (541 год н. э.) и Черная смерть (1348 год) привели к гибели значительной части людей в «известном» мире, то есть мире, записи о котором сохранились, по крайней мере, в Азии, на Ближнем Востоке и в Европе.
Вставка 1 | Термины, относящиеся к возникающим инфекционным заболеваниям
Антигенный иммунодоминант: способность белкового эпитопа вызывать иммунный ответ сильнее, чем ответ на один или несколько соседних эпитопов.
Клеточный тропизм: свойство патогена инфицировать определенный тип клеток.
Эндемический: обозначение инфекционного заболевания, преобладающего в инфицировании человека.
Энзоотический: обозначение инфекционного заболевания, преобладающего в инфицировании животных.
Эпидемия, пандемия: высокий уровень заболеваемости либо распространение инфекции, которое носит глобальный характер или охватывает очень большие географические районы (пандемия).
Эпизоотический, панзоотический: понятия, аналогичные эпидемии и пандемии, но в отношении животных.
Фомит: неодушевленный предмет, принимающий участие в передаче инфекции; например, полотенце или дверная ручка.
Переключение между хозяевами: явление, когда в процессе адаптации патогена к одному организму-хозяину он становится адаптированным и к другому виду хозяина.
Возникновение болезни: появление заболевания у нового хозяина.
Зооноз: инфекция человека, вызванная патогеном животного происхождения, который либо может быть тупиковой инфекцией, либо может инициировать распространение инфекции от человека к человеку.
Всего столетие назад пандемия гриппа 1918 года унесла жизни около 50 миллионов человек, что, по-видимому, стало самым смертоносным событием в зарегистрированной истории человечества (Morens and Taubenberger, 2020). Пандемия ВИЧ/СПИД-а, признанная в 1981 году, унесла жизни не менее 37 миллионов человек. А последнее десятилетие стало свидетелем беспрецедентных пандемических взрывов: свиного гриппа H1N1 (2009 г.), лихорадки чикунгуньи (2014 г.) и вируса Зика (2015 г.), а также вспышек лихорадки Эбола на большей части Африки (с 2014 по настоящее время). Поскольку описано четыре эндемичных типа коронавируса, которые циркулируют в человеческой популяции во всем мире, коронавирусы, должно быть, возникли и распространились в эпоху, предшествующую признанию вирусов патогенами человека. Коронавирус, вызывающий тяжелый острый респираторный синдром (SARS) (SARS-CoV), появился от животного-хозяина (как предполагается, циветты) в 2002–2003 годах и практически вызвал пандемию, прежде чем был уничтожен благодаря мерам контроля общественного здравоохранения. Связанный с этим коронавирус ближневосточного респираторного синдрома (MERS) (MERS-CoV) перешел в организм человека от верблюдов в 2012 году, но с тех пор слабо распространяется среди людей (Cui et al., 2019). COVID-19, выявленный в конце 2019 года, является лишь последним примером неожиданного, нового и разрушительного пандемического заболевания, из чего можно сделать вывод, что мы вступили в эру пандемии (Morens et al., 2020a; Morens et al., 2020b). Причины новой опасной ситуации многогранны, сложны и достойны серьезного изучения.
▶ Читать по теме: Вирус Зика: конец пандемии?
Инфекции прошлого
Размышляя о недавно возникших инфекционных заболеваниях, необходимо сначала рассмотреть существующие в настоящее время инфекции, впервые возникшие в прошлом, но со временем ставшие эндемичными (преобладающими у людей) или энзоотическими (преобладающими у животных) (Fauci and Morens, 2012; Morens et al., 2020b; Morens and Fauci, 2012; Morens et al., 2004). Такие заболевания могут дать важные подсказки о механизмах возникновения и продолжительности болезней, а также о том, почему до сих пор мы были в значительной степени неспособны предотвратить и контролировать многие из них. Тот факт, что многие недавно появившиеся инфекционные агенты и вирусы (далее сгруппированные вместе под термином «микробы») адаптировались к сосуществованию с людьми, подтверждается наличием эндогенных ретровирусов в ДНК человека (Johnson, 2019) и латентным заражением вирусами герпеса, такими как простой герпес (HSV), цитомегаловирус (CMV), вирус Эпштейна-Барр (EBV) и вирус ветряной оспы (VZV). Последний, например, представляет собой высокоцитолитический, крайне контагиозный и потенциально смертельный вирус, который адаптировался к долгосрочному пребыванию в человеческих популяциях с помощью сложного механизма выживания. В отличие от других высококонтагиозных респираторных вирусов, адаптированных к человеку (например, вирус кори), для выживания которых необходимы очень большие популяции, чтобы не заражать восприимчивых людей, вирус ветряной оспы вызывает скрытые нецитолитические инфекции, персистируя в ганглиях, периодически реактивируясь в инфекционную/цитолитическую форму (опоясывающий лишай), которая может передаваться даже в популяциях без циркуляции вируса ветряной оспы новым группам восприимчивых людей и проявляться как высококонтагиозная ветряная оспа.
Существование инфекционных агентов, характерных для человека, таких как ретровирусы, герпесвирусы и многие другие, говорит нам о том, что возникновение определенных заболеваний в давние времена могло привести к долгосрочному выживанию микробов за счет кооптации некоторых наших генетических, клеточных и иммунных механизмов для обеспечения их жизнедеятельности и непрерывной передачи. По терминологии британского биолога Ричарда Докинза, эволюция происходит на уровне конкуренции генов, а мы являемся просто генетическими «машинами для выживания» в конкуренции между микробами и людьми (Dawkins, 1976). Кто из нас разместился на эволюционном «водительском сидении?» — может быть вопросом будущего. Эта точка зрения влияет на то, что мы думаем о возникающих угрозах инфекционных заболеваний и как на них реагируем. С точки зрения человека, тот факт, что современные эндемические болезни возникли и стали распространяться в какой-то незамеченный период в прошлом (Таблица 1) (Morens et al., 2004), и что некоторые из этих болезней «выжили», разработав сложные долгосрочные стратегии выживания, дает убедительное обоснование двойных стратегий для немедленного и долгосрочного контроля заболеваемости. Во-первых, важно препятствовать распространению инфекции, заболеваемости и смертности. Во-вторых, крайне важно предотвратить сохранение инфекционных агентов, которые могут привести к дополнительным чрезвычайным ситуациям, которые в совокупности столь же смертельны или даже более опасны, чем первоначальные (Dobson and Carper, 1996). Тот факт, что генетические «потомки» пандемического вируса гриппа 1918 года по-прежнему вызывают сезонные вспышки во всем мире и столетие спустя все еще убивают в общей сложности миллионы людей (Morens and Taubenberger, 2020), является серьезным напоминанием о том, что возникновение единичного заболевания может иметь последствия, выходящие за рамки заболеваемости и смертности. В давней непрекращающейся борьбе между микробами и человеком генетически более приспособленные микроорганизмы постоянно удивляют нас и зачастую застают врасплох. Последний пример этого — пандемия COVID-19, возникшая в декабре 2019 года, заболеваемость которой по-прежнему стремительно растет во всем мире (Рисунок 1). На данный момент выявлено более 247 миллионов случаев заболевания и зарегистрировано более 5 миллионов смертей (по данным мониторинга Университета Джона Хопкинса от 03.11.2021). Тем не менее, это, несомненно, значительный недочет, отражающий проблемы, связанные с диагностическим тестированием и неточной диагностикой смертельных случаев. Поскольку COVID-19 вызван новым вирусом (SARS-CoV-2), приводящим к развитию целого спектра заболеваний, клинические, патологические и эпидемиологические паттерны которых никогда ранее не наблюдались, мы получаем информацию только постепенно. Когда-нибудь в будущем мы сможем лучше сравнить COVID-19 с другими важными появляющимися заболеваниями, однако в настоящее время мы еще только вступаем в период «познания», который, несомненно, будет удивлять нас, пока мы изо всех сил пытаемся контролировать то, что уже входит в число самых смертоносных пандемий прошлого века.
Таблица 1 | Инфекционные заболевания на протяжении истории

Эмерджентные (новые возникающие) инфекционные заболевания
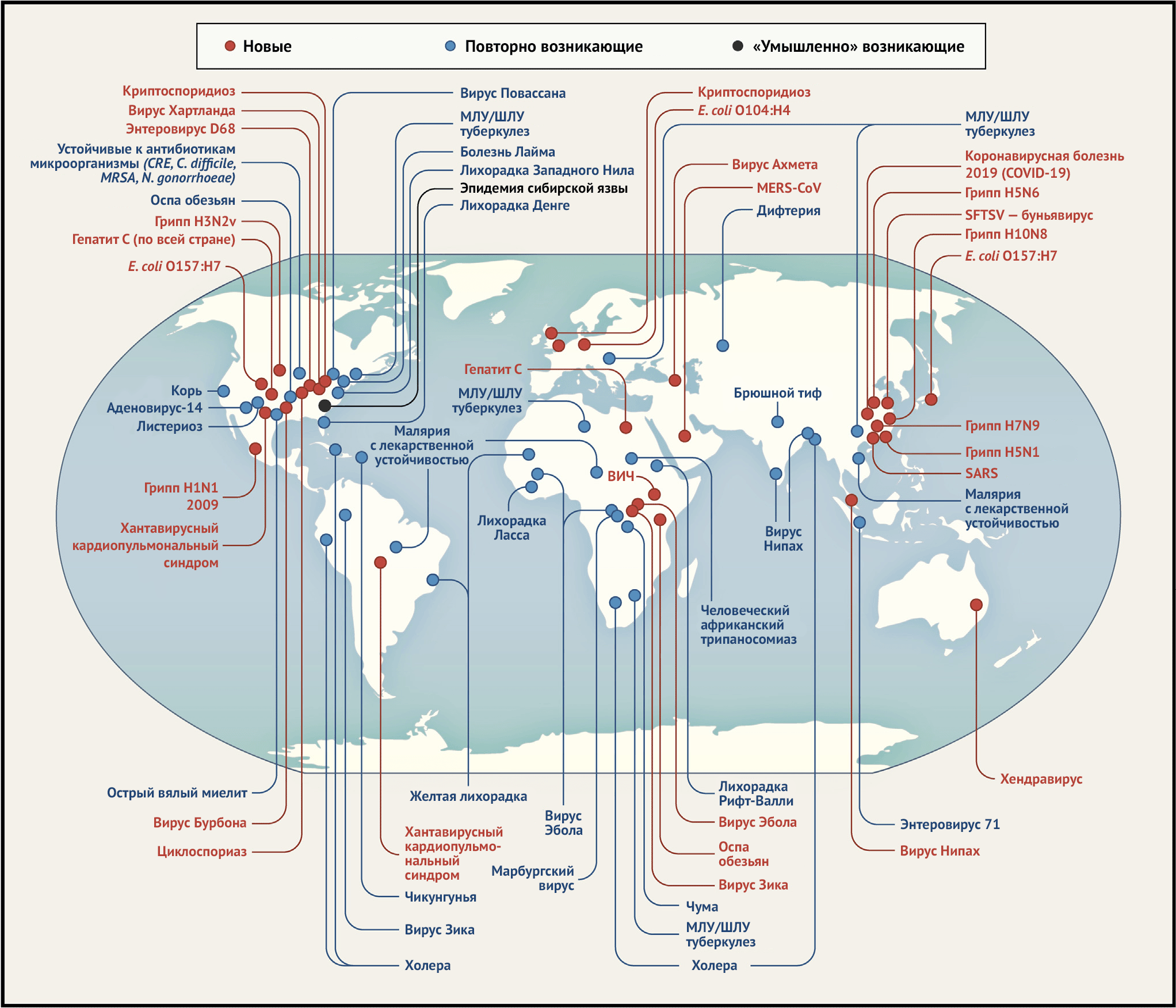
Вышеупомянутые заболевания, например, многие вирусы, вызывающие инфекции верхних дыхательных путей, кишечные инфекции или инфекции, поражающие кожу/слизистые оболочки, не считаются истинно эмерджентными, даже если они меняются в зависимости от сезона или географического положения. Однако на фоне существующих болезней продолжают возникать и новые. Эмерджентные (новые) болезни классифицируются на три типа. Это новые, ранее неизвестные заболевания, старые, повторно получившие распространение и заболевания, вызванные «сознательно созданными патогенами», то есть связанные с биотерроризмом (Таблица 2; Рисунок 2) (Morens и Fauci, 2012; Morens с соавт., 2004, 2008). К ним мы добавляем случайно эмерджентные заболевания, вызванные человеком, такие как повторяющиеся появления полиовирусов вакцинного происхождения (ПВРП) в результате естественных обратных мутаций живых вирусных вакцин, а также живую вакцину, созданную человеком, которая «ускользнула», чтобы вызвать новое эпизоотическое заболевание: естественную вакцину, передаваемую естественным путем (Lum с соавт., 1967). Хотя эти четыре категории отличаются друг от друга, они взаимосвязаны: заболевания, повторно получившие распространение, могут сохраняться, а затем возникать вновь, а также могут распространяться случайно или преднамеренно. Пример пересечения последних двух категорий — инцидент с сибирской язвой в Екатеринбурге в 1979 году. В результате непреднамеренного взрыва на российском заводе по производству биологического оружия сибирская язва попала в воздух, в результате чего погибло не менее 100 человек (Meselson с соавт., 1994). Такие преднамеренно и случайно эмерджентные заболевания представляют собой особую ситуацию, в которой возникновение эпидемии лучше всего предотвратить с помощью глобального сотрудничества в области биобезопасности.
Таблица 2 | Основные категории возникающих инфекционных заболеваний

Среди возможных способов такого сотрудничества — усиление Организации Объединенных Наций и ее агентств, в частности Всемирной организации здравоохранения и Международного бюро пищевой промышленности, Всемирной организации здравоохранения животных. Этого можно добиться несколькими путями: поддержанием совместных многонациональных исследований по предотвращению возникновения болезней, изучением патогенов в соответствующих условиях безопасности, требованием возобновления международных межправительственных усилий на глобальном уровне для сотрудничества в исследованиях, связанных с рисками возникновения патогенов и способами их предотвращения, а также с помощью предотвращения развития биологического оружия. Пятая родственная категория имеет особенно важное значение, поскольку она подчеркивает важность реагирования на угрозы возникновения болезней с помощью контрмер. К этой категории относятся ранее побежденные и контролируемые болезни, то есть те, которые были ликвидированы или даже полностью уничтожены, или которые находятся в процессе ликвидации и/или искоренения (Таблица 3 - Dowdle и Cochi, 2011; Hopkins, 2013; Tomori, 2011). Оспа и ветеринарная чума крупного рогатого скота официально внесены в группу забытых болезней в 1980 и 2011 годах соответственно. SARS, возникший в 2002–2003 годах и распространившийся по всему миру в 29 странах, заразивший 8096 человек и убивший 813 человек, был взят под контроль и в конечном итоге ликвидирован благодаря эффективным мерам общественного здравоохранения (Cui с соавт., 2019). По некоторым определениям, SARS был искоренен, хотя предположительно остается в энзоотической циркуляции и теоретически может возродиться в природе, как Эбола в течение последних 44 лет (Baseler с соавт., 2017). Другие болезни, близкие к искоренению, включают дракункулез, лимфатический филяриатоз, корь, полиомиелит и краснуха (Таблица 3). Такие успехи в уничтожении и контроле отражают наличие усовершенствованных инструментов, стратегий профилактики и борьбы, а также международные (как государственные, так и частные) усилия по снижению смертности и заболеваемости. Успехи в искоренении инфекционных заболеваний и борьбе с ними напоминают нам, что мы не беспомощны перед лицом новых болезней. Уничтожение и борьба с существующими заболеваниями и профилактика, как и борьба с новыми возникающими заболеваниями — это взаимосвязанные усилия, требующие внимания со стороны гражданского, политического, научного сообществ и общественного здравоохранения, которое потребуется для успешного решения этой серьезной проблемы.
Таблица 3 | Отдельные инфекционные заболевания человека
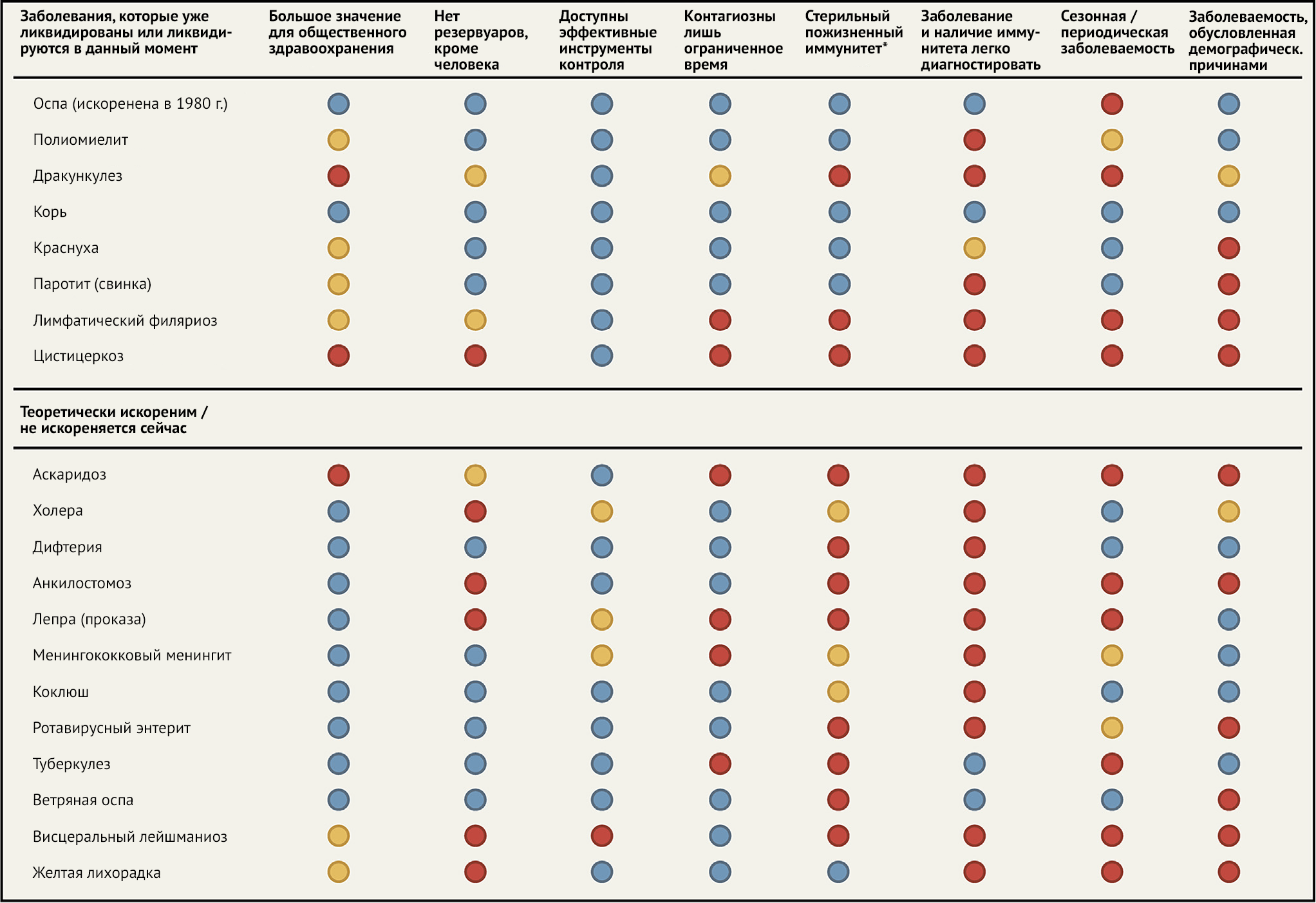
Переменные, относящиеся к способности заболевания к исчезновению (вверху). Отдельные инфекционные заболевания, которые либо уже ликвидированы, либо ликвидируются в настоящее время, либо находятся под серьезным контролем со стороны общественного здравоохранения, а также медицинских или ветеринарных мероприятий (внизу). Инфекционные болезни человека, в настоящее время считающиеся неизлечимыми, но некоторые аспекты которых гипотетически могут быть устранены с помощью существующих инструментов (например, ликвидация человеческого бешенства без или до искоренения бешенства среди диких животных). Информация основана на опубликованных данных, отражающих определения 2008 г. (www.cartercenter.org), дополненных общедоступными публикациями. Столбцы показывают признаки заболевания, которые способствуют ликвидации (синие кружки), имеют неопределенные перспективы к ликвидации (желтый) или, как ожидается, крайне сложны для ликвидации или неискоренимы вовсе (красный). Некоторые из этих характеристик (например, простота выявления болезней и антител, сезонность в тропическом или умеренном климате) являются субъективными и ситуативно изменчивыми; см. текст и ссылки по отдельным заболеваниям.
* Стерильный пожизненный иммунитет относится к способности естественной инфекции или вакцины вызывать такие тип и степень иммунитета, которые предотвращают инфекцию / повторное инфицирование и исключают перенос и передачу инфекции другим людям, животным и резервуарам окружающей среды.
Ключевые фигуры инфекционного процесса: агент, хозяин и среда
Микробы, которые по определению вызывают заболевания человека, существовали в некоторых других экологических нишах задолго до того, как начали заражать людей и других животных. Хотя некоторые из таких организмов долгое время были человеческими патогенами, которые мутировали в новые формы (например, повторное появление устойчивых к антибиотикам бактерий, таких как метициллин-устойчивый золотистый стафилококк (MRSA), большинство из них исторически были зоонозами (Woolhouse and Gowtage-Sequeria, 2005; Woolhouse et al., 2005). Такое появление зоонозных микробов часто связано с мутационными механизмами, позволяющими переключать хозяев с животных на людей, что еще будет обсуждаться далее. Триада причин развития возникающих и других заболеваний, концептуализированная более века назад, представляет собой взаимодействия между инфекционными агентами, их хозяевами и окружающей средой (Рисунок 3). Эта концептуализация признает тот факт, что, хотя сами инфекционные заболевания обязательно вызваны микробными агентами, чрезвычайные ситуации, приводящие к возникновению эпидемии и пандемии, также в значительной степени определяются сопутствующими факторами, связанными с хозяином и взаимодействиями между хозяином и окружающей средой (Centers for Disease Control and Prevention, 2011).
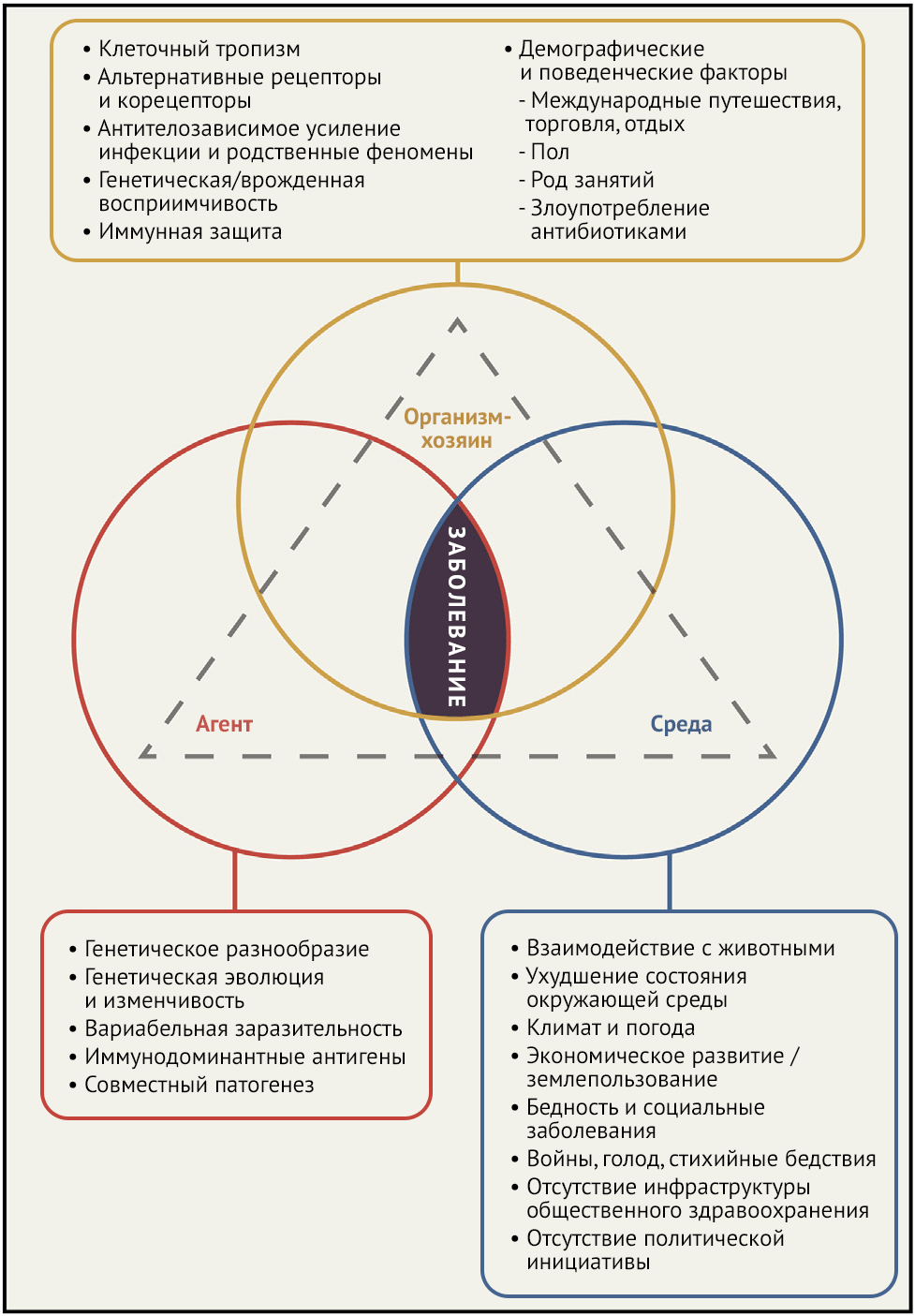
Роль возбудителей инфекционных заболеваний в возникновении эпидемий
Изучение процесса возникновения инфекционных заболеваний начинается с самого возбудителя инфекции. В то время как многие известные заболевания, такие как туберкулез, малярия и холера, являются бактериальными или протозойными, а другие вызваны грибами (например, криптококками) или такими инфекционными агентами, как риккетсии или прионы, большинство важных новых и повторно возникающих заболеваний прошлых веков, все-таки, были вирусными. Поэтому в данном обзоре особое внимание уделяется вирусам, включая SARS-CoV и SARS-CoV-2, а также вирусам гриппа, арбовирусам и вирусам геморрагической лихорадки.
Генетическая нестабильность микроорганизмов является неотъемлемым свойством, позволяющим микробам быстро эволюционировать и адаптироваться к постоянно меняющимся экологическим нишам. Это особенно заметно в отношении РНК-вирусов, таких как вирусы гриппа, флавивирусы, энтеровирусы и коронавирусы, у которых нарушены, а то и вовсе отсутствуют механизмы исправления дефектов полимеразы, в результате чего в окружающей среде циркулируют сотни или даже тысячи генетических вариантов одного и того же вируса, известных как «квазивиды».
Возникновение вирусных заболеваний начинается с генетической пластичности инфекционного агента, который может неоднократно сталкиваться с разными экологическими нишами, в которых он может развиваться и адаптироваться при благоприятных обстоятельствах, например, тех, которые создаются в среде хозяина. Для вирусов, передаваемых от человека к человеку, передача квазивидами может увеличить вероятность того, что один или несколько вирусных вариантов будут сохранять патогенность для клеток нового хозяина, что приведет к инфекции, вирусной амплификации и распространению различных квазивидов, способствующих дальнейшей передаче.
К другим детерминантам возникающих инфекционных агентов относятся, среди прочего, клеточный тропизм, способность обходить врожденный иммунный ответ и доминирование антигенной специфичности. Многие вирусы проникают в клетки через один или несколько клеточных рецепторов (Рисунок 4) (Dai et al., 2020; Jayawardena et al., 2020); некоторые инфицируют разные клетки через разные рецепторы, в то время как некоторые клеточные рецепторы могут представлять собой входные ворота для множества разных типов вирусов. Ситуация чрезвычайно сложна с точки зрения как вируса, так и хозяина, с огромным набором как классических, так и альтернативных рецепторов и корецепторов, а также бесчисленным множеством вирусов, способных их использовать, что свидетельствует о том, что вирусы явно обладают глубокими эволюционными корнями в природе (Baranowski et al., 2001). Примером могут служить SARS-подобные бета-коронавирусы летучих мышей или сарбековирусы, рецепторные связывающие домены которых, по-видимому, гиперэволюционируют при взятии проб различных рецепторов млекопитающих (Hu et al., 2017).
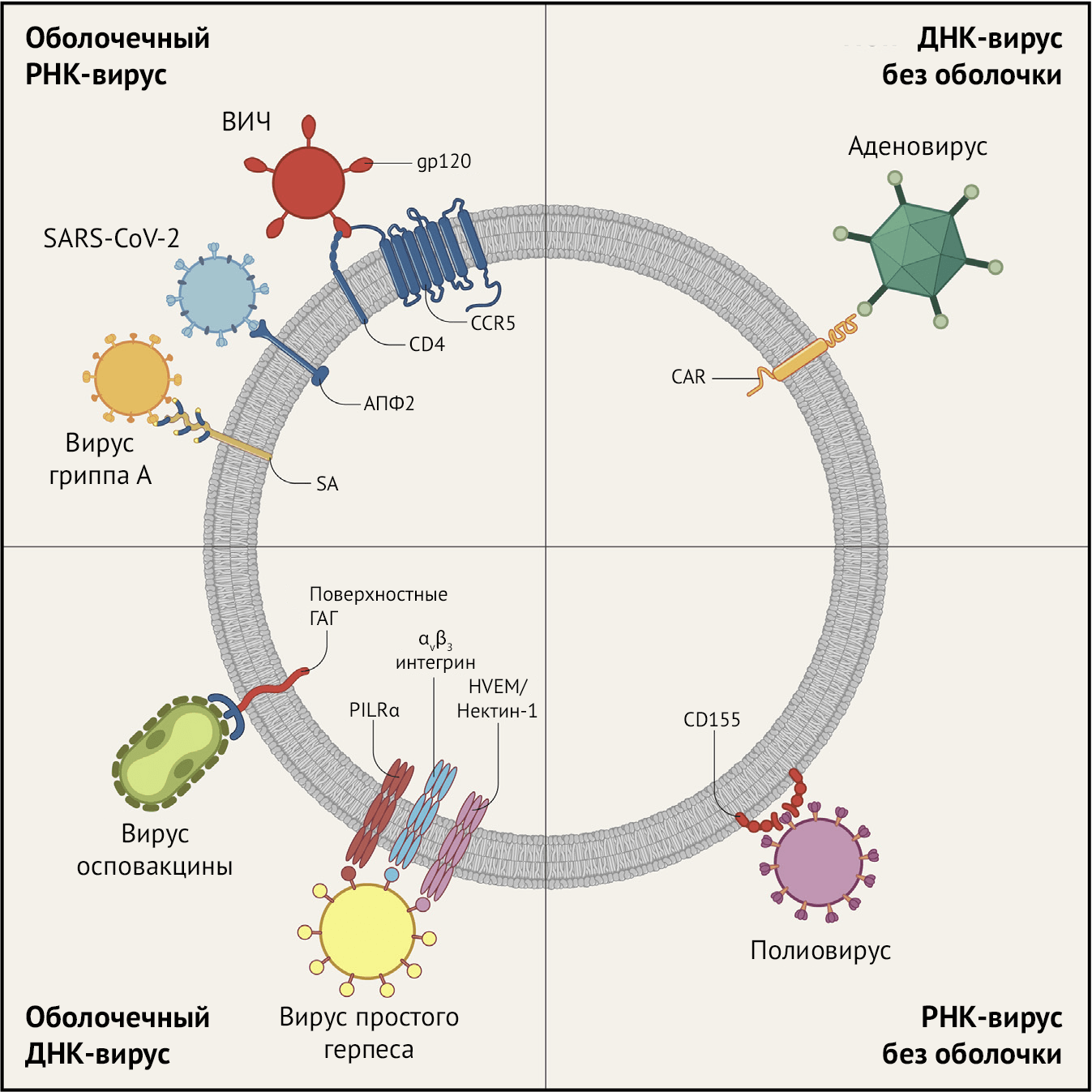
Многие вирусы проникают в клетки посредством фагоцитоза или пиноцитоза, последний включает клатрин-опосредованный или опосредованный клавеолином эндоцитоз, а другие вирусы проникают в клетки посредством слияния или прямого проникновения (Dai et al., 2020). SARS-CoV и SARS-CoV-2 — это бета-коронавирусы, которые проникают в клетки человека через рецепторы ангиотензинпревращающего фермента-2 (АПФ2), аналоги которого повсеместно встречаются в клетках и других видов (Cui et al., 2019; Hasan et al., 2020). Это означает, что коронавирусы многих других видов млекопитающих могут быть по существу предварительно адаптированы к организму человека. Фактические данные свидетельствуют о том, что существует множество коронавирусов летучих мышей, предварительно адаптированных к человеку, и, возможно вызывающих пандемию (Andersen et al., 2020; Hasan et al., 2020; Hu et al., 2017; Menachery et al., 2016; Wang et al. др., 2018; Zhou et al., 2020а). Вирусы гриппа A (IAV) инфицируют клетки посредством связывания с терминальными сиаловыми кислотами, обнаруженными на поверхности клеток просвета респираторного эпителия птиц, млекопитающих и человека, и содержат нейраминидазу, которая расщепляет те же рецепторы, чтобы обеспечить высвобождение вируса, что способствует его дальнейшей передаче (Morens и Taubenberger, 2020; Taubenberger et al., 2019). Поскольку сиаловые кислоты обнаруживаются на большом количестве клеток, неудивительно, что многие вирусы прикрепляются к этим рецепторам, хотя их сродство к ним не до конца изучено. Например, тесты на лектины in vitro предполагают различную аффинность гриппа к различным типам концевых сиаловых кислот, например, с a-2,3 (птичьим) и с a-2,6 (млекопитающим) связями. Однако анализ аутопсийных материалов подтвердил наличие смертельных инфекций, вызванных вирусом гриппа A, которые афинны к любому из рецепторов в организме человека, что отражает сложность взаимодействий вирус-хозяин в животном мире.
Еще один аспект заражения вирусом заключается в том, что некоторые из них (например, ВИЧ, вирус гриппа) экспрессируют на своей поверхности иммунодоминантные эпитопы, которые играют важнейшую роль в развитии иммунного ответа, что приводит к менее устойчивым иммунным реакциям на другие, часто смежные, эпитопы. Это может давать эффект «притупления» или ограничения диапазона оптимального иммунного ответа организма хозяина. Почти все вирусы содержат белки, которые подавляют врожденные защитные реакции макроорганизма, такие как, например, продукция интерферонов (Blanco-Melo et al., 2020; Mesev et al., 2019). Некоторые вирусы способны инфицировать клетки, несущие FcR, посредством антителозависимого усиления инфекции или ADE (antibody-dependent infection enhancement) — механизма, с помощью которого IgG «привязываются» к поверхности клетки, облегчая проникновение вирусных частиц через другие рецепторы (Morens, 1994; Sullivan , 2001). Во время эпидемии SARS 2002–2003 годов было обнаружено, что как постинфекционные, так и возникшие в результате вакцинации антитела вызывали ADE-эффект с SARS-CoV in vitro (Jaume et al., 2012; Wang et al., 2016, 2014; Yip et al., 2014). Неизвестно, имеет ли это явление, изучаемое в основном in vitro, последствия для естественных человеческих коронавирусных инфекций (Wan et al., 2020), тем не менее, это представляет потенциальную проблему для разработки вакцин против SARS-CoV и SARS-CoV-2.
Является также проблемой для разработки вакцины против SARS-CoV-2 и то, что естественное заражение коронавирусом кошек (FECV) инициирует нефатальную инфекцию, которая иногда приводит к развитию вирусных вариантов, которые являются макрофаг-тропными и могут связываться с антителами организма-хозяина (антитело против внешнего вирусного белка, которое прикрепляется к рецепторам АПФ2 и вызывает защитный иммунитет), позволяя вирусам проникать в макрофаги через FcR (тот самый ADE), что приводит к смертельному заболеванию, известному как инфекционный перитонит кошек (Vennema et al., 1990; Weiss and Scott, 1981). Постинфекционное редактирование генов организмом-хозяином также было рассмотрено в качестве механизма развития подострого склерозирующего панэнцефалита (SSPE), смертельного заболевания, связанного со стойкой инфекцией вируса кори, осложненной возникающими мутациями этих вирусов (Cattaneo et al. , 1986). К счастью, вирусы, вызывающие SSPE, полученные в результате редактирования генома, не всегда способны передаваться в популяциях.
Согласно экспериментальным исследованиям, ранняя гибель кошек, ассоциированная с инфекционным перитонитом, является результатом как вакцинации белком FIPV (feline infectious peritonitis viruses), так и пассивного переливания антител против FIPV (Vennema et al., 1990; Weiss and Scott, 1981). Ни FECV, ни FIPV филогенетически не близки к SARS-CoV или SARS-CoV-2, оба являются a-коронавирусами, экспрессирующими аминопептидазу-N или другие рецепторы белков/гликанов, а не рецепторы АПФ2, с которыми связываются b-коронавирусы типа SARS. Но данные о ADE с множеством различных a- и b-коронавирусов позволяют предположить, что по мере продвижения к разработке вакцин и терапевтических антител против SARS-CoV-2, еще многое предстоит узнать об этом сложном вирусном семействе.
Также важное значение для возникновения инфекционных заболеваний имеют генетические свойства того или иного вируса, ассоциированные с патогенностью, что наиболее ярко проявляется на примере пандемии гриппа А. Пандемический вирус H1N1 1918 года, унесший жизни около 50 миллионов человек (что эквивалентно 200 миллионам человек с поправкой на численность населения 2020 года), стал таким смертоносным из-за, по крайней мере, двух присущих ему свойств: 1) гемагглютинина H1 птичьего происхождения, т. е. необычно цитопатогенного и иммунопатогенного по сравнению с гемагглютининами большинства других вирусов гриппа А и 2) выраженная патогенность, вирусная генетическая основа которой остается плохо изученной, чтобы вызывать смертельные бактериальные бронхопневмонии в сочетании с пневмопатогенными бактериями, незаметно переносимыми в верхних дыхательных путях человека. (Morens et al., 2008b; Morens, Taubenberger, 2020; Taubenberger et al., 2019). Теперь мы знаем, что не только гемагглютинин птиц, но и 4 из 15 других вариантов гемагглютинина, обнаруженных в организме диких водоплавающих и береговых птиц (Anseriformes и Charidriiformes), обладают схожими патогенными свойствами и, таким образом, представляют потенциальную угрозу возникновения смертельных пандемий (Morens and Taubenberger, 2020; Taubenberger et al., 2019). Возможно, еще более шокирующим примером возникновения пандемии, связанной с высочайшим уровнем патогенности, является вирус Зика — флавивирус, известный на протяжении десятилетий. Данный вирус никогда не был причиной эпидемии среди людей, однако в 2015 году он внезапно распространился по всему тропическому поясу мира, вызвав миллионы случаев инфекций и став причиной выкидышей, мертворождений и тяжелых врожденных пороков развития у детей (Fauci and Morens, 2016). Причиной пандемии оказалась мутация, которая привела к изменению одной аминокислоты во внешнем вирусном гликопротеине (Shan et al., 2020).
Патогенная изменчивость, несомненно, применима ко многим другим типам вирусов, примером чего может служить сравнение высокопатогенного штамма эболавируса Заир с близкородственным, но низкопатогенным штаммом эболавируса Рестон (Baseler et al., 2017). Несмотря на то, что патогенная изменчивость еще недостаточно изучена, она также может наблюдаться у коронавирусов животных. Тот факт, что все три недавно появившихся коронавируса человека (возбудители SARS, MERS и COVID-19) вызывают высокую степень заболеваемости и приводит к значительной смертности людей, позволяет предположить, что энзоотические коронавирусы в целом по своей природе могут быть патогенными и для человека. С одной стороны, предварительные данные предполагают, что SARS-CoV-2 может вызывать врожденный иммунный ответ, связанный со снижением экспрессии интерферонов I и III и с увеличением продукции провоспалительных цитокинов (Mesev et al., 2019), что согласуется с более ранними исследованиями COVID-19 (Vanderheiden et al., 2020). С другой стороны, предварительные данные предполагают, что вирусно-бактериальная ко-инфекция при SARS-CoV-2 представляет собой гораздо меньшую опасность, чем при гриппе, кори и других патогенных респираторных вирусах, хотя результаты масштабных клинических исследований еще не опубликованы.
Что касается тяжести коронавирусной инфекции, стоит принять во внимание общепринятое мнение (кстати, не всегда верное),что вирус, убивающий своего хозяина, ограничивает свою собственную способность к передаче и что при передаче от человека к человеку предполагается, что они со временем будут селектированы с ослаблением патогенности. Исходя из этой логики, вполне возможно, что четыре эндемичных коронавируса человека: b-коронавирусы OC43 и HKU1 и a-коронавирусы 229E и NL63, возникли давно как зоонозные и, возможно, высокопатогенные вирусы, которые со временем эволюционировали в ослабленные формы (Cui et al., 2019). Такое естественное ослабление патогенности еще не наблюдалось с возбудителями SARS, MERS или COVID-19, хотя летальность от SARS-CoV-2 составляет 1 %, а также имеются данные о значительной доле бессимптомной передачи. Более того, эволюция вирусов в сторону более низкой патогенности распространяется далеко не на все инфекционные заболевания. Для многих других микроорганизмов, таких как холерный вибрион (экспрессирующий токсин бактериофага, вызывающего диарею) или ротавирусная инфекция (тоже с диареей, вызванной токсином NSP4), или для туберкулеза легих и многих респираторных вирусов, повреждение желудочно-кишечного тракта и легких, соответственно, способствует передаче, и поскольку диарея и кашель способствуют еще большему выбросу инфекционных агентов в окружающую среду, увеличивая вероятность дальнейшего заражения. Таким образом, с одной стороны серьезность заболевания отражает баланс между гибелью или заболеванием организма-хозяина, а с другой оптимизацией процесса передачи микроорганизма и, следовательно, выживанием. Аналогичные принципы могут также применяться и к не вирусным инфекционным заболеваниям, передающимся через окружающую среду: например, в случае энзоотической сибирской язвы уничтожение хозяина может быть важным механизмом передачи, поскольку в земле, куда складируют гниющие туши скота, остаются споры сибирской язвы, что может привести к повторному возникновению вспышек данной инфекции в будущем (Turner et al. ., 2014).
Роль организма-хозяина в возникновении инфекционных заболеваний
Параметры организма-хозяина, необходимые для возникновения инфекционных заболеваний, включают в себя как особенности, специфичные для отдельных лиц, так и относящиеся к популяции в целом (Morens и Fauci, 2012; Morens и соавт., 2004, 2008). Так как вирус реплицируется в клетках хозяина, и поскольку вирусы обычно инфицируют хозяев через специфические рецепторы на клетках различных тканей и органов, организм-хозяин должен экспрессировать клеточные рецепторы или иметь другие свойства поверхности клеток, с помощью которых вирус мог бы связаться и проникнуть в клетку. Основные пути проникновения инфекционных агентов — органы, которые находятся вне окружающей среды (кожа); те, которые могут быть доступны непосредственно из окружающей среды (например, дыхательный и желудочно-кишечный тракт), а также органы, доступные из системного кровотока (такие как печень и сердце). В организме человека есть множество систем органов, каждая из которых состоит из различных типов клеток, и каждая клетка имеет множество различных рецепторов. Поэтому неудивительно, что переключение патогена с животного-хозяина на организм человека приводит к очень разным клиническим и эпидемиологическим последствиям, включая различные проявления заболевания и механизмы передачи. Эти факторы связаны с возможностью развития инфекции у нового хозяина, а также с вероятностью устойчивой передачи в новой популяции, и влияют на успешность или неудачу переключения организмов-хозяев. SARS-CoV и SARS-CoV-2 проникают в клетки через рецепторы АПФ2 (Wang и соавт., 2020), обнаруженные на поверхности альвеолоцитов легких, энтероцитов желудочно-кишечного тракта, артериальных и венозных эндотелиальных клеток и гладких миоцитов артерий, а также среди других клеток (Hamming и соавт., 2004; Wang и соавт., 2020), что объясняет процесс выведения SARS-CoV-2 и его потенциальную передачу через дыхательные пути и кишечник. Хотя SARS-CoV-2 поражает клетки желудочно-кишечного тракта, фекальный путь передачи на сегодняшний день не связан со значительным распространением вируса от человека к человеку.
Различные вирусы используют совершенно разные стратегии связывания и проникновения в клетки, например, полиовирусы, ВИЧ, вирусы гриппа, коронавирусы и другие (рис. 4) (Bowers и соавт., 2017; Cicala и соавт., 2011; Jayawardena и соавт. др., 2020; Laureti и соавт., 2018). Некоторые вирусы проникают в клетки посредством связывания с двумя ближайшими рецепторами — первичным и вторичным (например, c рецепторами для связывания и слияния), как многочисленные флавивирусы (Laureti и соавт., 2018). Как уже отмечалось, механизмы проникновения вирусов в клетки чрезвычайно разнообразны и сложны (Jayawardena и соавт., 2020). Вирусы также могут инфицировать макрофаги и макрофагоподобные клетки, как в случае клещевых флавивирусов, переносимых комарами. Эти вирусы вносятся в периваскулярную ткань дермы соответствующими векторами, захватываются дендритными клетками и переносятся в региональные лимфатические узлы, где они вызывают системную инфекцию. Антителозависимое усиление инфекции, описанное выше, и другие подобные явления тоже могут способствовать клеточной инфекции (Morens, 1994; Sullivan, 2001). Тропизм к тканям/клеткам также влияет на типы вызываемых иммунных ответов. Например, при системной инфекции, такой как корь, виремия с высокой вирусной нагрузкой связана с инфицированием нескольких органов, тканей и типов клеток; возникающие в результате широкие системные В- и Т-клеточные ответы приводят к приобретению пожизненной защиты от повторного заражения. Напротив, вирусы гриппа A и респираторно-синцитиальный вирус (RSV) среди многих других респираторных вирусов, которые инфицируют поверхностные эпителиальные клетки, не вызывают виремию и инфицируют только поверхностные респираторные эпителиоциты.
В результате не происходит непосредственного взаимодействия вирионов с иммунной системой. Основным местом взаимодействия вируса гриппа и иммунной системы является неинкапсулированная лимфоидная ткань, ассоциированная со слизистыми оболочками (mucosa-associated lymphoid tissue, MALT) носоглотки, евстахиевой трубы, ротоглотки (TALT, NALT), а также в постнатально развивающейся лимфоидной ткани, ассоциированной с бронхами (iBALT, Moyron-Quiroz и соавт., 2007). Такая организация ткани приводит к компартментализации иммунного ответа. Это частично объясняет слабый иммунный ответ на естественные и ассоциированные с вакцинными штаммами вирусы гриппа и респираторно-синцитиальный вирус (RSV). Предварительные данные клинических и морфологических исследований SARS-CoV и SARS-CoV-2, которые указывают на вирусную инфекцию нескольких типов тканей, согласуются с развитием надежного и, как надеются ученые, длительного защитного иммунитета, обеспечивающего возможность контроля COVID-19 с помощью вакцин. Еще более важной представляется экспрессия рецепторов АПФ2 на эндотелиоцитах и многих других клетках, а также данные аутопсий, свидетельствующие о значительной эндотелиальной инфекции SARS-CоV-2 (Fox и соавт., 2020), что согласуется с общей картиной системной вирусной инфекции, приводящей как к легочным, так и к внелегочным заболеваниям, в том числе и к часто обсуждаемому образованию микротромбов. Некоторые вновь появляющиеся вирусы сталкиваются с ранее существовавшим частичным популяционным иммунитетом, как, например, вирусы пандемического гриппа. В частности, во время пандемий гриппа 1968 и 2009 годов, вызванных вирусами H3N2 и H1N1 соответственно, определенные группы населения имели ранее существовавший иммунитет, который препятствовал распространению вируса и, возможно, его эволюции. Несмотря на то, что популяционного иммунитета недостаточно для предотвращения пандемии, он все же защищает определенные слои населения (Morens и Taubenberger, 2020; Taubenberger и соавт., 2019).
Фактически во время большинства пандемий гриппа специфическая для этого заболевания летальность среди пожилых людей, которая регулярно увеличивается в возрасте около 60 лет при сезонном гриппе, очевидно, сдерживается малоизученными на сегодняшний день иммунными эффектами, возникающими в результате предшествующих контактов с вирусами гриппа, что подчеркивает сложность как самой вирулентности возбудителя гриппа, так и факторов устойчивости хозяина (Morens and Taubenberger, 2011). И напротив, есть предположения, что уменьшение естественных инфекций патогенами или вакцинация против них могут способствовать появлению родственных организмов, например, увеличение заболеваемости оспой обезьян после прекращения вакцинации против оспы, последовавшей за ликвидацией данного возбудителя (Lloyd-Smith, 2013) или давняя теория о том, что новые энтеровирусы появятся (или уже появляются), чтобы заполнить «экологическую нишу», созданную в результате почти полного искоренения трех полиовирусов (Rieder et al., 2001). В случае COVID-19 некоторые данные свидетельствуют об отсутствии ранее существовавшего популяционного иммунитета, обеспечиваемого воздействием четырех эндемичных коронавирусов, достаточного для предотвращения инфекции (Corman et al., 2018). Невзирая на то, что данные вирусы имеют несколько общих эпитопов, которые в значительной степени перекрестно реагируют с SARS-CoV-2 в серологических исследованиях, было высказано предположение, что перекрестная защита от эндемического коронавируса может, тем не менее, предотвратить заболевание или, по крайней мере, снизить его тяжесть у некоторых людей, особенно у молодых (Nickbakhsh и др., 2020).
Быстро распространяются пока еще предварительные данные о том, что тяжесть инфекционного заболевания или даже восприимчивость к нему в некоторых случаях могут быть связаны с определенными генетическими параметрами организма-хозяина, относящимися к врожденному иммунному ответу, как в случае с информацией о тяжелом заболевании, вызванном гриппом, ассоциированным с H5N1 у домашних птиц (Morens and Taubenberger, 2015). Несколько генов организма-хозяина были предварительно ассоциированы с предрасположенностью к таким тяжелым исходам вирусных заболеваний (Nguyen et al., 2020; Tang et al., 2008), включая аллель SNP rs22522-C, связанный с интерфероном, трансмембранный белок 3 (IFITM3) (Everitt et al. al., 2012; Zheng et al., 2017), которые были рассмотрены (на основании предварительных данных) как гены, связанные с тяжестью SARS-CoV-2 (Zhang et al., 2020). Кроме того, дифференциальные взаимодействия с IFITM, такими как IFITM3, включают ингибирование эндемического α-коронавируса человека при одновременном усилении проникновения β-коронавирусов SARS-CoV и MERS-CoV (Huang et al., 2011; Zhao et al., 2018). Что касается COVID-19, несколько исследований связывали I группу крови в системе ABO с тяжестью заболевания, хотя механизмы этого эффекта еще не ясны. Некоторые системные взаимосвязи ABO с инфекционными заболеваниями были также продемонстрированы для инфекций, вызванных норовирусами, H. pylori и малярией falciparum; однако любые такие ассоциации могут также быть косвенными маркерами неродственных генов. Новые данные начинают определять риски иммунотипа человека для возникновения более тяжелых заболеваний (Mathew et al., 2020), а также возможные генетические признаки тяжелых болезней (Gussow et al., 2020).
В настоящее время данные, устанавливающие конкретную генетическую предрасположенность, остаются неубедительными для большинства заболеваний, включая коронавирусную инфекцию. Это область исследований, которая, вероятно, будет иметь важное значение в будущем, поскольку определение предрасположенности к серьезности заболеваний человека имеет большое значение для профилактики, диагностики и лечения. К наиболее важным факторам организма-хозяина для развития заболеваний относятся урбанистические факторы, например, рост населения, его плотность, перемещения людей и многие другие, включая поведение, которое либо нарушает окружающую среду, либо приводит к появлению новых, искусственно созданных экологических ниш (рис. 3). Что касается передвижения людей, то и Черная смерть 1347–1348 годов (бубонная/легочная чума), и пандемия холеры 1832 года (которая распространилась из Индии в Европу, а затем в Западное полушарие) распространились по основным торговым и туристическим маршрутам. В 1831–1832 годах, за 45 лет до того, как была сформулирована связная «теория микробов», было ясно, что по мере того, как холера медленно распространялась на запад, она двигалась не быстрее, чем путешествовали кареты и корабли: зимой она замедлялась по мере замедления передвижения, и летом снова набирала обороты по мере увеличения интенсивности сообщения. Пандемия гриппа 1889 года пришла на Запад из Азии в Европу по железным дорогам, а затем распространилась по всему миру по морским маршрутам. В ходе пандемии гриппа 1957 года вирус передавался на кораблях, но 11 лет спустя пандемия гриппа 1968 года распространялась уже воздушными путями, что стало первым примером глобального распространения пандемии с помощью самолетов. В 1981 году острый геморрагический конъюнктивит распространился между международными воздушными узлами в тропиках и некоторых зонах с умеренным климатом (например, во Флориде и Северной Каролине). В 2002–2003 годах SARS по воздуху пришел из Гонконга в Западное полушарие и Европу. В 2019–2020 годах SARS-CoV-2 распространился по всему миру из Китая аналогичным образом. Эти многочисленные примеры отражают исключительную важность роста населения и передвижения людей в распространении болезней: чем более густонаселенным и многолюдным становимся мы как вид и чем больше мы путешествуем, тем больше у нас возможностей для возникновения новых болезней.
Роль окружающей среды в возникновении инфекционных заболеваний
Многие виды деятельности человека, связанные с окружающей средой, имеют важные последствия для возникновения болезней (Allen et al., 2017; Dobson and Carper, 1996; Fauci and Morens, 2012; Morens et al., 2020b; Morens and Fauci, 2012; Morens et al., 2004, 2008a, 2019; Morens and Taubenberger, 2020). Человек начал хранить воду в Северной Африке около 5000 лет назад, что привело к появлению нового, исключительно адаптированного для человека комара Aedes aegypti, который создал вторичную экологическую нишу для появления вируса желтой лихорадки и столетия спустя — денге, чикунгунья и Зика, которые затем стали повсеместно распространяться. Склады автомобильных резиновых шин создают идеальные места для размножения родственного адаптированного для человека комара Aedes albopictus, который в последние десятилетия распространился по всему миру в тропических и субтропических зонах, передавая многие из арбовирусных заболеваний, хотя и менее эффективно. Как и ожидалось, вирусы и вирусные векторы адаптировались к воздействиям окружающей среды: мутация одного локуса в адаптированном к Aedes aegypti штамме вируса чикунгунья в Индийском океане недавно адаптировала его (без потери пригодности для А. aegypti) к А. albopictus, широко распространенному в регионе (Tsetsarkin and Weaver, 2011).
Практика землепользования была связана с повторными вспышками восточного энцефалита лошадей (Morens et al., 2019); вырубка лесов — с появлением вирусов Зика и Хендра; дорожное строительство и ухудшение состояния окружающей среды — с распространением боливийской геморрагической лихорадки и ВИЧ (инфекция, которая распространялась водителями грузовиков и женщинами, вовлеченными в проституцию на стоянках грузовых фур); а также бедность, скученность и плохие санитарные условия приводили к повторным появлением многих болезней, таких как туберкулез и холера. На протяжении веков войны также приводили к возвращению многих болезней (Dobson and Carper, 1996; Fauci and Morens, 2012; Morens and Fauci, 2012; Morens et al., 2004, 2008a, 2020b; Morens and Taubenberger, 2020), например, эпидемия сербского тифа во время Первой мировой войны, унесшая жизни 150 000 человек, в основном мирных жителей. В 1700-х годах, когда сыпной тиф еще не был идентифицирован как конкретное заболевание, в учебниках под нозологическими терминами «военный тиф» и «тюремный тиф» перечислялись два отдельных состояния, что отражало деятельность человека, которая спровоцировала возникновение болезни в давние времена. Классический текст по эпидемиологии, опубликованный более века назад и изучаемый до сих пор, называется «Эпидемии в результате войн» (Prinzing, 1916). Предполагается, что SARS-CoV-2 возник в 2019 году, как и SARS-CoV в 2002 году, а также грипп, связанный с птицами H5N1 и H7N9, — в 1997 и 2013 годах, соответственно, на рынках Китая в условиях влажной среды (Morens et al., 2020a; Morens et al., 2020b). Таким образом, эти четыре заболевания могут представлять собой четыре смертельных случая за 18-летний период в результате определенной культурной практики в конкретных регионах мира. Эти и многие другие примеры (Dobson and Carper, 1996; Fauci and Morens, 2012; Lu et al., 2020; Morens and Fauci, 2012; Morens et al., 2004, 2008a, 2019, 2020b; Morens and Taubenberger, 2020; Zhang and Holmes, 2020; Zhou et al., 2020b) представляют собой мощный аргумент в пользу того, что человеческая деятельность стала ключевым фактором, определяющим возникновение болезней.
Возникновение заболеваний, приводящих к эпидемиям
Как бы поведение человека ни приводило к возникновению инфекционных заболеваний, вновь возникший микроорганизм не может постоянно выживать в организме хозяина без адаптации к одному из нескольких прямых или косвенных механизмов распространения от человека к человеку (таблица 4). Многие появляющиеся микроорганизмы, такие как хантавирусные агенты хантавирусного легочного синдрома и корейской геморрагической лихорадки или аренавирусы, вызывающие аргентинскую, боливийскую геморрагические лихорадки, а также лихорадку Ласса, возникают в результате тупикового контакта с грызунами-резервуарами и редко передаются от человека к человеку. Таким образом, предотвращение и контроль таких чрезвычайных ситуаций сосредоточены на энзоотическом резервуаре. Передача от человека к человеку (необходимый шаг в установлении фактов эпидемичности и пандемичности после смены хозяина) может происходить посредством одного или нескольких из четырех основных (таблица 4):
- респираторный;
- желудочно-кишечный;
- распространение в окружающей среде через промежуточные звенья, такие как вода, пища и фомиты;
- распространение в окружающей среде посредством инокуляции, в том числе трансмиссивно.
Таблица 4 | Механизмы передачи инфекции от человека к человеку и от животного к человеку
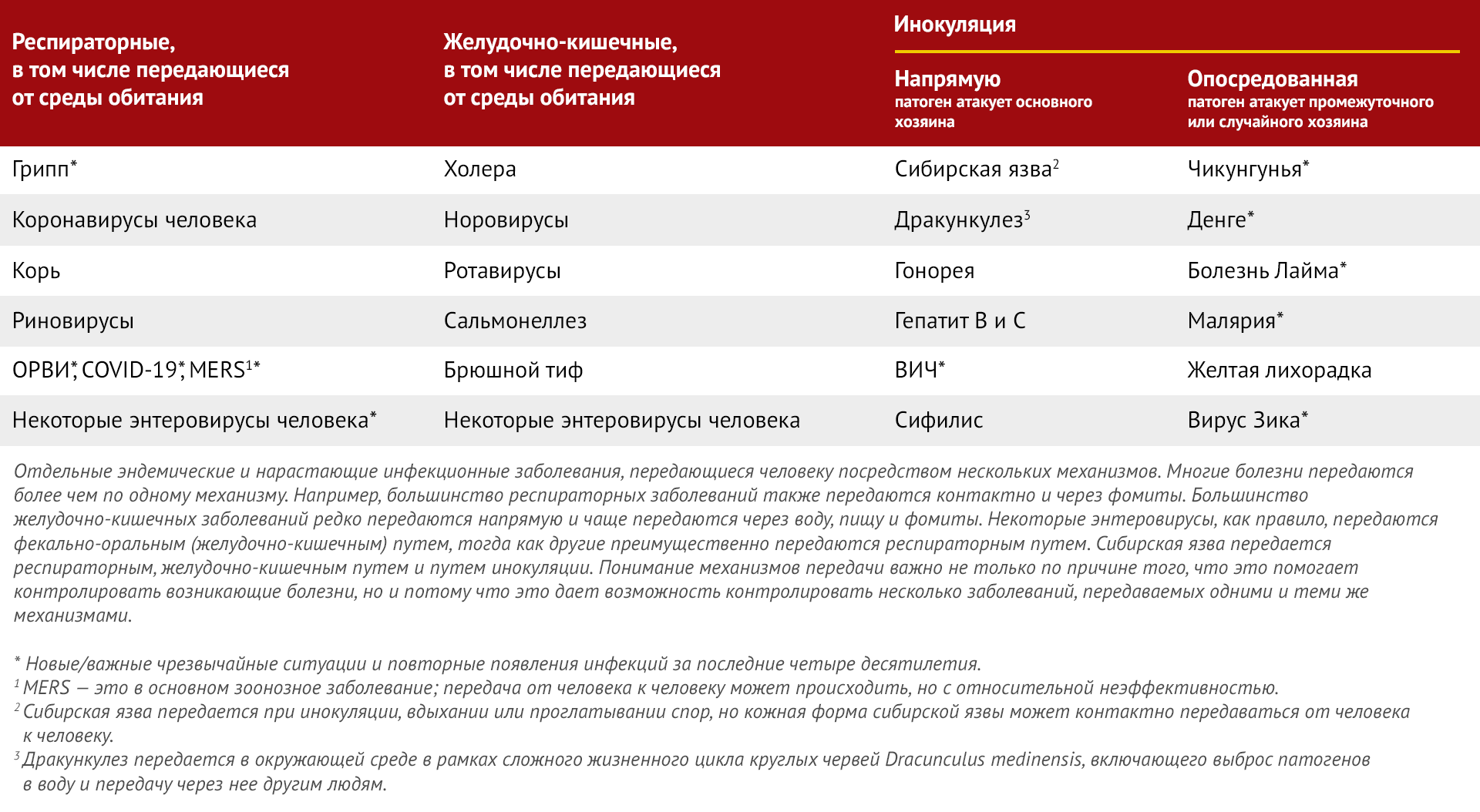
Примечательно, что эти механизмы отражают не только социальные обычаи человека, такие как санитарная практика, физическая близость и сексуальная активность, но и способы взаимодействия людей с окружающей средой, такие как хранение и питье воды из разных источников, добыча продуктов питания и практика кулинарной подготовки. Даже в этом случае многие переменные взаимодействуют, создавая различные клинические и эпидемиологические аспекты заболевания, передаваемого от человека к человеку. Например, в то время как и Эбола, и SARS-CoV-2 являются потенциально смертельными заболеваниями, передаваемыми от человека к человеку, SARS-CoV-2, как и большинство респираторных заболеваний, во многих случаях ассоциируется с бессимптомной инфекцией. Более того, механизмы передачи от человека к человеку различны для этих двух заболеваний. SARS-CoV-2 передается через руки и фомиты, респираторные капли и аэрозоль, включая передачу в результате сверхраспространения, когда большое количество людей заражается от одного человека, почти всегда в закрытых многолюдных местах. Эбола, с другой стороны, передается через зараженные вирусом выделения организма, и инфекция обычно передается от людей, соприкасающихся с зараженными жидкостями или фомитами, например, при оказании медицинской помощи, захоронении, пользовании полотенцами, постельным бельем, посудой и т. д. (Baseler et al., 2017).
Несмотря на то, что общие принципы передачи инфекций уже давно понятны, некоторые отдельные заболевания могут различаться по клиническим и эпидемиологическим характеристикам, которые влияют на тип передачи и ее интенсивность. В этом контексте продолжающееся исследование происхождения SARS-CoV-2 направлено на выяснение того, где, как и почему возник данный вирус именно как пандемическое заболевание человека (Boni et al., 2020; Latinne et al., 2020). SARS-CoV-2 филогенетически группируется в обширной, но еще недостаточно изученной вселенной β-коронавирусов диких летучих мышей, обнаруженных у многих видов, населяющих большую часть земного шара (Anthony et al., 2017; Cui et al., 2019; Hu et al., 2017 ; Letko et al., 2020; Lu et al., 2020; Morens et al., 2020a; Zhang and Holmes, 2020; Zhou et al., 2020b). Открытие того, что его ближайшие вирусные «родственники» являются энзоотическими у подковоносых летучих мышей (Zhou et al., 2020a, 2020b), указывает на то, что SARS-CoV-2, вероятно, возник из еще не идентифицированного резервуара (летучих мышей) либо непосредственно, либо после заражения промежуточного хозяина, например, панголина (Boni et al., 2020; Letko et al., 2020; Li et al., 2020; Zhou et al., 2020a, 2020b). Как и в случае SARS-CoV 18 лет назад, конкретные детерминанты появления SARS-CoV-2 до сих пор остаются неясными. Прогресс в изучении огромного количества резервуаров коронавирусов летучих мышей был важнейшей задачей со времен эпидемии атипичной пневмонии 2002 года и остается таковой и сегодня. Еще предстоит провести целый ряд обсервационных, филогенетических и экспериментальных исследований. На 2020 год это стало одним из наиболее актуальных исследовательских приоритетов (Latinne et al., 2020). Одним из вопросов, который в ходе продолжающейся пандемии COVID-19 остался без ответа, связан с эволюционным потенциалом адаптированного к человеку SARS-CoV-2. Будет ли он, подобно IAV в последние столетия, эволюционировать, чтобы оставаться постоянным патогеном человека, и мутировать, чтобы избежать коллективного иммунитета, который он создает? И если он будет, то ослабнет ли со временем, как это могло произойти с четырьмя эндемичными типами коронавируса столетия назад? Или, с другой стороны, будет ли он наращивать патогенность, как вызывавший пандемии IAV H3N2 за последние 52 года? Поскольку у SARS-CoV-2 отсутствует сегментированный геном, мы избавлены от по крайней мере одной генетической ловушки (перегруппировки генов), лежащей в основе возникновения пандемии IAV; однако, как и в случае с IAV, можно ожидать, что SARS-CoV-2 будет мутировать и эволюционировать по мере распространения в человеческих популяциях и дополнительно развиваться путем генетической рекомбинации. Энзоотические данные подтверждают очень высокую степень рекомбинации генома SARS-подобных CoV в природе. Позволят ли такие возможности SARS-CoV-2 ускользнуть от популяционного иммунитета, вызванного перенесенной инфекцией или вакцинацией? Только время и ряд важных исследований позволят ответить на эти вопросы.
Уловки вируса для смены хозяина
Возможно, самая большая загадка возникающих инфекционных болезней заключается в том, как микроорганизмы, в том числе адаптированные к животным, покидают свой вид и принимаются заражать людей. Смена хозяина с животного на человека долгое время трактовалась как пересечение своего рода «островка пригодности», в границах которого вирус, адаптированный к передаче между представителями вида хозяина A, должен каким-то образом одновременно развивать способность продуктивно инфицировать и нового хозяина B (рис. 5) (Dolan et al., 2018; Geoghegan, Holmes, 2018; Kuiken et al., 2006; Parrish et al., 2008). В этой парадигме глубина «островка пригодности» отражает проблемы, связанные с барьером между разными хозяевами, которые необходимо преодолеть. Наше понимание механизмов вирусной эволюции и смены хозяина, тем не менее, является недостаточно полным, отчасти из-за неспособности согласовать экспериментальные данные об эволюции вируса внутри организма-хозяина и параметры окружающего мира, которые исследуют эволюцию вируса во время вспышек, включая возникновение новых инфекционных болезней (Geoghegan and Holmes, 2018). Среди многих осложняющих факторов быстрая передача новых вирусов от человека к человеку в больших популяциях людей часто приводит к возникновению сложного генетического разнообразия, затрудняя попытки связать вирусную изменчивость с вирусными фенотипическими изменениями. Ситуация особенно сложна для наиболее важной категории новых возбудителей, в том числе РНК-вирусов, к которым относятся SARS-CoV, SARS-CoV-2, MERS, вирус лихорадки Эбола и гриппа, а также денге, вирус Зика и другие арбовирусы. Эти вирусы развиваются и передаются как сложные квази-виды, которые содержат множество вирусных вариантов разной степени родства. Неясно, отражает ли (и в какой степени) передача / смена хозяина дарвиновскую теорию эволюции новых вариантов вируса, в отличие от эволюции, основанной на пригодности целых квази-видов (Geoghegan and Holmes, 2018).
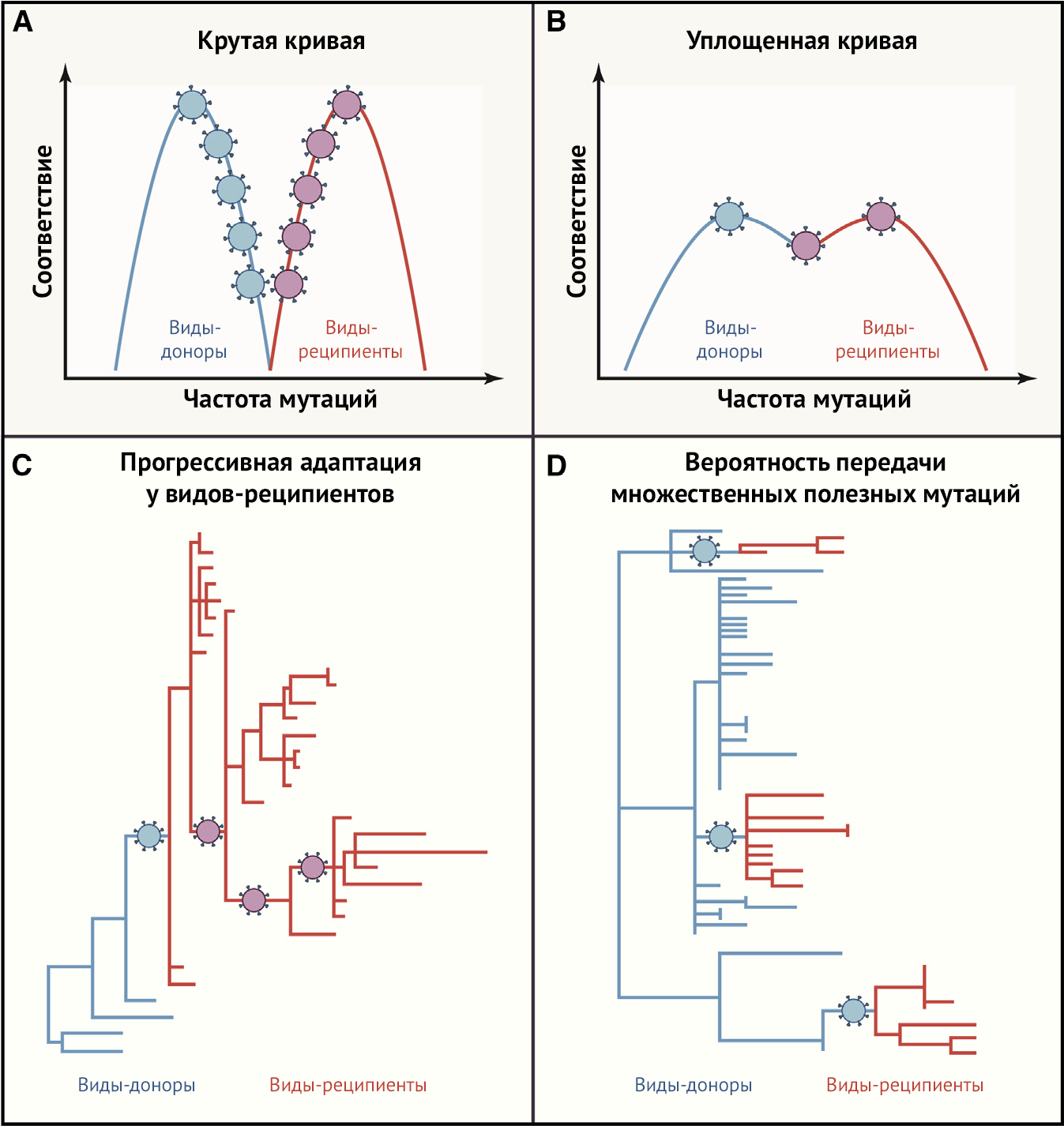
В последней концепции квази-виды вирусов развиваются вместе как разнообразный набор оптимально подходящих, менее оптимально подходящих и наименее оптимально подходящих вариантов, жертвуя идеальной приспособленностью организма-хозяина для адаптационной гибкости. Хотя долгое время считалось, что основными детерминантами смены хозяина являются эволюционная близость хозяев A и B и разнообразие передающих их квази-видов, недавние исследования показывают, что параметры патогена могут быть основной детерминантой смены хозяина (Anishchenko et al., 2006; Araujo et al., 2015). По сути, даже вирус, плохо приспособленный для потенциального хозяина, может адаптироваться к заражению этого самого хозяина, если у него будет достаточно шансов. Последствия серьезны: если переключение хозяина обусловлено возможностями, например, для SARS-CoV и CoV-2, тогда профилактика и контроль должны будут сосредоточиваться не только на самих инфекционных агентах, но и на поведении людей и животных, в том числе на покупках живых животных, приготовлении и потреблении мяса диких животных, сельском хозяйстве / животноводстве, ухудшении экологического состояния и других видах человеческого влияния на окружающую среду (Allen et al., 2017; Carroll et al., 2018). С другой стороны, инфекционные заболевания могут появляться у людей с большей частотой, чем предполагалось, однако исторически сложилось так, что они обычно не достигают достаточно устойчивой передачи, которая привела бы к их диагностике. Например, до признанного появления вируса Зика в энзоотических областях в течение десятилетий выявлялись низкие уровни распространенности серотипов среди людей, но без выявления вспышек заболеваний. До появления SARS-CoV-2 антитела к нему или к близкородственным сарбековирусам были обнаружены у людей, подвергшихся воздействию коронавирусов летучих мышей (Wang et al., 2018). MERS неоднократно переходил от верблюдов к людям, однако, несмотря на ограниченные цепочки последующего распространения от человека к человеку, это не привело к возникновению заболевания у людей. Вирус птичьего гриппа H5N1 инфицировал миллионы людей, тем не менее, только у небольшого процента случаев обнаруживается верифицированное заболевание (часто тяжелое или смертельное), а передача от человека к человеку регистрируется редко (Morens and Taubenberger, 2015). Эти и многие другие примеры позволяют предполагать, что появление заболеваний у людей может быть обычным явлением, однако устойчивая передача инфекции от человека к человеку была редким явлением в результате недостаточно изученных факторов.
Но, оглядываясь на недавнюю волну смертельных случаев, отмеченных выше, мы должны теперь задаться вопросом, не достигло ли человеческое поведение, нарушающее статус-кво человека и микроорганизмов, критической точки, которая подразумевает неизбежность возникновения болезней. Такие закономерности необходимо понимать лучше, если мы хотим контролировать возникновение инфекционных заболеваний (Dobson et al., 2020). Тщательное изучение неясных механизмов возникновения инфекционных заболеваний может позволить нам предвидеть риски возникновения посредством:
- наблюдения и характеристики таксономических групп потенциально пандемичных вирусов, включая вирусы, которые могут быть наиболее близкими к вирусам высокого риска, например, коронавирусы, генипавирусы, флавивирусы, аренавирусы и филовирусы;
- проведения интенсивных исследований предполагаемых категорий вирусов высокого риска для выявления у экспериментальных животных консервативных эпитопов с целью разработки вакцины и мишеней для противовирусной терапии;
- характеристика потенциальных механизмов передачи инфекции человеку в экспериментальных исследованиях на животных;
- разработки механизмов контроля в таких сферах, как животноводство, взаимодействие с дикими животными и борьба с грызунами, переносчиками и комарами/клещами;
- разработки программ охраны окружающей среды, землепользования, сохранения/контроля дикой природы;
- использования новых вирусологических, информационных и технологических подходов для понимания эволюции вирусов и даже прогнозирования потенциала их появления (Allen et al., 2017).
Есть множество примеров, когда возникновение тех или иных болезней отражает нашу растущую неспособность жить в гармонии с природой. Возникновение вируса нипах последовало за сельскохозяйственными выжиганиями лесов, что привело к перемещению инфицированных летучих мышей, в результате чего последние были вынуждены устраиваться на ночлег на деревьях, которые затеняли выращиваемых свиней, что привело к заражению свиней через помет летучих мышей; в результате возникли вспышки заболевания среди людей (в частности, свиноводов) (Morens et al., 2004). Производство рыбной муки рыбаками в водах по всему миру наносит ущерб экосистемам из-за чрезмерного вылова рыбы и лишает местных жителей источников пищи; это приводит к бедности и перемещению людей, что увеличивает вероятность возникновения болезней. В Азии рыбная мука используется для кормления сельскохозяйственных животных, что увеличивает вероятность зоонозных заболеваний. Желтая лихорадка, денге, чикунгунья и вирус Зика связаны с перенаселенностью городов, антисанитарией и скоплениями застойной воды. На протяжении многих веков урбанизация и скученность людей приводили к заражению переносимыми грызунами болезнями, такими как чума, мышиный тиф и лихорадка. Продолжающаяся пандемия COVID-19 напоминает нам, что перенаселенность городов и мест скопления людей (спортивные площадки, бары, рестораны, пляжи, аэропорты), а также географическое перемещение людей катализируют распространение инфекционных болезней. Жизнь в большей гармонии с природой потребует изменений в человеческом поведении, а также других радикальных трансформаций, на достижение которых могут потребоваться десятилетия: восстановление инфраструктуры от городов до домов и рабочих мест, систем водоснабжения и канализации, мест отдыха и собраний людей. В рамках такой трансформации нам необходимо будет уделить первоочередное внимание изменениям в поведении людей, которые повышают риск возникновения инфекционных заболеваний. Главные из них — сокращение скопления людей на работе и в общественных местах, а также минимизация нарушений окружающей среды, таких как вырубка лесов, урбанизация и интенсивное животноводство. Не менее важно искоренить глобальную бедность, улучшить санитарные условия и общую гигиену, а также снизить опасное воздействие на животных, чтобы люди и потенциальные патогены человека имели ограниченные возможности для контактов. Полезно отметить, что вплоть до последних десятилетий многие пандемические заболевания со смертельным исходом либо не существовали, либо не представляли серьезных проблем.
Например, холера не была известна на Западе до конца 1700-х годов и стала пандемией только из-за скопления людей и большого числа международных поездок, что открыло доступ бактериям в региональных азиатских экосистемах к антисанитарным водопроводным и канализационным системам, характерным для городов по всему миру. Осознание этого заставляет нас подозревать, что некоторые, а возможно, и очень многие из улучшений в жизни, достигнутых за последние столетия, дорого обходятся нам в контексте возникновения смертельных болезней. Поскольку мы не можем вернуться в древние времена, можем ли мы хотя бы извлечь урок из тех времен, чтобы повернуть современность и прогресс в более безопасном направлении? На эти вопросы должны ответить все сообщества и их лидеры, философы и мыслители, а также те, кто участвует в оценке экологических детерминант здоровья человека и влиянии на них.
Резюме и выводы
SARS-CoV-2 — смертельное дополнение к существующему списку микробных угроз человеческому виду. Это заставляет нас адаптироваться, реагировать и пересматривать характер наших взаимоотношений с миром природы. Возникающие и повторяющиеся инфекционные заболевания — это эпифеномены человеческого существования и нашего взаимодействия друг с другом и с природой. По мере того, как человеческие сообщества становятся больше и сложнее, мы создаем бесконечное множество возможностей для появления генетически нестабильных возбудителей инфекционных заболеваний в незаполненных экологических нишах, которые мы продолжаем создавать. В этой ситуации нет ничего нового, за исключением того, что сейчас мы живем в мире, где доминируют люди, в котором наши все более радикальные изменения окружающей среды вызывают все более серьезную негативную реакцию со стороны природы. Наука обязательно принесет нам множество жизненно важных лекарств, вакцин и средств диагностики, однако нет оснований полагать, что только они могут устранить угрозу все более частых и смертельных случаев инфекционных заболеваний. Факты свидетельствуют о том, что SARS, MERS и COVID-19 являются лишь последними примерами смертельного коронавируса и других чрезвычайных ситуаций. Пандемия COVID-19 — это еще одно событие, добавленное в быстро растущий архив исторических напоминаний о том, что в мире, где доминируют люди, в котором наша человеческая деятельность представляет собой агрессивное, разрушительное и несбалансированное взаимодействие с природой, мы все чаще будем провоцировать возникновение новых болезней и чрезвычайные ситуации. В обозримом будущем мы по-прежнему рискуем. COVID-19 — один из самых ярких тревожных сигналов за более чем сто лет. Он должен заставить нас серьезно и коллективно задуматься о том, чтобы жить более осознанно, даже если мы готовы к неизбежным и всегда неожиданным природным сюрпризам.
