Будущее бронходилатации: поиск новых классов бронходилаторов
Введение
Несмотря на то что за последние годы был достигнут значительный прогресс в лечении заболеваний дыхательных путей, лечение бронходилататорами, которое остается ключевым элементом в терапии данных расстройств, остается на этапе использования β2-адренорецепторных агонистов, антагонистов мускариновых ацетилхолиновых рецепторов (аМАХР) и ксантинов.
Конечно, имеющиеся бронходилататоры удовлетворяют многие потребности пациентов, страдающих заболеваниями дыхательных путей, но часто они не снимают симптомы, а их длительное применение вызывает опасения по поводу безопасности. Поэтому имеется потребность в разработке новых классов препаратов.
Селективные ингибиторы фосфодиэстеразы
Селективные ингибиторы фосфодиэстеразы не являются чем-то новым. Фактически, рофлумиласт, который является ингибитором фосфодиэстеразы-4 , уже давно присутствует на рынке и применяется для лечения ХОБЛ. Тем не менее мы понимаем, что новое поколение препаратов избирательно влияет на уровень цАМФ или цГМФ в различных субклеточных микродоменах, и отдельные ФДЭ, вероятно, имеют определенные точки приложения в определенное время (рис. 1). Кроме того, вместо того чтобы вовлекать одну ФДЭ, мы должны рассмотреть вопрос об использовании нескольких их вариантов с применением центральных регуляторных механизмов. Вероятно, что соединения, ингибирующие ферменты ФДЭ-4, вместе со вторым семейством ФДЭ могут обеспечить терапевтический эффект при концентрации, не вызывающей тошноты.
Эти предположения привели к изучению семейства ФДЭ как важной мишени в лечении заболеваний дыхательных путей, а также к исследованию лекарств, недооцененных в прошлом, таких как ФДЭ-8 и ФДЭ-9. Эти препараты потенциально способны не только подавлять ФДЭ, но и одновременно взаимодействовать с различными ФДЭ. Также они, по-видимому, регулируют релаксацию гладких мышц трахеи крупного рогатого скота.
Двойные ингибиторы ФДЭ-3/ФДЭ-4
Открытие, что ФДЭ-4 является основным изоферментом в большинстве воспалительных клеток, имеющих важное значение в патогенезе астмы и ХОБЛ, а также открытие, что ФДЭ-3 является ключевым изоферментом в процессе реализации механизма релаксации гладкой мускулатуры воздухоносных путей (вызванной стимуляцией β2-адренорецептора), привело к разработке препаратов, способных ингибировать как ФДЭ-3, так и ФДЭ-4 с целью получения бронхолитического и противовоспалительного действия одновременно. Несколько соединений, избирательно ингибирующих ФДЭ-3 и ФДЭ-4, таких как зардаверин, бензафтрин, толафтрин и пумафтрин, были протестированы на добровольцах. Ни один из препаратов не нашел дальнейшего применения из-за недостаточной эффективности или неуверенности в его безопасности. Энсифентрин (RPL554) является единственным двойным ингибитором ФДЭ-3/ФДЭ-4, находящимся на стадии клинической разработки с целью лечения ХОБЛ, астмы и, вероятно, муковисцидоза. Однако было отмечено, что его сродство к ФДЭ-3 в 3440 раз выше, чем к ФДЭ-4 (половина максимальной ингибирующей концентрации [IC50] для ФДЭ-3 0,43 нм а для ФДЭ-4 — 1479 нм), что позволяет предположить, что он действует преимущественно как ингибитор ФДЭ-3, а следовательно, как бронхолитический препарат. Следует отметить, что существуют свидетельства, полученные на доклиническом и клиническом этапах, о синергетическом взаимодействии между энзифентрином и β2-адрецепторными агонистами или антагонистами мускариновых ацетилхолиновых рецепторов, что позволяет предположить, что он (энзифентрин) может быть использован в качестве стимулирующего агента. В любом случае, хотя есть опасения, что блокировка ФДЭ-3 может вызвать неблагоприятные последствия (особенно в сердечно-сосудистой системе, потому что этот фермент также важен в регулировании функций гладкой мускулатуры сосудов и сердечной мышцы), энзифентрин является безопасным и хорошо переносимым препаратом.
Двойные ингибиторы ФДЭ-4/ФДЭ-7
ФДЭ-4 и ФДЭ-7 экспрессируются в иммунных клетках и контролируют внутриклеточный уровень цАМФ. Одновременное ингибирование ФДЭ-4 и ФДЭ-7 потенцирует эффекты, наблюдаемые при простом ингибировании ФДЭ-4 или ФДЭ-7, а также подавляет гиперреактивность дыхательных путей. Тем не менее более высокая противовоспалительная активность двойных ингибиторов ФДЭ-4/ФДЭ-7 по сравнению с одним только ФДЭ-4-ингибитором не была убедительно продемонстрирована. Также было показано, что ингибирование ФДЭ-7 не способно влиять на провоспалительные клетки как таковые, но может увеличивать ингибирующий эффект других препаратов, повышающих уровень цАМФ. Было исследовано несколько ингибиторов ФДЭ-4/ФДЭ-7 (например, YM-393059, T-2585, ASB16165 и BC54). Доказано, что YM-393059, ингибирующий ФДЭ-4 и ФДЭ-7 со значениями IC50 630 нм и 14 нм, проявлял некоторую активность в доклинических симуляциях воспаления , а Т-2585, ингибирующий ФДЭ-4 и ФДЭ-7 со значениями IC50 0,013 нм и 1,7 нм, блокировал пролиферацию Т-клеток и выделение из них цитокинов, тогда как высокоселективный ингибитор ФДЭ-4 — пикламиласт — не оказывал эффекта. ASB16165, ингибирующий ФДЭ-4 и ФДЭ-7A при значениях IC50 2,1 нм и 15 нм, блокировал пролиферацию CD3/CD28-стимулированных Т-клеток и высвобождение цитокинов. BC54 индуцировал более выраженное противовоспалительное действие, повышая секрецию фактора некроза опухоли-α макрофагами и интерлейкина-2 (IL-2) Т-лимфоцитами, по сравнению с ролипрамом (в качестве монотерапии или в комбинации с BRL50481). Комбинированное ингибирование экспрессии ФДЭ-4B, ФДЭ-4D и ФДЭ-7A дало гораздо больший противовоспалительный эффект, чем монотерапия рофлумиластом при воспалении легких, обусловленном курением, которое индуцировалось in vivo на мышах.
В связи с этими открытиями все еще существует интерес к поиску новых эффективных ингибиторов ФДЭ-4/ФДЭ-7, главным образом в качестве противовоспалительных средств, хотя ингибирование ФДЭ-4 может влиять на тонус гладкой мускулатуры дыхательных путей. Было разработано и синтезировано несколько соединений, например, бутанегидразиды — класс производных пурина-2,6-диона, а также серия новых амидных производных 1,3-диметил-2,6-диоксопурин-7-алкиларбоновых кислот, которые ингибируют активность ФДЭ-4B/ФДЭ-7A, а также блокируют канал TRPA1 (транзиентный рецепторный потенциал, анкирин 1).
Двойные ФДЭ-4/ФДЭ-5 ингибиторы
Двойные ингибиторы ФДЭ-4/ФДЭ-5 могут действовать на нескольких уровнях при заболеваниях дыхательных путей, снижая легочную гипертензию, а также уменьшая воспаление легких и, вероятно, улучшая функцию легких. Существуют доклинические доказательства того, что сочетание селективных ингибиторов ФДЭ-5 (тадалафил) и ФДЭ-4 (рофлумиласт) могут снижать гиперреактивность дыхательных путей и выработку маркеров воспаления (по крайней мере в испытаниях с эозинофильным воспалением, вызванным овальбумином) за счет увеличения внутриклеточных уровней цАМФ и цГМФ посредством ингибирования ФДЭ-4 и ФДЭ-5.
LASSBio596, разработанный как гибрид талидомида и сульфаниламида, оказывал противовоспалительный эффект в испытаниях на мышах с вызванным липополисахаридом Escherichia coli острым повреждением легких, уменьшая воспаление, а также вызывая увеличение емкости легких и ремоделирование стенок воздушных путей, тем самым улучшая функцию легких в у животных с эластаза-индуцированной эмфиземой. Тем не менее он не не нашел клинического применения, вероятно, потому, что LASSBio-596 оказывает негативное влияние на функцию сердца.
Недавно на крысах с монокроталин-индуцированной легочной гипертензией был протестирован двухмолекулярный ингибитор ФДЭ-4/ФДЭ-5, который ингибирует ФДЭ-4B, ФДЭ-4D и ФДЭ-5A со значениями IC50 6,7×10-10 М, <1×10-8 М и 6,6×10-10 М соответственно. Препарат снижал экспрессию профибротических генов, индуцированную трансформацией фактора роста β, и замедлял гипертрофию правого желудочка.
Тем не менее было высказано предположение, что разработка двойных ингибиторов ФДЭ-4/ФДЭ-5 не будет проводиться, поскольку селективные ингибиторы ФДЭ-5 не только оказываются неэффективными, но и, по-видимому, приводят к ухудшению газообмена.
.
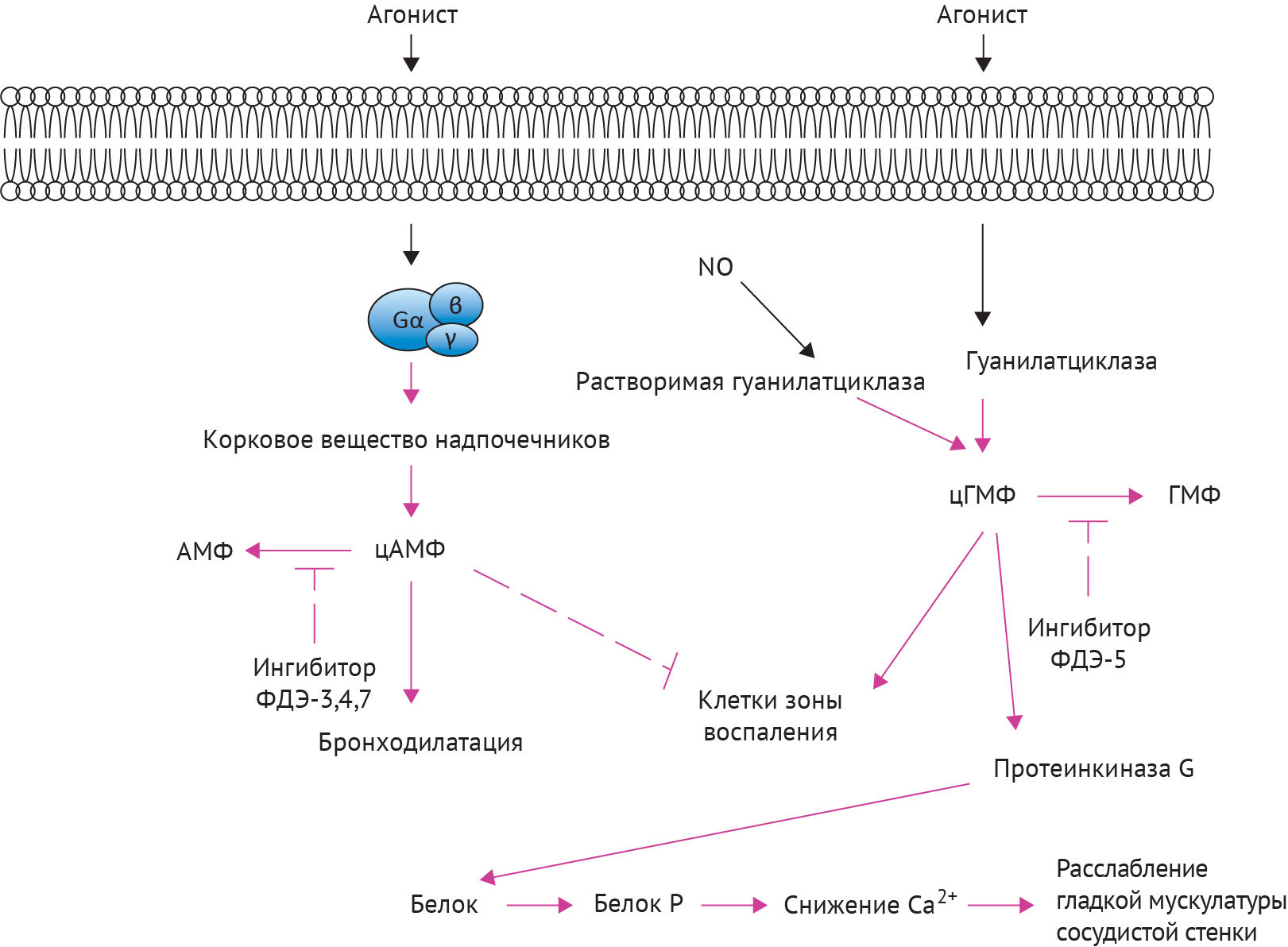
Рисунок 1 | Потенциальные точки приложения ингибиторов фосфодиэстеразы (ФДЭ) и активаторов растворимой гуанилатциклазы в гладкомышечных и воспалительных клетках дыхательных путей. Аденилатциклаза; цАМФ; предшественник гранулоцитов и макрофагов; (циклический) монофосфат гуанозина; гуанилатциклаза; окись азота, протеинкиназа G.
