Железодефицит у беременных

Железодефицитная анемия — одно из тех редких осложнений беременности, которое можно легко предотвратить на этапе планирования. Даже здоровые беременные подвержены риску развития анемии в связи с физиологической гемодилюцией и расходованием запасов железа для роста плода и материнского эритропоэза [1]. Учитывая тот факт, что развивающийся плод очень требователен к концентрации кислорода и железа в поступающей к нему крови, плацента способна увеличивать количество рецепторов к железу и хранить его в резидентных ретикулоэндотелиальных клетках [1,3]. Следует различать дефицит железа и железодефицитную анемию (ЖДА). Распределение железа в организме идет преимущественно в пользу гемового железа, следовательно, развитие анемии на фоне железодефицита — это сигнал о выраженном недостатке микроэлемента в депо [3]. В связи с этим выделяют три стадии дефицита: предлатентный — снижение резервного железа без уменьшения расходования его на эритропоэз, латентный — истощение депо и дефицит транспортного железа, без признаков анемии и манифестный или ЖДА [8].
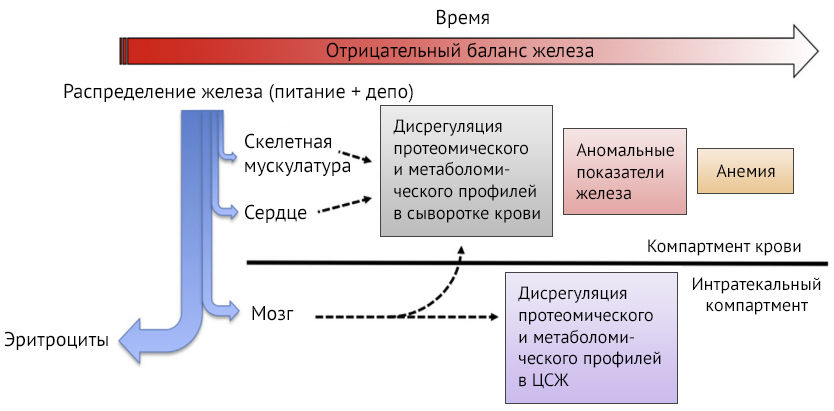
Рисунок 1 | Изменения в организме на различных стадиях железодефицита. Синей стрелкой указано распределение поступающего в организм железа — в первую очередь на эритропоэз, затем на синтез миоглобина и ферментные системы. Красной стрелкой указано прогрессирование дефицита с течением времени [3].
Потребность в железе на разных сроках беременности варьирует. В первом триместре суточная потребность снижается по сравнению с небеременным состоянием преимущественно за счет отсутствия менструальной кровопотери, а также за счет снижения эритропоэза. Во втором триместре объем циркулирующей крови увеличивается на 45 %, объем плазмы — на 50 %, а масса эритроцитов — на 35 %, следовательно, потребность в железе растет. В третьем триместре максимально возрастает потребность плода в железе, а кровопотеря в процессе родов уносит с собой около 150 мг железа [4].
Таблица 1 | Среднее увеличение потребности в железе в период беременности и в послеродовом периоде для женщин с массой тела до беременности от 55 до 60 кг [4,9]

Факторы риска развития железодефицита и железодефицитной анемии у женщин детородного возраста [4,8]:
- нарушения диеты (вегетарианство или веганство, недостаточное употребление красного мяса, анорексия, булимия, чрезмерное употребление кальция, чая, кофе);
- нарушения всасывания питательных веществ (болезнь Крона, целиакия);
- паразитозы (анкилостомоз, лямблиоз, цестодоз, шистосомоз);
- хронические заболевания (малярия, ВИЧ, гемоглобинопатии, аутоиммунные заболевания, ЗНО);
- осложнения беременности (рвота беременных, преэклампсия, холестатический гепатоз);
- короткие интервалы между беременностями (менее года);
- меноррагия;
- донорство крови.
Проявления дефицита крайне неспецифичны и могут списываться женщиной на саму беременность: быстрая утомляемость, слабость, раздражительность, нарушение концентрации внимания, бледность кожи и слизистых, головная боль, головокружение, тахикардия, одышка, усталость в ногах. Некоторые женщины отмечают пристрастие к специфическим продуктам: сырому мясу, сырым крупам, мелу, почве [1,8,10].
Существуют определенные опасности, связанные с дефицитом железа: повышение риска послеродовой депрессии, послеродового кровотечения (предположительно из-за снижения сократительной способности матки в условиях дефицита кислорода в тканях), некоторые исследования также говорят о риске развития послеродового сепсиса [1,10]. Женщин с анемией чаще подвергают гемотрансфузиям и родоразрешают путем кесарева сечения [2]. Преимущественно в странах с низким уровнем доходов показатели гемоглобина < 70 г/л связаны с двукратным увеличением материнской смертности [1,10]. В послеродовом периоде анемия связана с повышенной утомляемостью, депрессивными расстройствами, снижением познавательных способностей, нарушением лактации и ранним прекращением грудного вскармливания [10].
Железодефицит у плода и новорожденного
Железо в организме плода делится на гемовое железо, негемовое железо и депо, находящееся преимущественно в печени. В эритроцитах содержится 55 мг/кг железа в виде гемоглобина, нормальная концентрация которого у доношенных детей составляет 133–184 г/л. В депо хранится около 12 мг/кг железа в виде ферритина, нормальная концентрация которого в пуповинной крови доношенного ребенка составляет 170 мг/л. Наименьшее количество железа (около 8 мг/кг) участвует в метаболических процессах и переносе кислорода в мышцах. Дефицит негемового железа трудно отследить из-за отсутствия специфических биомаркеров, лабораторно он обнаруживается только в совокупности с дефицитом железа в депо и, как следствие, сниженным ферритином. Концентрация ферритина < 76 мг/л связана с нарушением неврологических функций новорожденного [3]. В случае легкой и умеренной степени дефицита у матери, компенсаторные механизмы поддерживают адекватное поступление железа плоду, но тяжелый дефицит, приводящий к развитию ЖДА у матери, приводит к развитию железодефицита у ребенка [5].
Регуляция биодоступности железа во время беременности, частично зависит от концентрации гепсидина у матери. Гепсидин - гормон-регулятор, вырабатывающийся в печени и регулирующий концентрацию железа в плазме и распределение его в тканях. Гепсидин действует путем ингибирования поступления железа в кровь, влияя на абсорбцию в кишечнике, высвобождение железа из макрофагов и мобилизацию его из депо. Гормон действует через рецептор ферропортин (Fpn), экспрессирующийся во всех тканях экспортирующих железо в плазму. Связывание гепсидина и ферропортина запускает секвестрацию железа в клетках-мишенях и снижение его поступления в плазму, следовательно, существует обратная зависимость между концентрацией гепсидина и достаточным потреблением железа тканями, в том числе костным мозгом и плацентой [9].
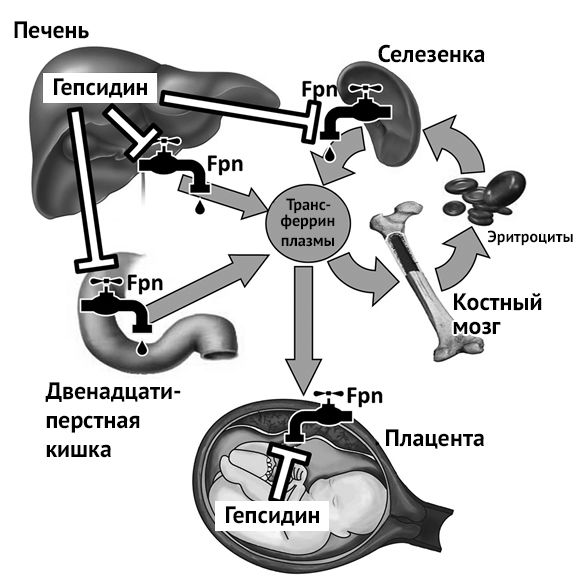
Рисунок 2 | Регуляция гомеостаза железа в организме беременной женщины. Fpn — ферропортин, Fe-Tf — трансферрин
В отношении влияния на развитие плода и исходы для новорожденного все не так однозначно: считается, что анемия матери связана с более высоким риском перинатальной и неонатальной смертности, низкой массой тела при рождении, преждевременными родами, однако метаанализ рандомизированных клинических исследований по влиянию добавок железа на перинатальные исходы показал лишь умеренное влияние на массу тела при рождении и неопределенное влияние на частоту преждевременных родов [1,2]. В то же время, некоторые исследования сообщают о 30% увеличении риска развития задержки роста плода на каждые 10 г/л сниженного гемоглобина до 20 недель беременности, а снижение гемоглобина <100 г/л значительно увеличивало риск мертворождения и перинатальной смерти. [10]. Постнатальный дефицит железа течение первых девяти месяцев в значительной степени обусловлен уровнем железа при рождении, следовательно, существует прямая зависимость между железодефицитом матери и плода. Самые распространенные факторы развития анемии у плода: острое материнское или плацентарное кровотечение и тяжелый дефицит железа у плода (менее 90 г/л). К другим факторам, приводящим к железодефициту плода, относятся артериальная гипертензия у матери, курение, нарушенная толерантность к глюкозе / сахарный диабет при нормальных показателях гемоглобина и ферритина, а также многоплодная беременность [3].
Наибольший интерес представляет влияние дефицита железа на нейрокогнитивные функции ребенка. Недостаток железа у матери в третьем триместре приводит к структурным изменениям головного мозга новорожденного, включая изменения в сером веществе: нейроны имеют более простую структуру, нарушается функционирование митохондрий. Железосодержащие ферменты играют важную роль в синтезе жирных кислот, являющихся неотъемлемой частью миелина, в связи с чем, дефицит железа в раннем возрасте изменяет жировой состав миелина и приводит к гипо- и дисмиелинизации нервной системы. Железодефицит изменяет экспрессию генов, критических для развития и функционирования гиппокампа, а также изменяет концентрацию нейротрансмиттеров, зависящих от железосодержащих гидроксилаз – тирозингидроксилазы и триптофангидроксилазы (дофамин, серотонин, норэпинефрин), нарушает работу их рецепторов и механизмов обратного захвата, что неминуемо приводит к ряду психоневрологических расстройств. [3,10].
У новорожденных с неанемическим дефицитом железа и концентрацией ферритина пуповинной сыворотки < 40 мг/л отмечаются нарушения памяти распознавания (способности узнавать ранее встречающихся людей, события, объекты), как и у двухмесячных младенцев с концентрацией ферритина пуповинной сыворотки < 76 мг/л. Нарушения памяти распознавания отмечались также в возрасте до 3,5–4 лет у детей с низким неонатальным уровнем железа, даже если в постнатальном периоде дефицита не было. Учитывая тот факт, что железодефицитная анемия у матери является предрасполагающим фактором для развития железодефицита у младенцев, создаются предпосылки для нарушения психомоторного развития ребенка. Дефицит железа в младенчестве и детстве связан с более низкой скоростью обработки информации, нарушением неврологических рефлексов, ухудшением двигательной функции, трудностями с социализацией, что в свою очередь создает предпосылки для развития тревожных и депрессивных расстройств в будущем. У детей в возрасте 5–6 лет отмечаются трудности с обучением, планированием и концентрацией внимания [3,10].
Существуют определенные риски, связанные с развитием психических расстройств у детей, рожденных от матерей с железодефицитной анемией. Низкий уровень железа в преконцепционном периоде связывают с высоким риском развития аутизма, во втором триместре — с повышением риска развития шизофрении на 30 % [3].
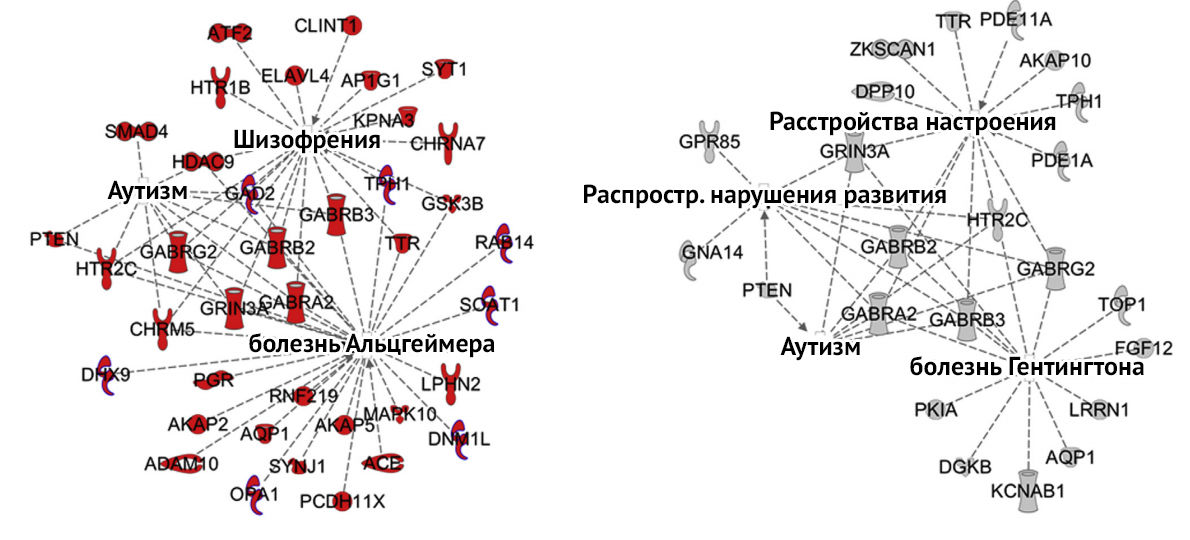
Рисунок 3 | Изменения экспрессии генов при железодефиците. Слева – непосредственное влияние дефицита на экспрессию, справа – эпигенетические нарушения. [3]
Диагностика дефицита железа
Как правило, железодефицит наряду с другими анемиями диагностируется во время рутинного исследования уровня гемоглобина в рамках общего анализа крови. Диагностика анемии у беременных имеет некоторые особенности в связи с вариабельностью показателей гемоглобина в зависимости от триместра. Для первого триместра пороговым значением является Hb < 110 г/л, для второго – < 105 г/л, в послеродовом периоде – < 100 г/л. В развернутом анализе крови рассчитываются эритроцитарные индексы: МНС (среднее количество гемоглобина в эритроците), MCV (средний объем эритроцита), МСНС (средняя концентрация гемоглобина в эритроците). Для дефицита характерно снижение показателей, однако, следует помнить о физиологическом увеличении MCV в время беременности [1,6].
Для железа существуют специфические маркеры: ферритин, различные методы оценки насыщения трансферрина: трансферрин, уровень растворимых рецепторов трансферрина (sTSAT), %TSAT (коэффициент насыщения трансферрина) и гепсидин – пептидный гормон, реагирующий на избыток железа. Концентрация гемоглобина в ретикулоцитах также определяет преанемию, дефицит железа и, следовательно, может служить ранним биомаркером дефицита железа [3,5]. Сывороточное железо и общая железосвязывающая способность сыворотки в настоящее время считаются ненадежными маркерами в связи с влиянием употребления железа и суточными колебаниями значений [6].
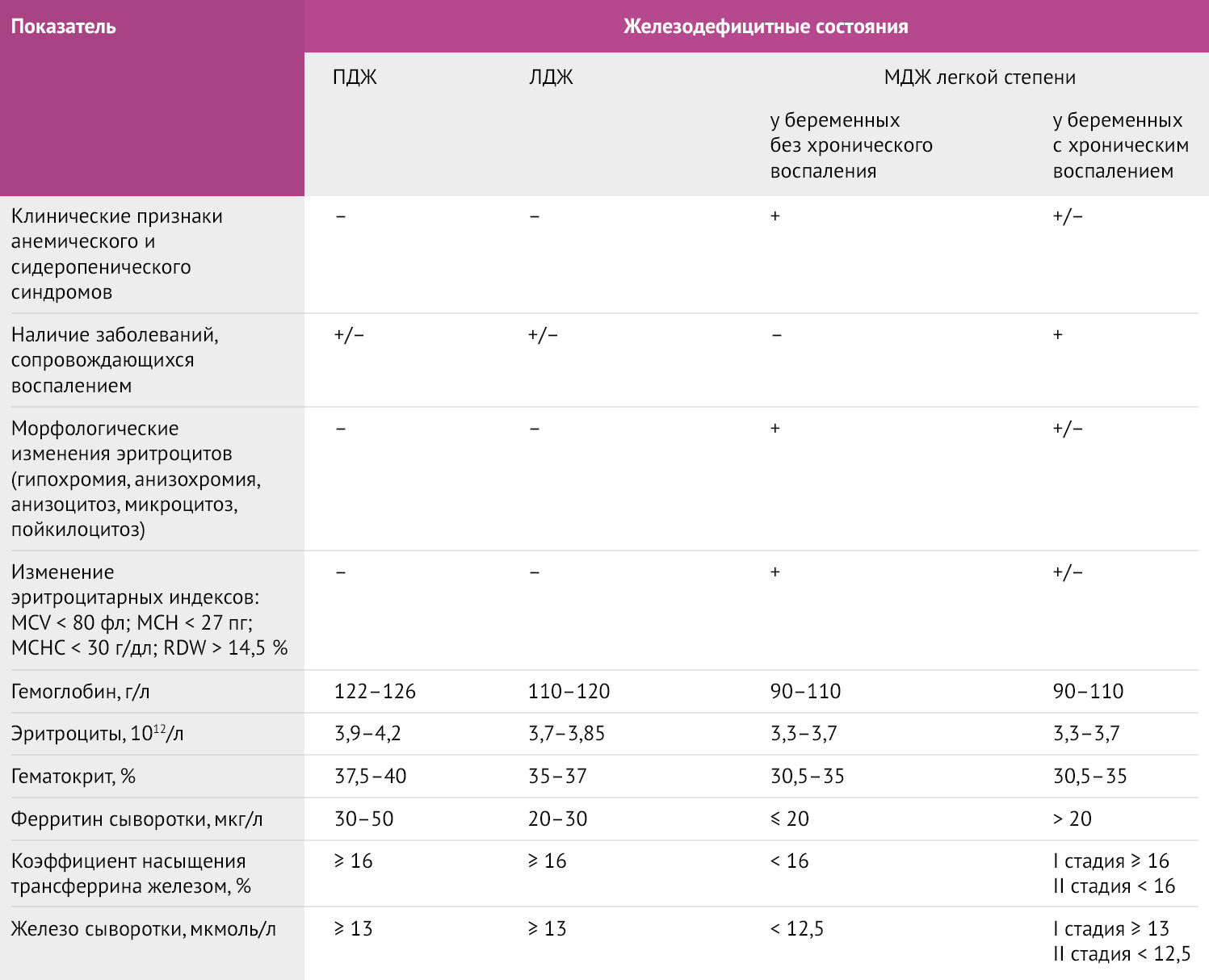
Таблица 2 | Диагностические критерии железодефицитной анемии у беременных. ПДЖ – предлатентный дефицит железа, ЛДЖ – латентный дефицит железа, МДЖ – манифестный дефицит железа. [7,8]
Наиболее широко у беременных используется ферритин – маркер депонирования железа в печени матери и плаценте. Именно ферритин поддерживает стабильный уровень железа, выводя из депо необходимое для синтеза гема количество. Диагностически значимым является снижение уровня сывороточного ферритина <30 мкг/л. Но в случае с сопутствующим системным воспалением ферритин может сыграть злую диагностическую шутку: уровень маркера растет, маскируя железодефицит, в связи с чем рекомендуется параллельное исследование С-реактивного белка для проведения дифференциальной диагностики [1,3,6].
Трансферрин — белок, отвечающий за транспорт железа в плазме крови, реагирующий на его дефицит увеличением концентрации. Показатель sTfR пропорционален количеству трансферрина. При снижении концентрации сывороточного железа концентрация sTfR возрастает одновременно с трансферрином. %TSAT рассчитывается путем деления уровня сывороточного железа на общую железосвязывающую способность сыворотки и умножения на 100. Он отражает процент участков связывания железа на трансферрине, которые заняты молекулами железа. Концентрация железа в сыворотке снижается на ранних этапах дефицита, тем самым снижая %TSAT. По мере усугубления дефицита концентрация трансферрина увеличивается, чтобы оптимизировать способность связывать железо для транспорта, что еще больше снижает %TSAT. Все эти изменения происходят до микроцитоза или анемии [3].
Самый интересный из предлагаемых маркеров — гепсидин, измерение концентраций которого в сыворотке может дать наибольшее количество информации о том, кто должен получать добавки железа, а кому они не показаны. Гепсидин — это главный регулятор всасывания железа в кишечнике и распределения железа из ретикулоэндотелиальных клеток, он синтезируется печенью в ответ на уровень железа и наличие воспаления. Гепсидин является негативным регулятором: это означает, что высокие его концентрации снижают всасывание железа в кишечнике и способствуют секвестрации железа, тогда как низкие уровни увеличивают абсорбцию железа в кишечнике и высвобождение железа ретикулоэндотелиальными клетками. Пациентки с низким уровнем гепсидина, вероятно, будут нуждаться в добавках железа и ответят на терапию, тогда как пациентки с высоким уровнем гепсидина из-за недостаточности железа или перегрузки им не нуждаются в дополнительном железе и не будут столь активно усваивать железо из пищи. Начало беременности характеризуется очень низкими концентрациями гепсидина, что указывает на состояние отрицательного баланса железа и дает веские доказательства того, что потребности в железе во время беременности высоки. Таким образом, женщины, уровень железа которых до беременности нормален или находится на границе нормы, склонны к развитию дефицита железа во время беременности [3].
Источники:
- Pavord S. et al. UK guidelines on the management of iron deficiency in pregnancy //Br J Haematol. – 2019.
- Stanley L Schrier, Michael Auerbach. Treatment of iron deficiency anemia in adults//UpToDate, Feb. – 2018.
- Georgieff M. K. Iron deficiency in pregnancy //American journal of obstetrics and gynecology. – 2020.
- McMahon L. P. Iron deficiency in pregnancy //Obstetric Medicine. – 2010.
- McCann S., Perapoch Amadó M., Moore S. E. The Role of Iron in Brain Development: A Systematic Review //Nutrients. – 2020.
- Клинические рекомендации “Кровесберегающие технологии в акушерской практике” 2014.
- Федеральные клинические рекомендации “Диагностика, профилактика и лечение железодефицитных состояний у беременных и родильниц” 2013.
- Доброхотова Ю. Э., Бахарева И. В. Железодефицитная анемия беременных: профилактика и лечение //РМЖ. – 2018.
- Fisher A. L., Nemeth E. Iron homeostasis during pregnancy //The American journal of clinical nutrition. – 2017.
- Benson C. S. et al. Iron deficiency anaemia in pregnancy: A contemporary review //Obstetric Medicine. – 2020.
