Аллергические реакции, равившиеся после введения первой дозы вакцины Pfizer-BioNTech

11 декабря 2020 года Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) выдало разрешение на экстренное использование (EUA, Emergency Use Authorization) вакцины фирмы Pfizer-BioNTech от коронавирусной инфекции COVID-19; режим введения включает две дозы с интервалом в 21 день. Консультативный комитет по практике иммунизации (ACIP, Advisory Committee on Immunization Practices) выпустил временные рекомендации по ее использованию. После проведения вакцинации появились сообщения о случаях анафилаксии после первой дозы вакцины от COVID-19 производства фирмы Pfizer-BioNTech.
Анафилаксия — это опасная для жизни аллергическая реакция, которая иногда возникает сразу после вакцинации, обычно в течение нескольких минут или часов.
Уведомления и отчеты о подозреваемых тяжелых аллергических реакциях и анафилаксии после вакцинации фиксировались в Системе сообщений о побочных эффектах вакцин (VAERS, Vaccine Adverse Event Reporting System), национальной системе пассивного наблюдения (путем спонтанных сообщений) о побочных эффектах после иммунизации. Врачами Центров США по контролю за заболеваниями и профилактике (CDC, Centers for Disease Control and Prevention) была произведена оценка этих сообщений; были применены критерии Брайтонской коллаборации (с помощью них проводится оценка этиологии случая как анафилактической или не анафилактической). Из анализа были исключены неаллергические побочные явления, в основном вазовагальные или связанные с тревогой. Также исключались случаи анафилаксии и не-анафилаксии с аллергическими реакциями с проявлением симптомов позднее, чем на следующий день после вакцинации из-за сложности однозначного определения после вакцинации аллергических реакций с отсроченным началом. Поскольку вакцина от COVID-19 фирмы Moderna вышла на рынок только 21 декабря 2020 года, эта статья посвящена вакцине Pfizer-BioNTech.
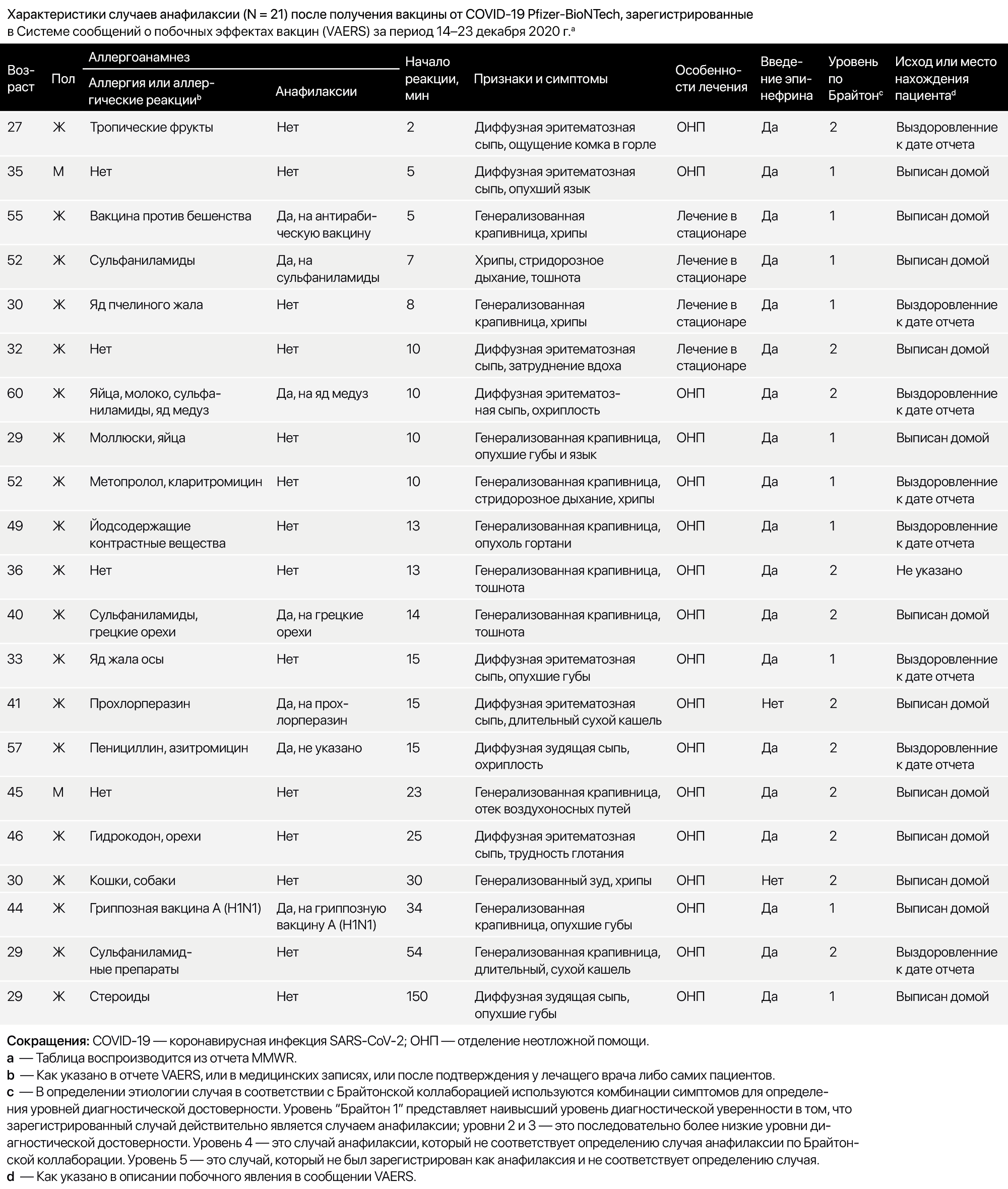
В период с 14 по 23 декабря 2020 г. после введения 1 893 360 первых доз вакцины от COVID-19 Pfizer-BioNTech (1 177 527 случаев введения вакцины среди женщин, 648 327 — среди мужчин; в 67 506 случаях реципиент пол не указывал), врачами CDC было выявлено 21 сообщение о случаях, представленных VAERS, которые соответствовали критериям определения случаев анафилаксии Brighton Collaboration (см. таблицу), что соответствует расчетной частоте 11,1 случая на миллион введенных доз. Четыре пациента (19 %) были госпитализированы (в том числе трое — в отделения интенсивной терапии), а 17 (81 %) находились на лечении в отделении неотложной помощи; известно, что 20 человек (95 %) были выписаны домой или выздоровели на момент сообщения в VAERS. О случаях смерти от анафилаксии не сообщалось.
В среднем время от момента введения вакцины до развития симптомов составляло 13 минут (диапазон 2–150 минут); у 15 пациентов (71 %) симптомы развивались в течение 15 минут; у 18 (86 %) симптомы появились в течение 30 минут. Наиболее частыми симптомами были крапивница, ангионевротический отек, сыпь и ощущение комка в горле. У 17 (81 %) из 21 пациента с анафилаксией был документально подтвержденный аллергический анамнез или аллергические реакции в течение жизни, в том числе на лекарства или медицинские продукты, продукты питания и укусы насекомых; у семи человек (33 %) был зафиксирован эпизод анафилаксии в прошлом, в том числе один — после введения вакцины против бешенства и другой — после вакцинации против гриппа A (H1N1) (см. таблицу). За тот же период VAERS было выявлено 83 случая не связанных с анафилаксией аллергических реакций после вакцинации препаратом фирмы Pfizer-BioNTech. Обычно симптомы не связанной с анафилаксией аллергической реакции включали кожный зуд, сыпь, ощущение першения и царапания в горле, а также легкие респираторные симптомы.
Смертность от COVID-19 среди групп высокого риска высока, а варианты лечения ограничены. Широко распространенная вакцинация против COVID-19 высокоэффективными препаратами представляет собой важный инструмент в усилиях по борьбе с пандемией. Рекомендации CDC по использованию вакцин от COVID-19 на основе мРНК и ведению случаев анафилаксии доступны.
- Места проведения вакцинации должны быть обеспечены необходимыми средствами для лечения анафилаксии; особенно растворами адреналина в предварительно заполненных шприцах или автоматических инъекторах.
- Должен проводиться скрининг среди потенциальных реципиентов вакцины для выявления лиц с наличием противопоказаний и необходимыми мерами предосторожности.
- Необходимо также ввести рекомендуемые периоды наблюдения после вакцинации: 15 или 30 минут в зависимости от предшествующего аллергоанамнеза каждого пациента.
- Необходимо, чтобы врачи и другие медицинские работники умели распознавать симптомы анафилаксии на ранней стадии.
- Необходимо немедленно лечить подозрение на анафилаксию с помощью внутримышечного введения адреналина (вследствие того, что анафилаксия представляет собой острое, опасное для жизни состояние, противопоказаний к введению адреналина нет).
Пациенты, страдающие анафилаксией, должны быть доставлены в учреждения для получения соответствующей медицинской помощи. Все пациенты должны быть проинструктированы насчет обращения за немедленной медицинской помощью в случае возникновения у них симптомов аллергической реакции после окончания периода наблюдения и после того, как они покинули место вакцинации. Клиницисты играют важную роль в мониторинге безопасности вакцин, они должны быть бдительными при выявлении побочных эффектов и своевременно сообщать о них в VAERS.
