Метаболизм азотистых оснований

Статья будет посвящена базовому, но крайне интересному разделу биохимии — метаболизму азотистых оснований. Сегодня мы рассмотрим то, как из аминокислот и глюкозы получается материал, кодирующий нашу биологическую сущность, — нуклеиновые кислоты (ДНК и РНК). Это понадобится нам для понимания очень важных вещей. Например, как одна мутация в метаболизме нуклеотидов способна подарить ребенку тяжелейший иммунодефицит или сделать из него глубокого инвалида. Почему не живут долго и счастливо многие из тех, кто злоупотребляет вином, красным мясом, шоколадом и прочими радостями. Почему иногда умирают (во всяком случае, часто умирали раньше) при проведении противоопухолевой химиотерапии. В статье, посвященной нарушению метаболизма азотистых оснований, ты узнаешь и о редких заболеваниях, о которых забывают 90 % врачей, принимая их за другие, более известные и очевидные. Но для начала надо постичь базу, ведь без понимания метаболизма азотистых оснований перечисленные мною факты и заболевания будет крайне сложно понять. Приступим.
▶ Еще по теме: Цикл трикарбоновых кислот
Немного терминологии
Нуклеотидом мы будем называть соединение, представляющее собой совокупность трех частей [3]:
- азотистое основание (аденин, гуанин, цитозин, урацил, тимин);
- пятиуглеродный сахар рибоза (дезоксирибоза);
- остатки фосфорной кислоты (от одного до трех).
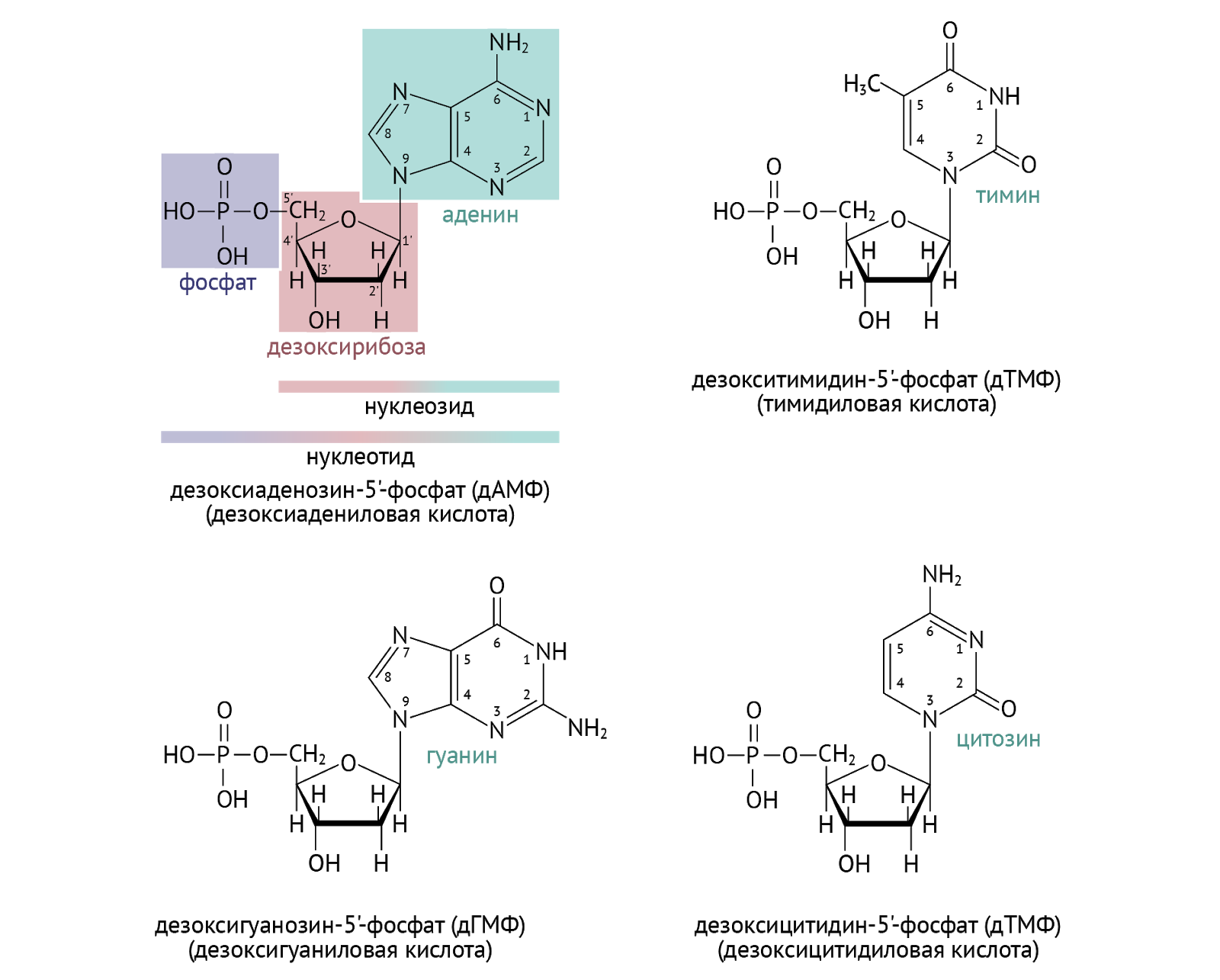
Уберем фосфат — получим нуклеозид. Уберем еще и рибозу и получим азотистое основание — пуриновое или пиримидиновое «кольцо». Эта терминология необходима для понимания названий целого ряда ферментов, которыми сегодня мы будем развлекать наш мозг.
Как я уже намекнул, азотистых оснований много во вкусной, но не всегда здоровой пище: бекон, красное мясо, ветчина, фасоль, спаржа, сыр, яйца, пиво, грибы и так далее. Бьюсь об заклад, что-то в твоем рационе из этого хоть иногда, да присутствует (если ты на стипендии. Если нет – работай над этим).
Попадая в твой ЖКТ, в 12-перстную кишку, нуклеиновые кислоты, содержащиеся в пище, расщепляются рибонуклеазами, нуклеотидазами и прочими ферментами поджелудочной железы. Продукты расщепления в виде нуклеотидов и нуклеозидов (иногда и вовсе азотистых оснований) попадают в энтероциты (клетки слизистой оболочки тонкой кишки).
В энтероцитах есть ксантиноксидаза, которая переводит пурины (аденин, гуанин) в мочевую кислоту. Мочевая кислота, как правило, стремится всосаться в кровь и выйти с мочой через почки. Может также пропустить себя в просвет кишки и выйти с калом (кстати, это бывает и весьма ощутимо, если имеется декомпенсированная патология почек).
Пиримидины утилизируются своим путем [1, 3], о котором мы поговорим позже. Но главное, что ты должен понять: экзогенных источников нуклеотидов для организма нет. Нуклеотиды, попадающие с пищей, не усваиваются, а лишь дают некоторое количество уратов — солей мочевой кислоты. Не перевелись еще люди, которые ведут активную пропаганду «Нет ГМО» и осуществляют на этом нехилую спекуляцию при продаже пищевых продуктов. Пусть в пище будет хоть трижды перекрещенная и модифицированная ДНК, твоя кишка все равно превратит все в кусок химуса и уратов, и ты даже не поймешь, что съел шедевр генной инженерии…
Образование пуринов. «Откуда же тогда взять мономеры для нуклеиновых кислот? Как и откуда берутся нуклеотиды? Как они используются дальше?» — и еще тысяча вопросов, которые добровольно не пришли бы в твою голову, если бы не предстоящий зачет по биохимии. Именно на них мы будем искать ответ.
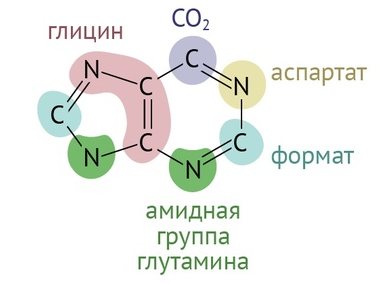
Пурины — гуанин и аденин — формируются буквально из ничего. Все, что нам нужно для создания пуринового кольца — глюкоза (поступающая в пентозо-фосфатный цикл), глицин, две молекулы глутамина, одна молекула аспартата, пара молекул активной метилированной формы фолиевой кислоты + немного терпения и приправы в виде пяти молекул АТФ [1].
Я не хочу грузить тебя серией реакций синтеза пуринов, ее на экзамене полностью никто не спросит, и, скорее всего, для принятия решений в своей работе она тебе тоже не нужна. Но кое-что ты знать должен.
Синтез пуринов проходит два основных этапа: формирование инозинмонофосфата (ИМФ) и получение из ИМФ таких нуклеотидов, как ГМФ и АМФ.
Необходимо знать ключевые моменты этого синтеза.
Первый из них — лимитирующая реакция синтеза пуринов — формирование фосфорибозилпирофосфата (ФРПФ).
(Для тех, кто не понял: лимитирующая реакция — это та реакция, скорость которой определяет скорость всего процесса, а также та, что подвергается наиболее жесткой и сложной регуляции).
Далее следует еще порядка девяти реакций, которые из 5-фосфорибозил-1-амина сделают инозинмонофосфат (ИМФ). На этом закончится первый этап синтеза. Для экзамена и последующей работы тебе нужно знать, какие молекулы участвуют в формировании пуринового кольца, и эти две реакции. Для жизни — и того меньше.
2 этап. Чрезвычайно важен и интересен. Два брата, два параллельно идущих, как ты со своим другом, ̶п̶о̶ ̶н̶а̶к̶л̶о̶н̶н̶о̶й̶ к синтезу АМФ и ГМФ.
Что интересно: конечные продукты этого чрезвычайно интересного (никому) синтеза — ГТФ и АТФ — помогают дружественному параллельному циклу, даруя энергию для синтеза нуклеотида. Несколько ниже приведена иллюстрация вышеописанных биохимических событий.
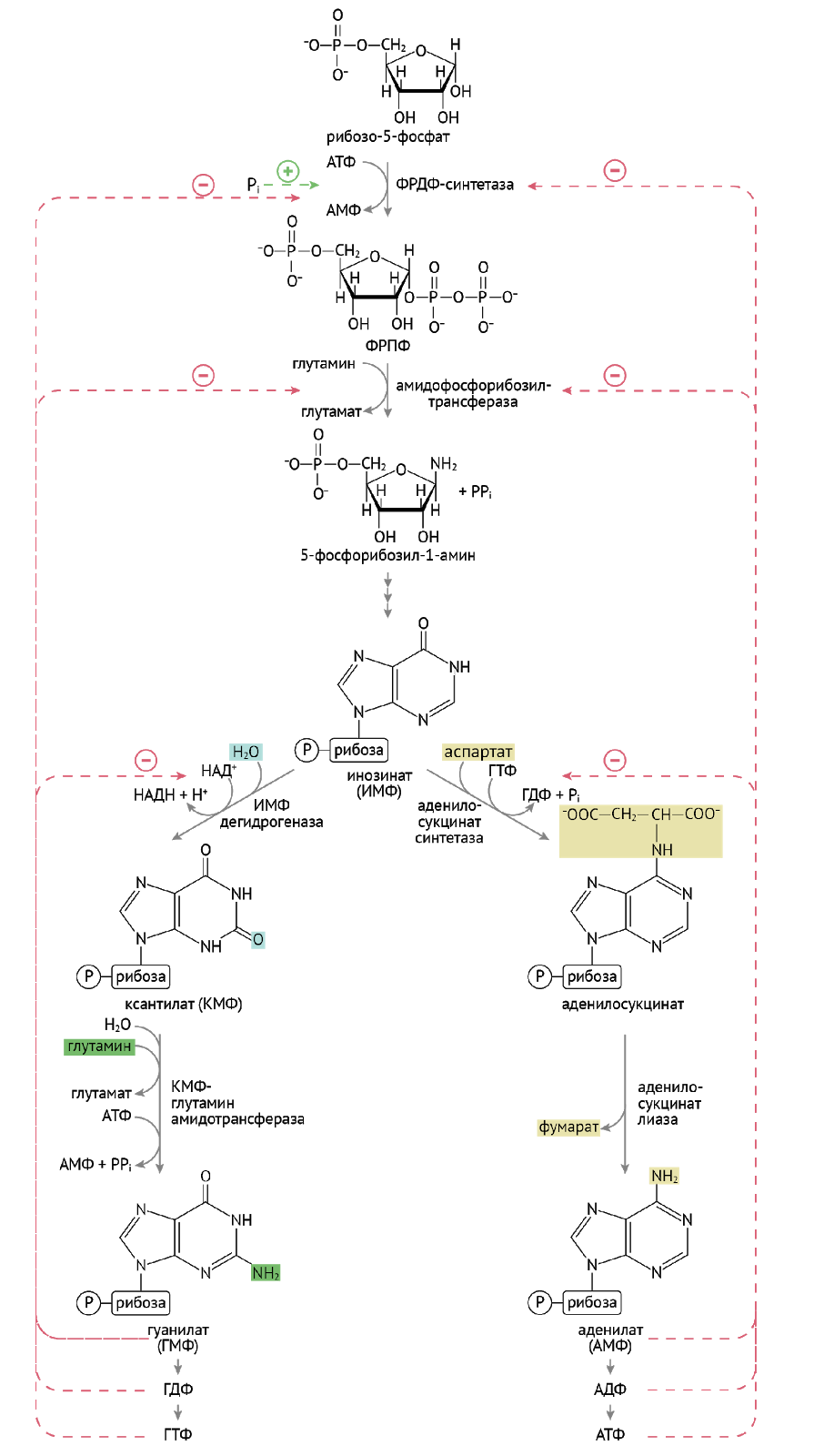
Распад пуринов и дальнейшая судьба одиноких азотистых оснований
Катаболизм пуринов не менее важная и интересная серия процессов, потому что так же, как и синтез пуринов, их катаболизм является ключевым моментом для понимания патогенеза ряда заболеваний. Большинство нуклеотидов подвергаются повторному использованию (отдать некому, выкинуть жалко), заново включаясь в синтез нуклеотидов. Проследим путь их катаболизма.
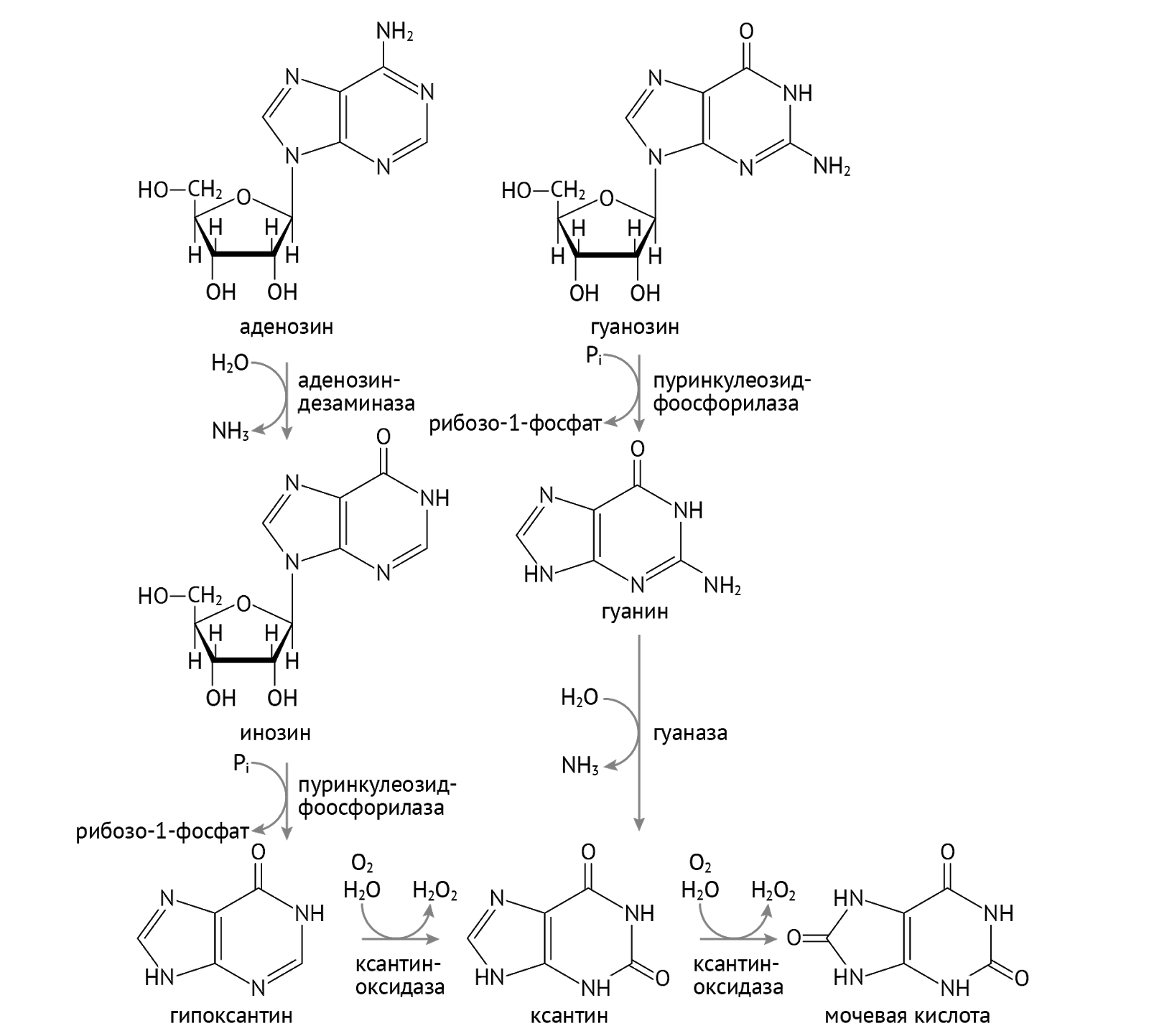
Как мы видим, аденозин (аденин + рибоза) стремится стать гипоксантином. Но на пути к этому ему нужно перевоплотиться назад в инозинмонофосфат. В этом ему поможет аденозиндезаминаза. Хорошо запомни этот фермент, мы к нему не раз еще вернемся. Гипоксантин, кстати, может стать просто ксантином, чем обязан ксантиноксидазе.
Гуанозин считает стадию гипоксантина для себя недостойным (не может смириться с тем, что именно АТФ, а не ГТФ, является основным источником энергии в клетке, старые обиды несчастной молекулы). В силу этого ГТФ не церемонится и становится ксантином, минуя стадию образования гипоксантина. И здесь перед ним встает выбор из двух путей. Путь 1: гипоксантин и ксантин станут мочевой кислотой и оставят после себя лишь воспоминания, удалившись в мочу (или в суставы и почечные канальцы в виде уратов). Путь 2: камбэкнуться в ИМФ (а затем в АМФ) и ГМФ. В этом им поможет братан, которого во дворе прозвали гипоксантингуанинфосфорибозил-трансферазой (ГГФРТ).
Получившиеся вновь ГМФ и ИМФ (🡪 АМФ) превращаются в ГТФ и АТФ путем присоединения фосфорных остатков. Здесь все просто.
Резюме: для нас клиническое значение будут иметь нижеперечисленные ферменты:
- Дезаминаза (аденозиндезаминаза)
- Ксантиноксидаза
- Гипоксантингуанинфосфорибозил-трансфераза
- Фосфорибозилпирофосфат-трансфераза (она же фосфорибозилдифосфат-трансфераза)
Их значение для реализации той или иной патологии будет обсуждаться в соответствующей статье.
Синтез пиримидинов
Здесь все проще и сложнее одновременно. Реакций здесь меньше, они понятнее, а значит, тебя могут спросить их на экзамене. Не пугайся, а просто смотри и запоминай.
С карбомоилфосфатом мы еще встретимся. Забегая далеко вперед (дальше, чем твое отчисление) сообщу тебе, что это соединение – исходный продукт для синтеза мочевины в печени. Той самой мочевины, в которую превращается весь «вредный» азот в организме. Советую отнестись внимательнее к следующим ферментам: оротатфосфорибозил-трасфераза и оротатмонофосфат (ОМФ)-декарбоксилаза. Нарушение их функции — ключевой момент в реализации такого патологического состояния, как оротовая ацидурия.
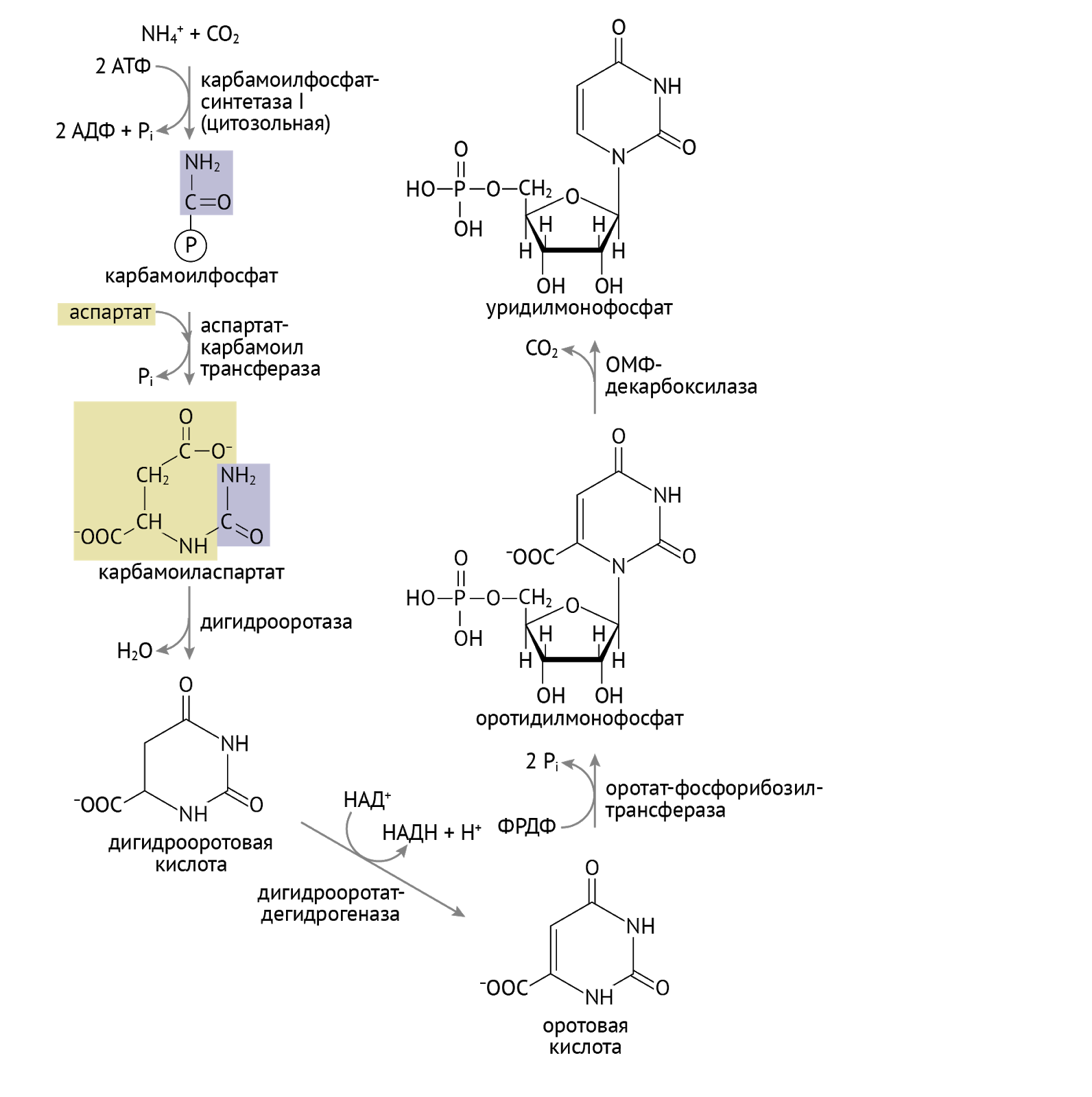
Взглянув на схему, мы видим, что конечным продуктом этого этапа является уридинмонофосфат (УМФ). С обостренным чувством собственной важности УМФ дает начало:
- уридинтрифосфату (УТФ) — путем реакции присоединения двух фосфорных остатков;
- цитидинтрифосфату (ЦТФ) — через образование УТФ и путем изнасилования ЦТФ-синтетазой.
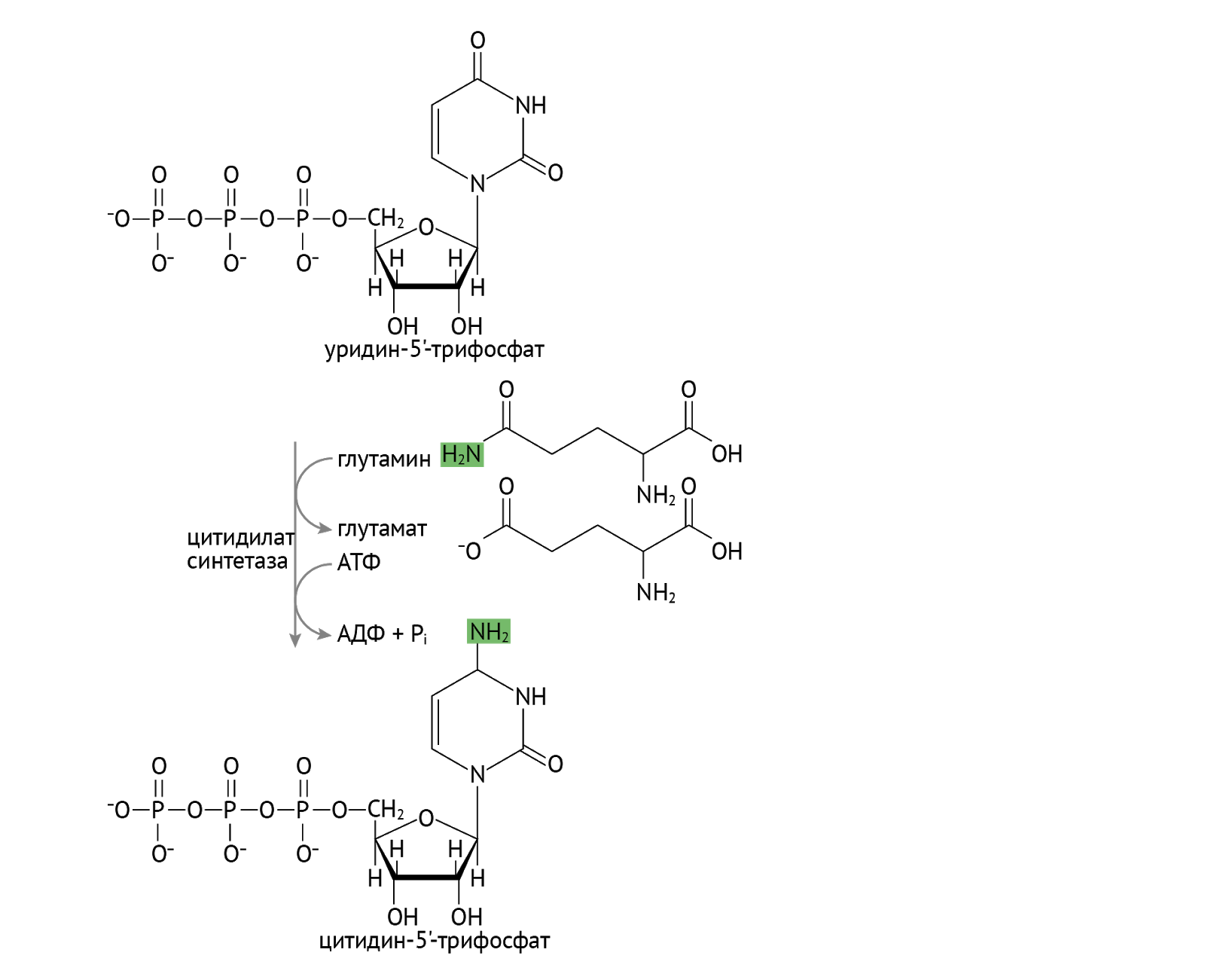
Все образованные соединения — АТФ, ГТФ, ЦТФ, УТФ — используются для синтеза рибонуклеиновых кислот, функцию которых ты должен был помнить не давеча как с третьего класса средней школы. Они имеют важное значение в матричных биосинтезах: в транскрипции ДНК, синтезе белка.
Но у нас есть еще и ДНК. Та штука, которая определяет твой фенотип и все, что из него вытекает. ДНК-полимераза установила фейс-контроль для синтеза ДНК. Он заключается в том, что все субстраты должны быть дезоксирибонуклеотидом [1, 3].
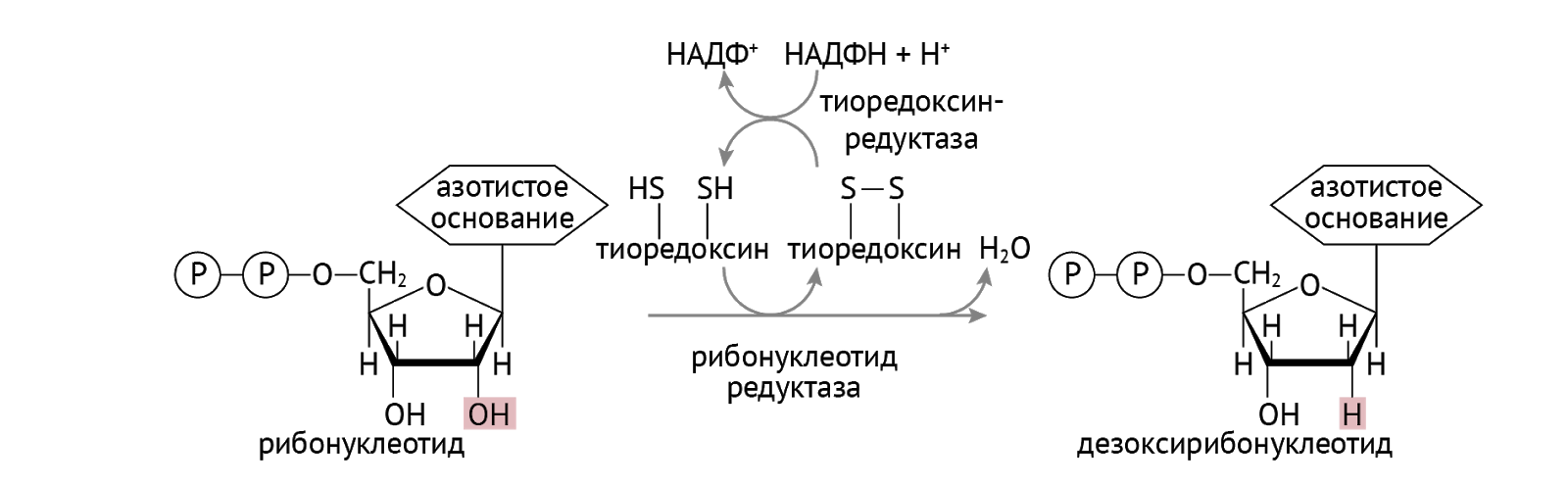
Есть исключение из правил. Это касается УТФ. Чтобы попасть в ДНК, ему нужно притвориться не просто дезоксирибонуклеотидом. Ему нужно притвориться ТТФ (тимидинтрифосфат). Что он и делает:
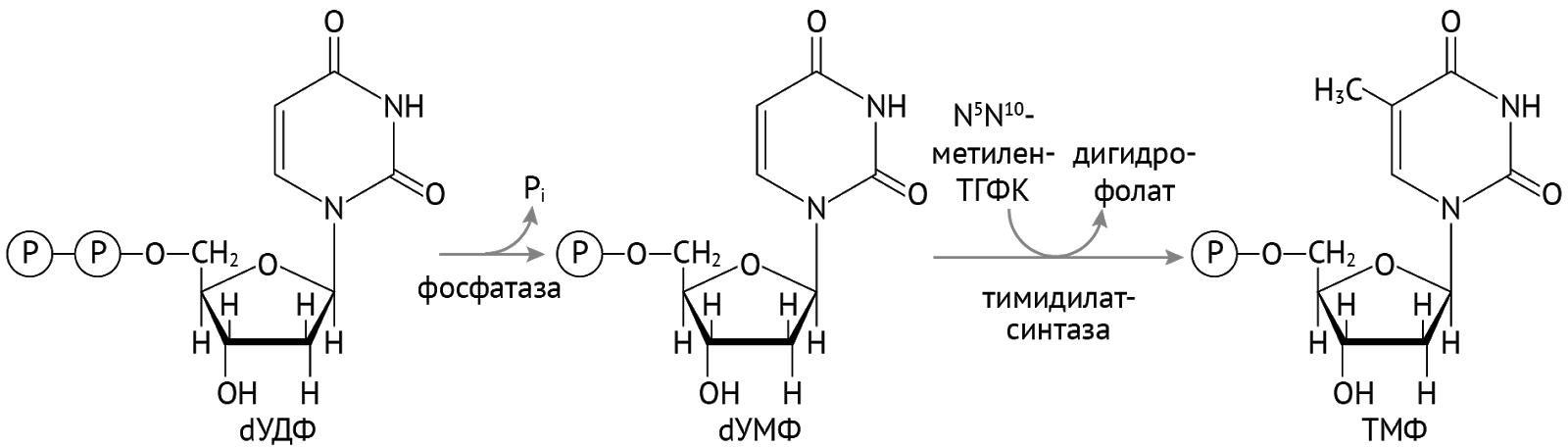
Далее остается присоединить остатки фосфорной кислоты и получить тимидинтрифосфат [1].
Важно отметить, что тимидилатсинтаза и реакция образования ТМФ являются чрезвычайно важными в отношении синтеза ДНК. Также здесь можно заметить, что необходимым кофактором является тетрагидрофолиевая кислота.
Именно данная реакция является мишенью метотрексата — цитостатического противоопухолевого препарата, являющегося антиметаболитом — структурным аналогом фолиевой кислоты, который проявляет к тимидилатсинтазе недвусмысленное сродство. Связываясь с ней, метотрексат останавливает реакцию образования ТМФ, тем самым обрывая синтез ДНК в самом зародыше — на этапе образования ее структурных компонентов. Метотрексат нашел применения в онкологии (преимущественно при гемобластозах) и в ревматологии (ревматоидный артрит [5]).
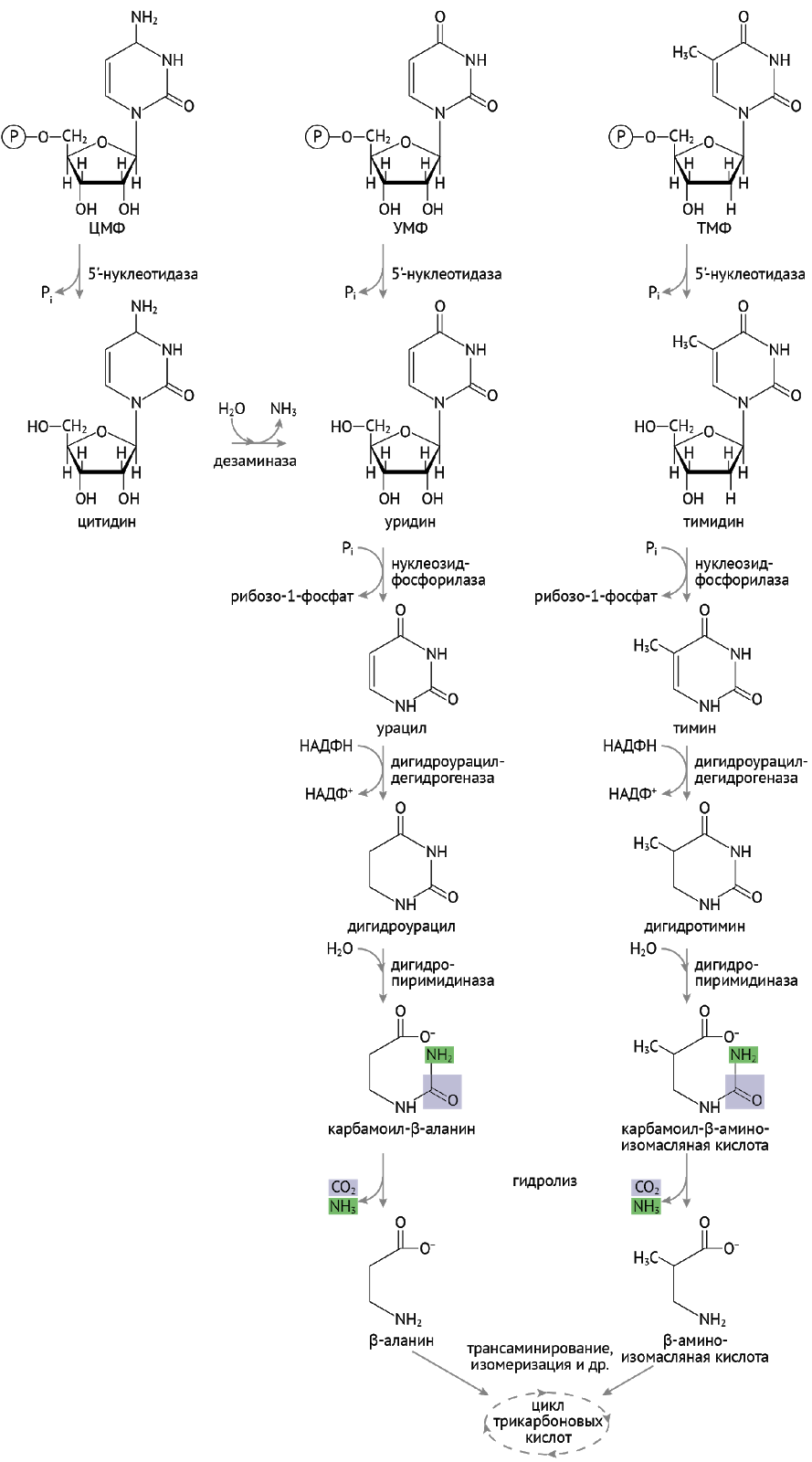
Распад пиримидинов
В нашей жизни ничего не вечно. Пиримидины тоже гибнут, но распадаясь, оставляют после себя ряд предшественников, которые участвуют в метаболизме, но уже другими путями.
Комментируя сложную схему распада пиримидинов, я акцентирую внимание на двух важных вещах:
- пиримидины, в отличие от пуринов, не подвергаются реутилизации;
- продукты их распада — аланин и бутират — в серии превращений становятся пировиноградной кислотой и оксалоацетатом. Их дальнейшая судьба связана с участием в цикле трикарбоновых кислот и процессе получения энергии [3].
Биологическое значение нуклеотидов в клетках. Функции, выходящие за рамки синтеза нуклеиновых кислот
Обсудив с тобой предметы сложной и высокой материи, мы переходим к самому интересному и «вкусному» (только не блевани) разделу настоящей статьи.
Нуклеотиды являются кирпичами для нуклеиновых кислот, что важно для реализации генетической информации и превращения ее в реальный фенотип со своими уникальными морфологическими особенностями. Этот процесс заслуживает отдельной лекции (спойлер — она следующая).
Но этим не исчерпывается значение нуклеотидов.
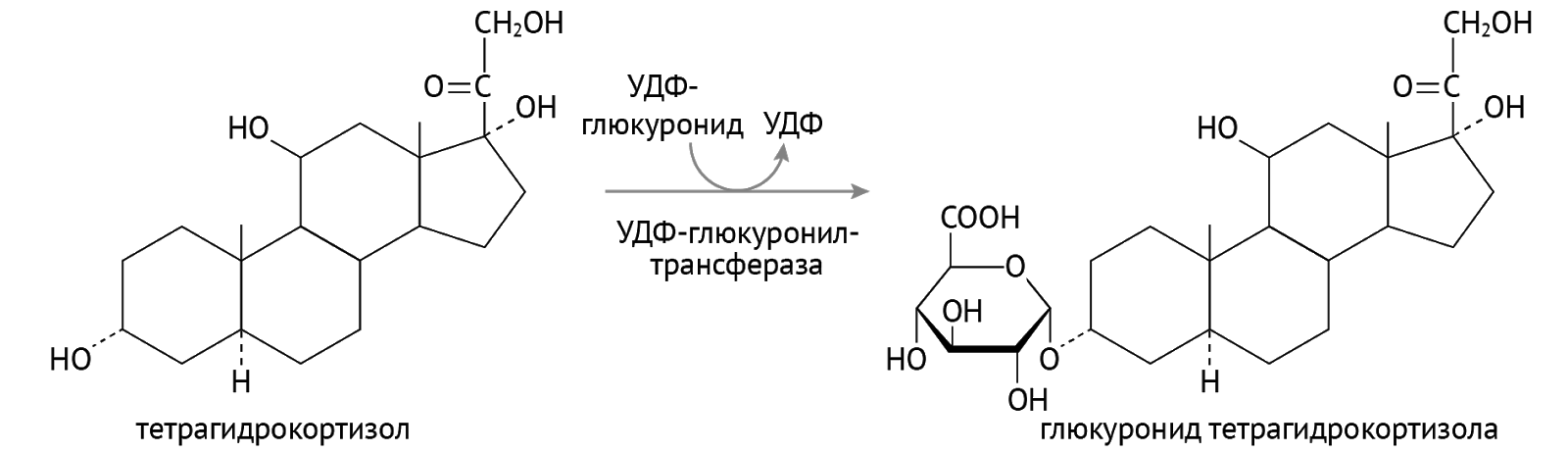
Детоксикация. Кое-кто из них используется в организме для детоксикации ксенобиотиков — лекарств, токсинов и иных химикатов, поступающих в организм, а также для детоксикации липофильных (т. е. растворимых в липидах и нерастворимых в воде) соединений: гормонов, билирубина. Суть детоксикации (обезвреживания) — перевести плохо растворимое в воде вещество в хорошо растворимое, что необходимо для последующего выведения через почки с мочой из организма. Достигается это присоединением полярной химической группы к исходному хулигану. Сначала формируется гидроксильная группа (если таковой нет, это этап образования более полярных соединений). А затем наступает этап конъюгации… Посмотрим, как это выходит на примере тетрагидрокортизола (рис. 11) [2].
А вот схема для менее дотошных, чем автор данной лекции.
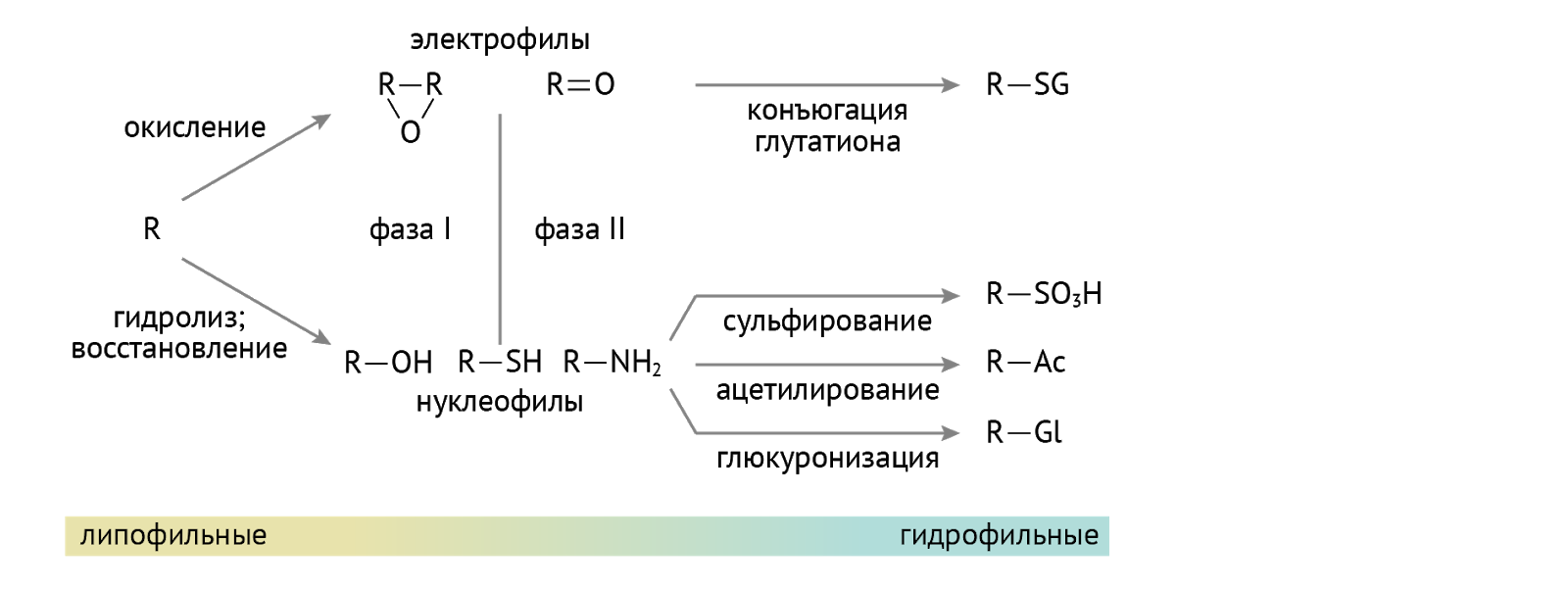
Никто: «Ух ты, классно и понятно».
Твой экзаменатор: «А откуда ты возьмешь такую форму нуклеотида, которая будет способна конъюгировать с ксенобиотиками?».
Ты:
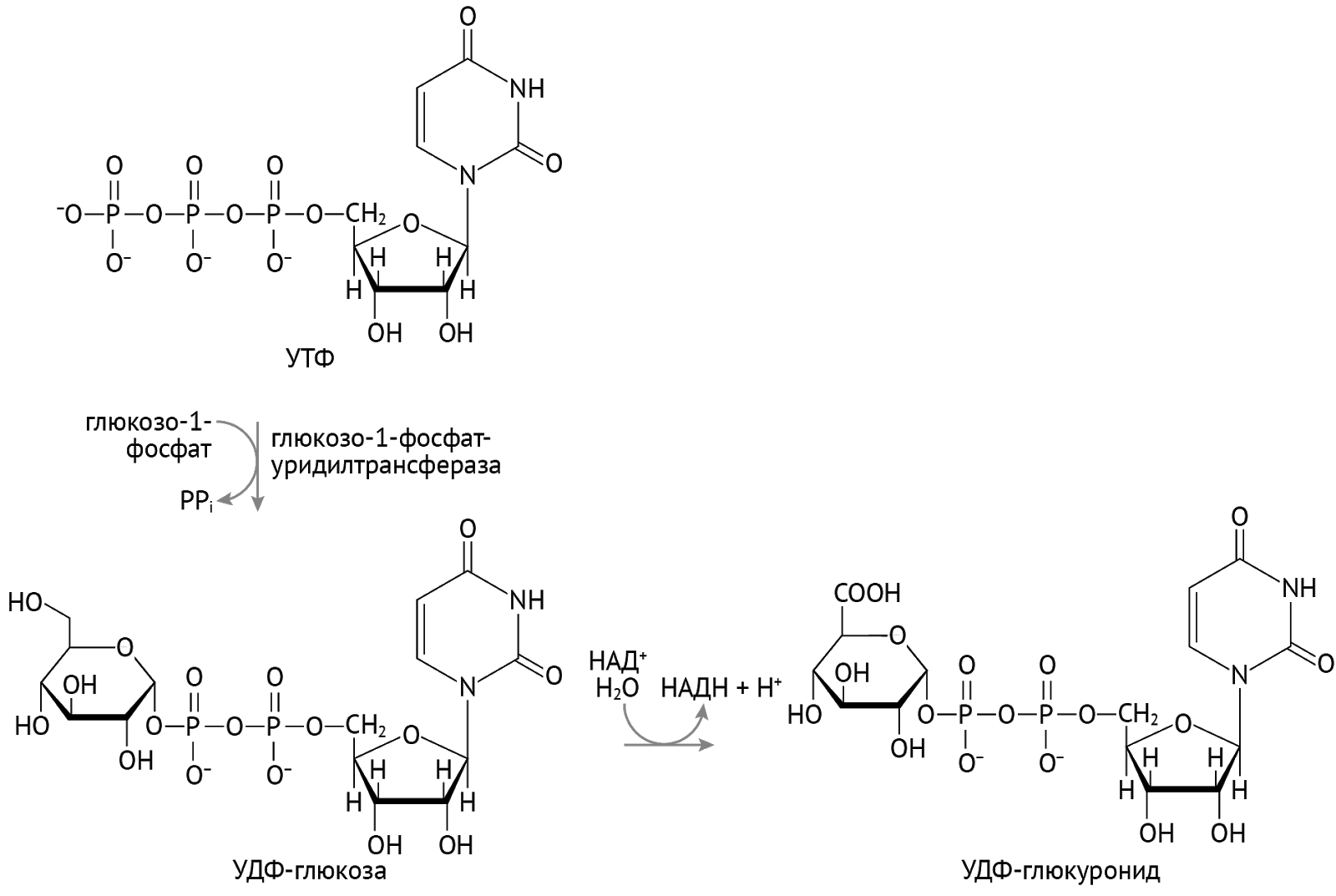
Важное значение эта форма УДФ имеет и для метаболизма билирубина: благодаря УДФ-диглюкурониду токсичный липофильный билирубин становится полярным, растворимым в крови и моче, конъюгированным билирубином [1, 2].
Гликоген. Неоценимое значение УДФ имеет и для образования гликогена.
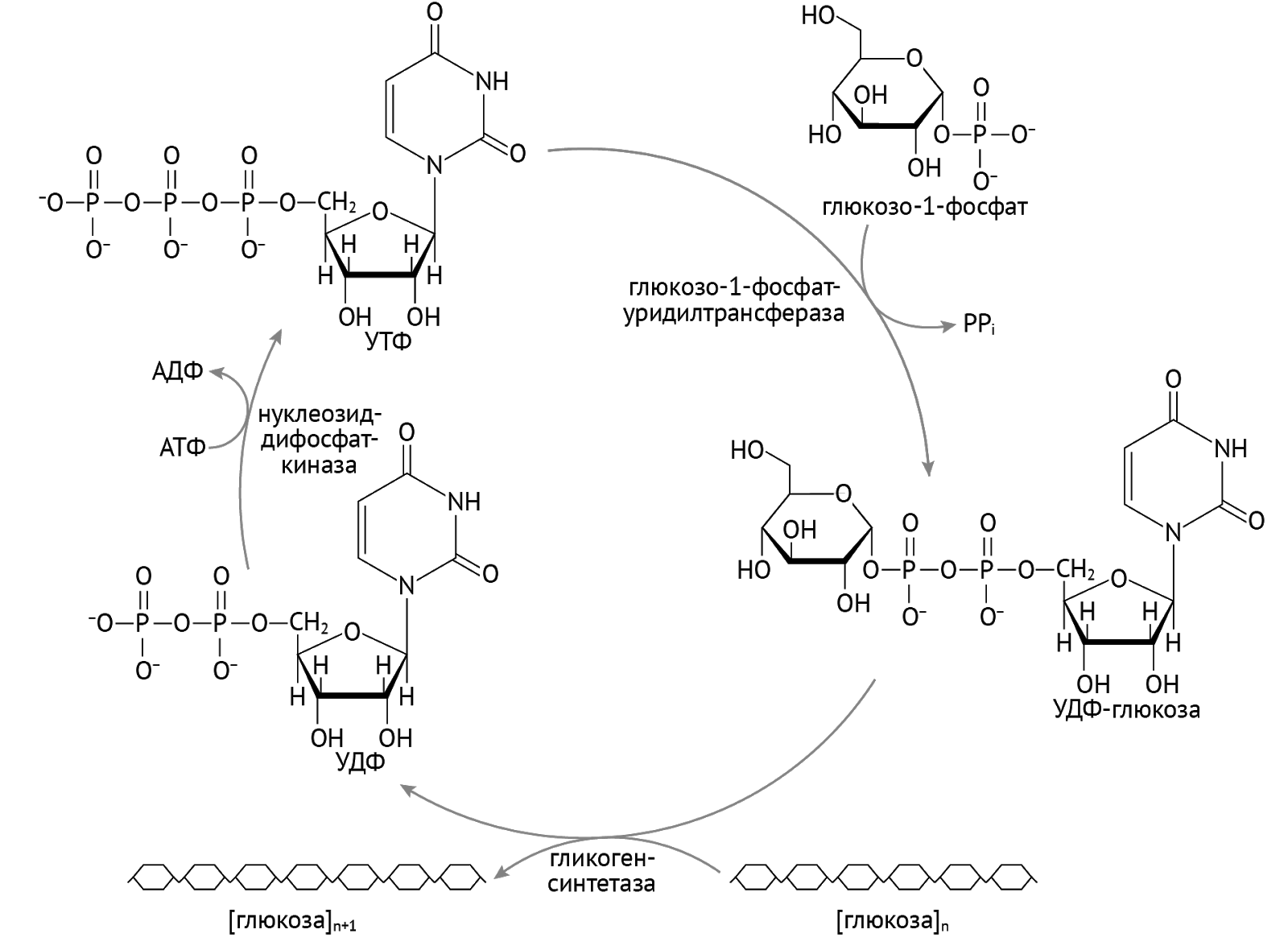
Гликоген — это сравнительно инертная макромолекула, которая является резервуаром источника энергии в печени и мышцах. Через восприятия сигнала от инсулина глюкоза посредством активации (в виде присоединения фосфорного остатка и изомеризации) прыгает на гликоген благодаря посредничеству УТФ [1].
Вторичные сигнальные молекулы. Нуклеотиды, в частности, цАМФ и цГМФ, играют важную роль в процессе реализации клеточных функций и межклеточного взаимодействия. Клетка, будучи кирпичом биологического коммунизма, воспринимает сигналы от вышестоящих регуляторных систем, которые контролируют ее деятельность.
Это может выражаться в:
- изменении экспрессии генов;
- реализации действия нейромедиаторов в твоей черепной и позвоночной коробках.
Такие молекулы, как цАМФ и цГМФ, являются одними из важных вторичных мессенджеров. Клетка, воспринимая сигнал извне (будь то гормон, нейромедиатор или любой другой разбойник), изменяет внутри себя концентрацию этих мессенджеров. Те вмешиваются в серию внутриклеточных последовательных реакций и тем самым усиливают первоначальный сигнал [4].
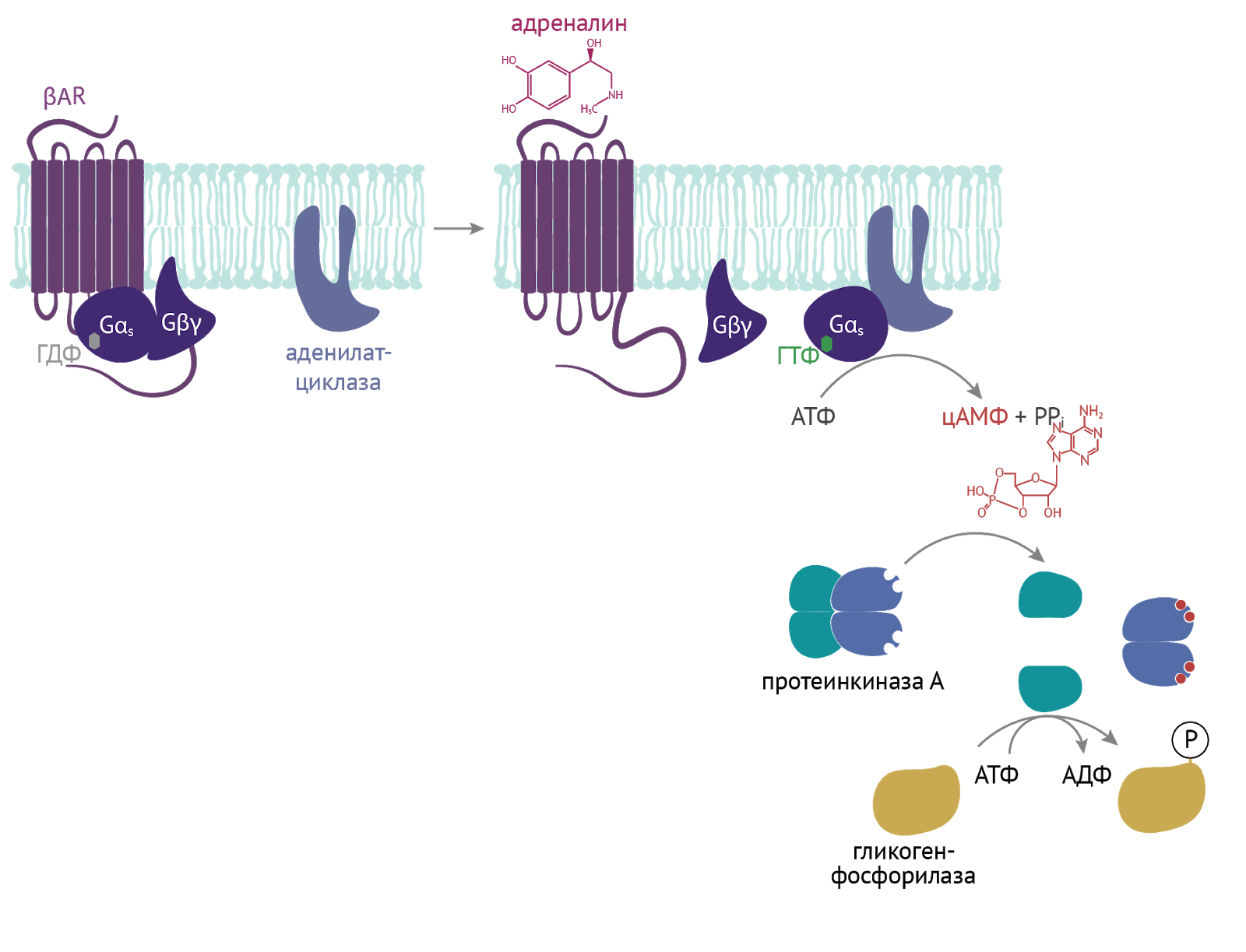
Здесь пример воздействия адреналина на метаболизм гликогена. Концентрация цАМФ растет, что приводит к активации протеинкиназы А. Та активирует гликогенфосфорилазу, что приводит к высвобождению из гликогена глюкозы и получению дополнительного источника энергии для выполнения различных нужд организма [4].
Примеров, когда нуклеотиды играют важную роль в организме, чрезвычайно много. Вспомнить хотя бы о том, кто в клетках является главным источником энергии (АТФ). Нуклеотиды в ходе своего метаболизма могут становиться источником иных метаболитов, которые могут принимать участие в энергетическом метаболизме (α-кетоглутарат, пировиноградная кислота 🡪 ацетил-Коа) и так до бесконечности. Придет время, и мы обсудим те случаи, когда метаболизм пуринов и пиримидинов в силу тех или иных причин нарушается [1].
Иногда это имеет очень серьезные последствия…
Источники:
- Я. Кольман, К. - Г. Рем Наглядная биохимия, 5-е издание. 2018 г.
- В. Дж. Маршалл Клиническая биохимия, 6-е издание, 2016 г.
- https://biokhimija.ru/ — раздел, посвященный обмену пиримидинов и пуринов.
- Жизнь клетки: рук. по цитологии /под ред. Н. С. Абдукаева [и др.] ; С.-Петерб.гос. педиатр. мед. ун-т. - 2-е изд., перераб. и доп. - СПб. : Янус, 2014.
- Федеральные клинические рекомендации «Ревматоидный артрит», 2017 г.
