Молекулярные разновидности глутаматных AMPA-рецепторов
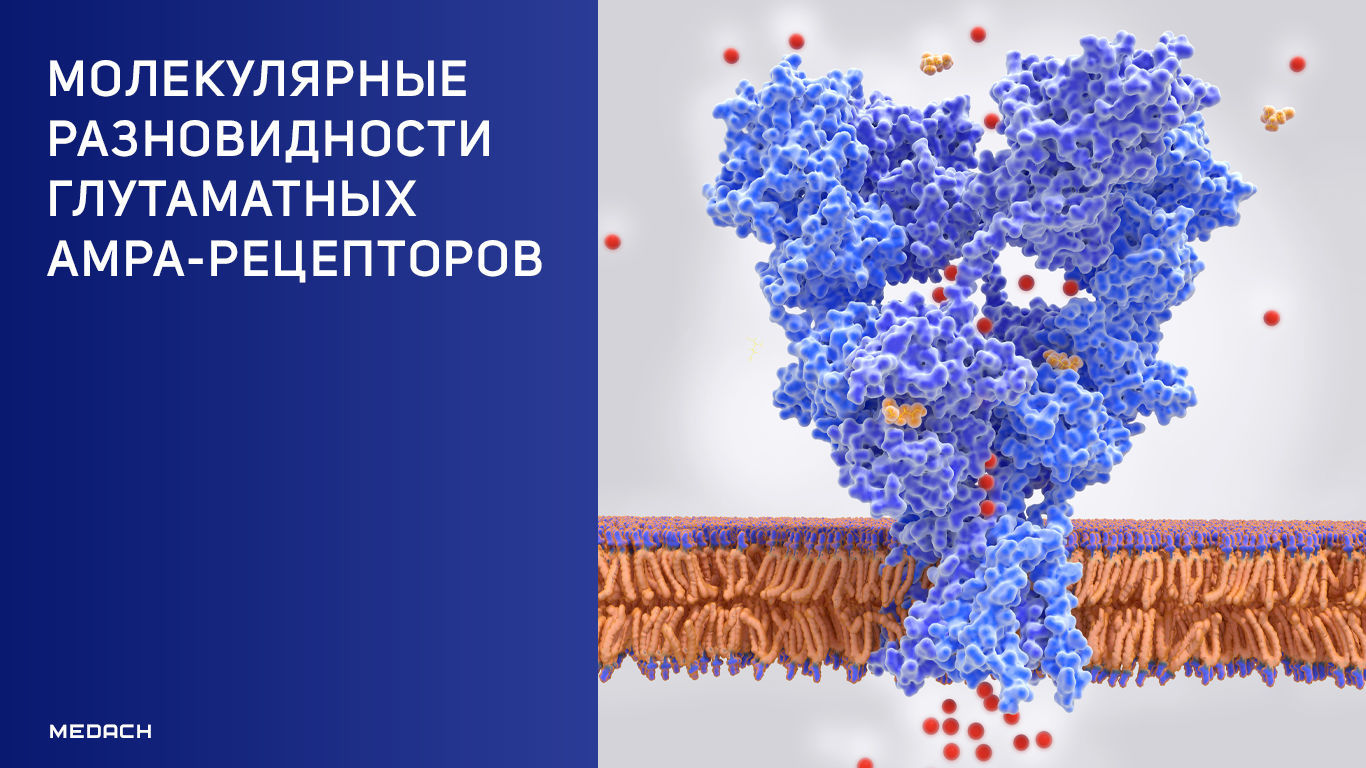
AMPA-рецепторы — это класс белковых комплексов, играющих ключевую роль в нейрональной коммуникации. В двух исследованиях представлены результаты изучения структуры этих рецепторов в области мозга, именуемой гиппокампом.
Жителей Бранденбурга (историческая область, где расположен Берлин) и Баварии, Нью-Йорка и Новой Англии можно различить по диалекту, который отражает различия не только в географическом положении носителей языка, но также в их культуре и истории. На первый взгляд кажется маловероятным, что такое разнообразие могло бы существовать среди AMPA-рецепторов — класса белковых структур, активируемых нейротрансмиттерной молекулой глутаматом при контакте между нейронами. Эти важные рецепторы находятся повсюду в головном мозге, однако белковые субъединицы, формирующие структуру их центрального канала, кодируются всего четырьмя генами, вследствие чего возникает предположение о невозможности существования различных молекулярных вариантов данных рецепторов в разных областях мозга. Однако данные протеомики свидетельствуют о том, что AMPA-рецепторы на самом деле могут являться крупными комплексами со множеством дополнительных субъединиц, которые сложно выделить. В своей статье в «Nature» Yu с соавт. [1] и Zhang с соавт. [2] представляют новый взгляд на структуру AMPA-рецепторов гиппокампа (области мозга, играющей ключевую роль в формировании памяти), демонстрируя существование молекулярных вариантов, свидетельствующих о разнообразии, казалось бы, универсальной структуры.
При возбуждении глутамат выделяется из пресинапса в синаптическую щель и связывается с AMPA-рецепторами на клеточной мембране постсинапса. При активации AMPA-рецепторов происходит открытие их каналов, по которым ионы быстро перемещаются в клетку, что приводит к электрическому возбуждению. Новые собранные AMPA-рецепторы располагаются на клеточной мембране в особой локации, называемой постсинаптической плотностью (ПСП), — сложном кластере белков, расположенном на постсинаптическом нейроне прямо напротив пресинапса, из которого выделяется глутамат. Сборка AMPA-рецепторов начинается с каркасных белков, таких как ПСП-95, в зависимости от уровня активности синапса. Сила синапса может изменяться посредством увеличения или уменьшения количества рецепторов. Процессы, лежащие в основе синаптической пластичности (т. е. способности синапсов изменяться по своей силе), — потенциальные клеточные механизмы для обучения навыкам и сохранения воспоминаний.
Новаторская работа, в ходе которой ученые определяли экспрессию четырех субъединиц канала AMPA-рецептора (GluA1-4) в разных типах клеток в мозге крыс [3], объясняет некоторые (но далеко не все) варианты AMPA-рецепторов в зависимости от их активационных характеристик. АМРА-рецепторы гиппокампа интересны тем, что участвуют в синаптической пластичности, но почему они выделяются по сравнению с АМРА-рецепторами в других областях мозга? AMPA-рецепторы «украшены» добавочными белками (среди которых насчитывается более 30 различных белковых молекул [4]), выделить которые очень трудно. Именно они обеспечивают AMPA-рецепторы локальными молекулярными особенностями в зависимости от той зоны мозга, где рецепторы расположены.
В биологии известно множество функций мультипротеиновых комплексов, и особенности естественных (т. е. полученных из живых тканей) комплексов важны для понимания их истинных биологических свойств. Пусть в предыдущей работе и были определены структура, состав и активационные свойства определенных комбинаций субъединиц AMPA-рецептора in vitro, нативные комплексы этих рецепторов, которые содержат больше, чем крайне ограниченное число субъединиц, в значительной степени не поддаются аналогичной характеристике.
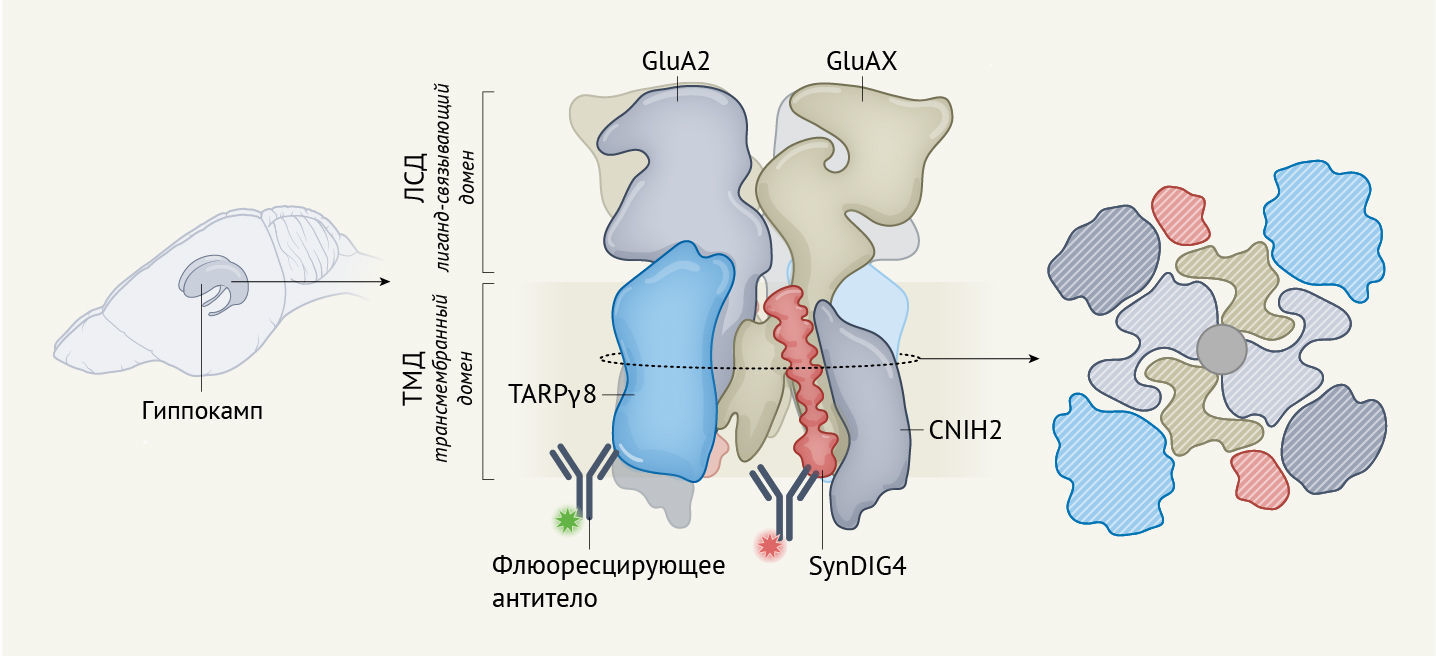
Выявление удивительных деталей этих рецепторных комплексов становится возможным благодаря современной криоэлектронной микроскопии, когда удается разделять и объединять образцы, состоящие из смеси комплексов с различными субъединицами в их составе. В двух исследованиях использовались разные подходы к очистке белковых комплексов, хотя каждый из этих методов не лишен недостатков в ходе процесса получения очищенных комплексов. Zhang с соавт. [2] «смешали» вместе последовательности ДНК, которые кодируют субъединицы GluA2 и вспомогательный белок TARPγ8, и провели экспрессию этого «коктейля», а также субъединицы GluA1 в линии клеточных клонов, в которой коэкспрессировался вспомогательный белок CNIH2. Yu с соавт. [1] выделили дефицитные комплексы непосредственно из гиппокампа мышей посрдством захвата GluA2, наиболее распространенной субъединицы, и посредством экстракции комплексов, таких как TARPγ8. Ученым удалось осуществить это с помощью молекулы, называемой JNJ-55511118, которая связывает и блокирует активность комплексов, содержащих белок TARPγ8. Авторам удалось разработать комбинацию субъединиц в каждом комплексе, используя небольшие фрагменты антител, посредством которых помечались определенные субъединицы. Таким образом, Yu с соавт. также смогли расположить JNJ-55511118 в его сайте связывания в структурах нативных рецепторов, расположенных между GluA1 и TARPγ8.
Результаты двух исследований совпадают, и в ходе каждого предоставлено независимое подтверждение того, что обнаруженные структуры отражают состав нативных (естественных) комплексов. Yu с соавт. [1] прикрепляли молекулы флуоресцентного красителя к нативным рецепторам с помощью селективных антител. Ученые обнаружили, что флуоресценцию большинства молекул красителя, прикрепленных к субъединицам TARPγ8 в каждом AMPA-рецепторе, можно было приглушить (т. н. приглушение люминесценции) в два этапа, тем самым подтверждая предположение, что каждый из рецепторных комплексов содержит две субъединицы TARPγ8. Методика, примененная Zhang с соавт. [2], свидетельствует, что активационные свойства октамерных комплексов, использованных ими в эксперименте, содержащих по две субъединицы GluA1, GluA2, TARPγ8 и CNIH2, более точно имитируют свойства рецепторов из естественных клеток пирамидных нейронов гиппокампа, чем свойства комбинированных комплексов, состоящих, например, только из CNIH2 или TARPγ8.
Дальнейший структурный анализ нативных комплексов, выделенных Yu с соавт. [1], свидетельствовал о наличии α-спирали в пространстве между субъединицами GluA1 и CNIH2. Мечение антител и метод приглушения люминесценции подтвердили, что данная спираль является вспомогательным белком SynDIG4 (рис. 1). Этот уникальный комплекс из 10 субъединиц (октамер и потенциально две субъединицы SynDIG4) является интересной находкой и ключевым объектом, поскольку он расширяет число возможных способов, посредством которых функция рецепторов AMPA может модулироваться комбинациями вспомогательных белков. Оглядываясь назад, можно сказать, что структура удивительно хорошо согласуется с предыдущими данными масс-спектрометрии [5], согласно которым предполагается периферическое расположение данной субъединицы. Любопытно, что SynDIG4 имеет две мембранные спирали [6]; тот факт, что гипотетическая часть этого белка (вторая спираль мембраны) не была зафиксирована в структурах Yu с соавт., предполагает, что в структуре AMPA-рецепторов впоследствии будет обнаружено большее разнообразие субъединиц.
Октамерный комплекс, примененный Zhang с соавт. [2], предоставляет еще одно свидетельство: структуру в активированном состоянии с открытой порой ионного канала. Из огромного количества структур полноразмерных рецепторов глутамата это только третий, соответствующий нативному, рецептор с открытой структурой [7, 8]. Сравнение структур инактивированных и активированных рецепторов демонстрирует, что нежное плавное движение периферических субъединиц сопровождает активацию (рис. 2).
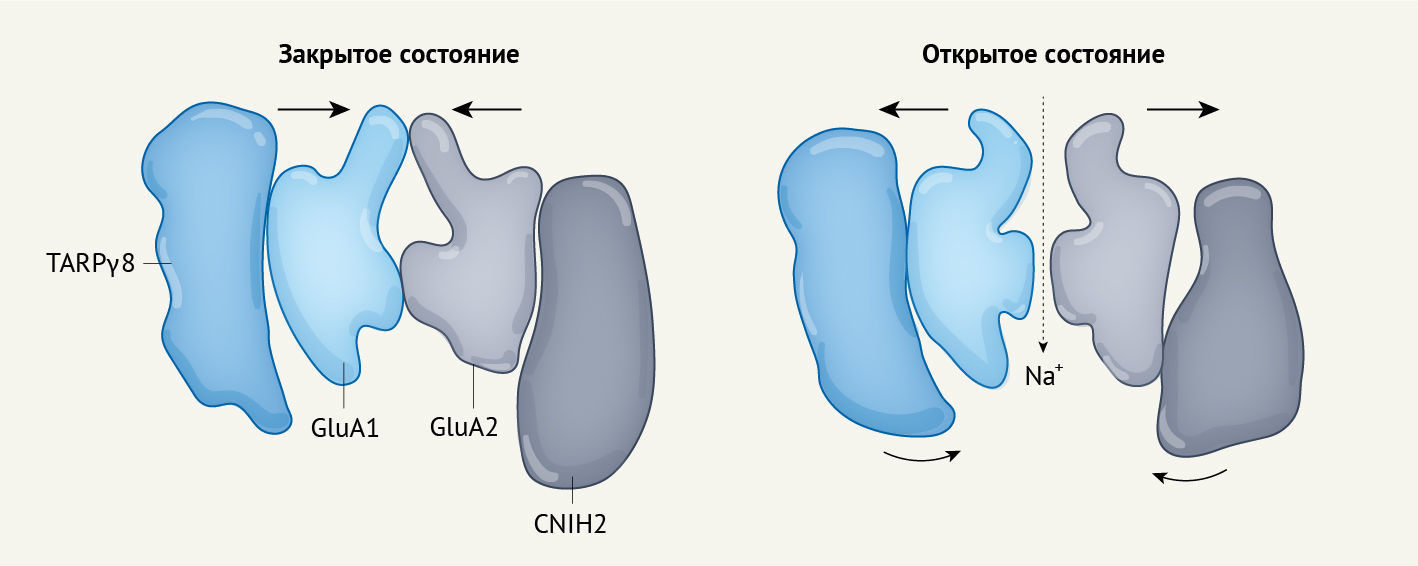
Субъединица CNIH2 являлась предметом многочисленных споров [9], но теперь, несомненно, она является ключевой в биологии AMPA-рецепторов. Она в значительной степени стабилизирует их открытое состояние, а переход, описанный Zhang с соавт., предоставляет два свидетельства к разгадке того, как это происходит. Во-первых, триплет аминокислотных остатков фенилаланина на внешней стороне CNIH2 контролирует сборку комплекса. Во-вторых, протяженная спираль CNIH2 упирается во внутриклеточные петли субъединиц канала, движение с завихрением которых было уже ранее обнаружено с помощью оптической спектроскопии [10].
Значительная часть AMPA-рецепторов хранится внутри клетки или находится в клеточной мембране вне синапсов. Таким образом, насколько исследованных комплексов [1, 2] отражают нативные синаптические рецепторы, что является актуальным вопросом. Предостережение о том, что это не синаптические рецепторы, регулярно звучало от многих специалистов в течение 30 лет с момента искусственного синтеза этих субъединиц [11]. Yu с соавт. [1] обнаружили ПСП-95 в их экспериментальном препарате, но неясно, были ли эти рецепторы синаптическими, потому что PSD-95 также обнаруживаются и вне синапсов [12]. До тех пор, пока не будут разработаны методы для маркировки или фиксации синаптических рецепторов и для работы с крайне малыми концентрациями искомых субстанций, которые могут быть получены, этот вопрос будет сохранять актуальность.
Тем не менее, будет неожиданным разочарованием, если рецепторы, полученные в ходе этих исследований, окажутся не истинно синаптическими, потому что у них есть необходимые «крючки», чтобы попасть в ПСП. Однако возможно, что вместо этого они могут быть своего рода «материалом», из которого состоят синаптические рецепторы, возможно, после обмена субъединицами в клеточной мембране. Сами синаптические рецепторы получить труднее, потому что они прочно фиксированы на ПСП посредством химических связей между их внеклеточными доменами и другими молекулами, участвующими в формировании синапса.
Оба исследования предлагают четкие правила, по которым субъединицы могут формировать AMPA-рецепторы. Однако другие субъединицы, такие как CKAMP44, а также другие вспомогательные белки из группы TARP, также должны присутствовать в комплексах рецепторов AMPA гиппокампа, и еще предстоит выяснить, чем такие комплексы отличаются от других аналогичных в иных областях мозга. Теперь специалисты надеются получить сведения о других белковых комплексах мембран, в том числе и из таких областей мозга, как мозжечок и кора. Чтобы понять взаимодействие внутри таких комплексов, необходимы функциональные и спектроскопические исследования, как это было осуществлено ранее [13]. Теперь стало возможным изучать активацию нативных рецепторов в режиме реального времени, схожих с теми, которые существуют на никотиновых рецепторах в мышцах у электрических скатов Torpedo marmorata [14].
Люди, чуждые иноязычной культурной среде, или переводчики часто стремятся использовать разговорный язык или вычурный стиль, соответственно. Но, несмотря на сильную стигматизацию относительно AMPA-рецепторов, теперь ученые знают, что данный тип рецепторных молекул далеко не полностью изучен.
