Сводка по вакцинам для интраназального введения

Высококонтагиозный коронавирус SARS-CoV-2, вызывающий тяжелый острый респираторный синдром, поражает дыхательные пути, а одним из способов его передачи является воздушно-капельный (аэрозольный). Следовательно, непривитым людям рекомендовано носить маски в общественных местах, соблюдать карантинные мероприятия при наличии симптомов и социальное дистанцирование. Несмотря на эти меры предосторожности, миллионы людей умирают. Поскольку волны пандемии следуют одна за одной, тема актуальности вакцин вновь занимает первые полосы газет. Кроме того, скорость разработки вакцинных препаратов на основе информационной (матричной) РНК (мРНК) возрастает. Однако, учитывая тропность вируса к тканям дыхательных путей, удивительно, что только семь из почти 100 вакцин против SARS-CoV-2, которые в настоящее время проходят клинические испытания, предназначены для интраназального введения. К преимуществам вакцин для интраназального введения относятся:
- отсутствие необходимости инъекции посредством иглы;
- попадание антигена в вакцине к месту инфицирования;
- активация иммунитета слизистой оболочки дыхательных путей.
Идея о том, что интраназальная вакцинация преимущественно защищает дыхательные пути, не нова: еще в 1960-е гг. велись разработки живой аттенуированной вакцины против гриппа (ЖАВПГ), которая была одобрена Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA). Иммунологам давно известно, что инфекция верхних дыхательных путей (ВДП) или вакцинация стимулируют антительный ответ (в виде иммуноглобулина A [IgA]) как в сыворотке, так и в жидких средах тканей ВДП. Внутримышечные вакцины преимущественно стимулируют выделение IgG (накапливается в сыворотке). IgA играет важную роль в ВДП и носовых ходах, где происходит его активный транспорт через эпителий и высвобождение в просвет дыхательных путей в виде димера, связанного с секреторным компонентом, посредством чего формируется стабилизирующая конфигурация, позволяющая более эффективно нейтрализовать вирусы, такие как SARS-CoV-2 [1]. Напротив, IgG проникает через бронхиальное дерево в легочную ткань и защищает нижние доли легкого посредством пассивной транссудации через тонкий альвеолярный эпителий [2]. Возможно, IgG, выявленный в ВДП и носовых проходах, попадает в них из нижних отделов легких посредством мукоцилиарного транспорта. Однако высокая степень иммунной защиты носовых ходов с помощью IgG может быть достигнута только при высоких концентрациях данных антител в сыворотке крови [2]. Таким образом, вакцины, вводимые внутримышечно, стимулирующие высокие титры сывороточного IgG, могут снижать вирусную нагрузку в легких и носовых ходах.
CD8+ Т-лимфоциты являются еще одним важным компонентом противовирусного иммунитета; они уничтожают непосредственно инфицированные вирусом клетки, тем самым снижая репликацию вируса и ускоряя восстановление клеток и тканей от вирусной нагрузки. Некоторые активированные CD8+ Т-лимфоциты трансформируются в клетки памяти, которые сами по себе не могут предотвратить инфицирование, но способствуют запуску быстрых реакций в ответ на вторжение патогена и стимулируют эффекторные клетки. Примечательно, что В- и Т-клетки, стимулированные вакцинацией слизистой оболочки интраназальным способом или непосредственно инфекцией, экспрессируют рецепторы, способствующие закреплению на участках слизистой оболочки клеток, способных длительно функционировать и секретировать антитела; или благодаря этим рецепторам Т- и В-клетки могут существовать в качестве резидуальных клеток памяти. Резидуальные В- и Т-клетки памяти в легких и носовых ходах — незаменимые компоненты формирования иммунного ответа, они первыми реагируют на вторжение инфекции и необходимы для быстрого очищения тканей от вируса [3, 4]. Размещение резидуальных клеток памяти в дыхательных путях необходимо для того, чтобы оказался возможным их быстрый контакт с антигеном в данной области [3, 5]. Именно это означает, что способ введения вакцин, предназначенных для задействования резидуальных клеток памяти в процессе иммунного ответа в дыхательных путях, должен быть интраназальным.
По сравнению с вакцинами, вводимыми внутримышечно, интраназальные вакцины формируют две дополнительных линии «обороны»: индуцированный вакциной синтез IgA и резидуальные В- и Т-клетки памяти в слизистой оболочке дыхательных путей, создающие эффективный барьер для инфекционных агентов в этих областях. Даже в случае развития инфекции (например, вирусной или вызывающей перекрестные реакции с тканями макроорганизма) резидуальные В- и Т-клетки памяти, которые раньше сталкиваются с антигеном и реагируют значительно быстрее, чем циркулирующие по кровотоку клетки памяти, препятствуют репликации вируса и уменьшают его распространение по организму, а также, соответственно, снижают трансмиссивность инфекции (см. рисунок).
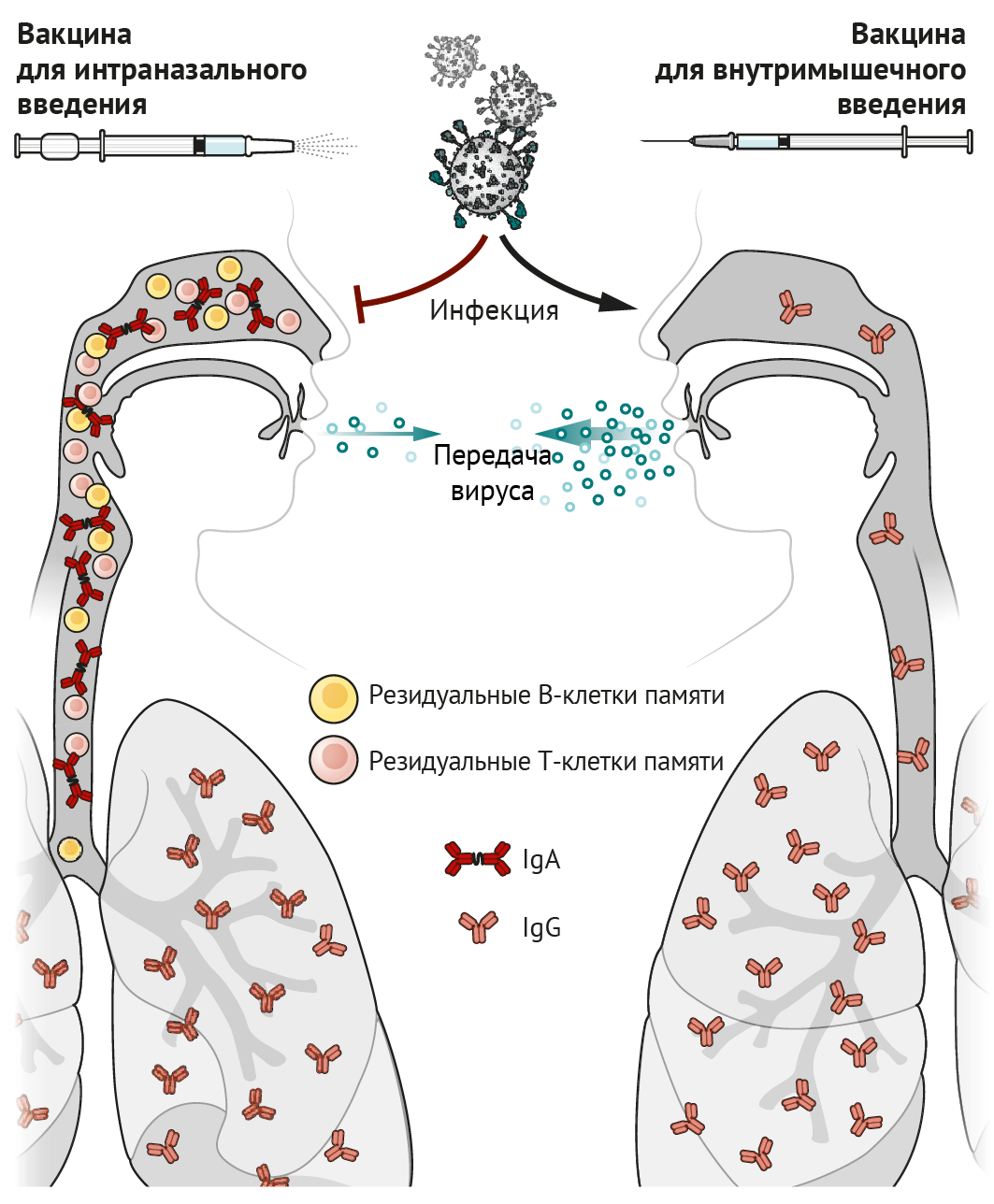
Таблица 1 | Вакцины против SARS-CoV-2 для интраназального введения, проходящие клинические испытания

Результаты доклинических испытаний вакцин на основе аденовирусных векторов, экспрессирующих шипиковый белок SARS-CoV-2 или его рецептор-связывающий домен (РСД), свидетельствуют о том, что интраназальное введение индуцирует длительный вирус-нейтрализующий антительный ответ (в виде сывороточных IgG), а также выделение антиген-специфических IgA и реакцию CD8+ Т-клеток дыхательных путей [6–8]. Более того, как интраназальное, так и внутримышечное введение вакцин на основе аденовирусных векторов предотвращает развитие пневмонии и истощения в модели инфекции. Однако животные, вакцинированные внутримышечным путем, продолжают выделять вирус из ВДП, тогда как у животных, вакцинированных интраназальным способом, наблюдается сниженная репликация и выделение вируса как из легких, так и из носовых ходов [8].
Аденовирусы — естественные патогены человека, и большинство взрослых людей подвергаются воздействию одного или нескольких штаммов, следовательно, у них могут оказаться антивирусные антитела, способные снизить эффективность вакцины (т. н. отрицательный перекрестный эффект). Однако интраназальная противогриппозная вакцина на основе вектора Ad5 (NasoVAX), вводимая в высоких дозах, работает аналогичным образом как у серопозитивных, так и серонегативных по наличию Ad5 людей [9]; возможно, это происходит по причине того, что вводимый объем вакцины способствует снижению локальных концентраций антител. Тем не менее, пытаясь избежать любого потенциального отрицательного воздействия вакцины, некоторые разработчики используют редкие штаммы аденовирусов человека или аденовирусов шимпанзе, с которыми большинство людей в популяции не сталкивалось.
В этой связи вакцина против SARS-CoV-2 на основе гриппозного вектора из университета Гонконга в процессе своей разработки может столкнуться с определенными препятствиями. Удаление гена вируса гриппа, кодирующего неструктурный белок 1 (NS1), в значительной степени ослабляет вектор (вирулентность самого вируса гриппа) и позволяет разработчикам заменить NS1 на РСД шипикового белка SARS-CoV-2. Как и вакцины на основе аденовирусного вектора, эта вакцина также должна вызывать синтез IgA к РСД на слизистых оболочках, а резидуальные клетки памяти также должны размещаться в дыхательных путях. Однако отрицательные перекрестные реакции со стороны уже существующих антител против гриппозного вектора могут снизить эффективность вакцины. Аналогичным образом, компания Meissa Vaccines разработала вектор из живого аттенуированного респираторно-синцитиального вируса (РСВ); в нем рецепторные белки F и G РСВ были заменены на шипиковый белок SARS-CoV-2. При интраназальном введении такой химерный вирус должен вызывать иммунные реакции в слизистой оболочке. Необходимо отметить, что существует предположение, согласно которому изменение поверхностных белков изменит клеточную тропность вируса, а также его иммуногенность. Уже существующие антитела против РСВ теоретически не должны мешать развитию иммунного ответа вследствие вакцинации, но уже существующие антитела против шипикового белка могут снизить его интенсивность.
Показателями эффективности живых аттенуированных интраназальных вакцин против SARS-CoV-2 также должны стать способность вызывать антительный ответ (в виде IgA) слизистых оболочек и формирование популяции резидуальных клеток памяти в ВДП. В отличие от векторных вакцин, экспрессирующих только шипиковый белок или РСД, живой аттенуированный вирус SARS-CoV-2 обладает преимуществом в экспрессии и потенциальной стимуляции иммунного ответа против всех вирусных белков, тем самым формируя иммунитет широкого спектра действия, который теоретически способен обеспечивать определенный уровень иммунной защиты против различных вариантов штаммов SARS-CoV-2. Хотя современные молекулярные методы минимизируют риск реверсии, живые аттенуированные вирусы сохраняют репликативную способность и противопоказаны детям младше 2 лет, людям старше 49 лет или лицам с ослабленным иммунитетом, поэтому живые аттенуированные вирусы SARS-CoV-2 и РСВ, экспрессирующий шипиковый белок, также могут столкнуться с пристальным изучением их потенциальной возможности вызывать побочные симптомы со стороны нервной системы [10].
При разработке живых аттенуированных вакцин необходимо обязательно брать в расчет опыт применения ЖАВПГ в прошлом. У детей чаще применяют интраназальный способ введения ЖАВПГ, нежели внутримышечный [11]. Вероятно, это отражает иммунологическую наивность детей (большинство из них за жизнь еще не сталкивалось с вирусом гриппа). Следовательно, отсутствует иммунный барьер для инфекции, провоцируемой ЖАВПГ в носовых ходах, и введение вакцины оказывается эффективным, приводя к формированию устойчивого антительного ответа (IgA) в слизистой оболочке и появлению резидуальных клеток памяти в ВДП. ЖАВПГ, вводимая интраназально, также эффективна у взрослых, но не в той же степени, что вакцина, введенная внутримышечно [11], отчасти потому что инфекция гриппа в анамнезе привела к формированию базового уровня иммунитета, который еще больше снижает вирулентность вируса в ЖАВПГ. Следовательно, живые аттенуированные вакцины против SARS-CoV-2 могут привести к формированию надежной защиты у наивных людей, но у людей, переболевших COVID-19 в анамнезе, может быть достаточная степень иммунной защиты для нейтрализации вакцины, что ставит под сомнение ее эффективность даже в качестве средства ревакцинации.
Только одна из интраназальных вакцин, проходящих клинические испытания, является инертной — это кубинская вакцина CIBG-669, в составе которой присутствует РСД, связанный с коровым антигеном вируса гепатита B (является мощным стимулятором Т-лимфоцитов). Поскольку инертные вакцины не зависят от наличия инфекции в анамнезе или экспрессии генов, иммуногенность таких препаратов не может быть нейтрализована уже существующими антителами. Однако растворимые белки в составе вакцин при попадании на слизистые ВДП, не приводят к нарушению целостности эпителия (что необходимо для эффективного развития иммунного ответа). Вместо этого они должны переноситься сквозь эпителиальный барьер специализированными микроскладчатыми клетками (M-клетки) [12], способными доставлять антигены к иммунокомпетентным клеткам под слоем эпителия.
Примечательно, что в списке интраназальных вакцин отсутствуют вакцины, в составе которых находится мРНК, инкапсулированная в липидный слой. МРНК-вакцины, вводимые внутримышечно, приводят к образованию высоких титров сывороточного IgG против антигенов, кодируемых мРНК. Исследования на животных моделях (грызуны) свидетельствуют, что вакцины, содержащие мРНК, также эффективны при интраназальном введении [13]. Однако важно различать интраназальную вакцинацию и назальную вакцинацию. Грызунам часто дают наркоз для интраназальной вакцинации, чтобы животные медленно и глубоко дышали, вследствие чего вакцинный биоматериал в полной мере попадает в легкие. В результате большая часть литературы (включая некоторые цитируемые здесь источники) об интраназальной вакцинации грызунов на самом деле относится к внутрилегочной вакцинации, которая может обеспечить более полную защиту, чем строго назальная вакцинация. Тем не менее, резидуальные клетки памяти из носовых ходов могут предотвратить попадание вируса в легкие [4]. Учитывая, что доставка вакцины непосредственно в нижние дыхательные пути может вызывать воспаление или привести к обострению таких состояний, как бронхиальная астма или хроническая обструктивная болезнь легких (ХОБЛ), введение интраназальных вакцин людям обычно осуществляют таким образом, чтобы предотвратить непосредственное попадание антигена в легкие.
Липидный состав имеет решающее значение для стабильности мРНК вакцины, для прицельного воздействия иммунокомпетентных клеток и высвобождения мРНК в цитозоль. Таким образом, успешность применения интраназальных мРНК-вакцин в будущем, вероятно, будет зависеть от разработки липидных наночастиц, на которые смогут воздействовать соответствующие типы клеток в носовых ходах. В отличие от вирусов и вирусных векторов, на поверхности липидных наночастиц нет белков, и теоретически они не должны нейтрализоваться антителами. Благодаря этому, тот же состав, что и при первом введении, может быть применен для ревакцинации. Однако сохраняется вероятность развития побочных эффектов, таких как повышенная усталость и недомогание, часто связанных с введением вакцин на основе мРНК. Следовательно, при разработке интраназальных вакцин, содержащих мРНК, важно учитывать эти аспекты во избежание побочных эффектов и повышенной реактогенности.
В конечном счете, цель вакцинации — стимуляция иммунитета на длительное время. Однако продолжительность антительного ответа (по антителам сыворотки) значительно варьируется в зависимости от недостаточно изученных свойств антигенов, инициирующих иммунную реакцию [14]. Антительный ответ в слизистой оболочке считается краткосрочным, однако его фактическая продолжительность зависит от того, как часто иммунокомпетентные клетки встречают определенный антиген. Аналогично, циркулирующие Т-клетки иммунной памяти самообновляются и сохраняются на длительные периоды времени, тогда как популяция Т-клеток памяти, находящаяся в легких, исчезает относительно быстро: в большей степени это касается CD8+ Т-клеток, чем CD4+ Т-клеток. Таким образом, действие интраназальных вакцин должно вносить равновесие между функционированием местного иммунитета в дыхательных путях и длительностью системного иммунитета. Однако эффективные стратегии вакцинации не должны ограничиваться одним путем введения. Действительно, клетки памяти, стимулированные вакциной, введенной внутримышечно, могут быть доставлены внутрь слизистой путем интраназальной ревакцинации слизистой оболочки [15]. Таким образом, идеальная стратегия вакцинации может быть следующей:
- внутримышечное вакцинирование для индукции длительно действующего системного антительного (IgG) ответа и стимуляции широкого спектра циркулирующих В- и Т-клеток памяти;
- интраназальная ревакцинация, которая служит для привлечения В- и Т-клеток памяти в носовые ходы и дальнейшей их дифференцировки для защиты слизистой оболочки, в том числе для секреции IgA и распределения резидуальных клеток памяти в дыхательных путях.
