Изменения в терморегуляции у «моржей»

Аннотация
Скандинавская культура зимнего плавания заключается в кратковременных погружениях в холодную воду, которые чередуются с сеансами горячей сауны, что, возможно, влияет на температуру тела. Авторы статьи решили изучить термогенную бурую жировую ткань (БЖТ) у опытных мужчин, занимающихся зимним плаванием 2–3 раза в неделю. Полученные данные свидетельствуют о более низком состоянии теплового комфорта у зимних пловцов по сравнению с контрольной группой с более низкой внутренней температурой и отсутствием активности БЖТ.
В ответ на холодовое воздействие наблюдаются увеличение индуцированного холодом термогенеза и повышение температуры кожи в надключичной области у зимних пловцов, а поглощение глюкозы БЖТ и мышечная активность увеличиваются одинаково в обеих группах. Все испытуемые демонстрируют ночное снижение температуры кожи надключичной области, в то время как у зимних пловцов пик приходится на 4:30–5:30 утра. Данные, полученные в ходе исследования, улучшают понимание роли БЖТ в терморегуляции у взрослых людей, дают возможность предположить акклиматизацию как к жаре, так и к холоду у зимних пловцов, а также предлагают зимнее плавание в качестве потенциальной стратегии увеличения расхода энергии.
▶ Подробнее о рецепторах температуры: Нобелевская премия по физиологии и медицине 2021
Введение
У взрослых людей бурая жировая ткань (БЖТ) присутствует поверхностно в надключичной области и в более глубоких областях, близких к симпатической нервной системе, включая шею, позвоночник и паранефральную область [1, 2]. БЖТ — это термогенная ткань, которая использует свободные жирные кислоты для производства тепла за счет митохондриального разобщения, что делает ее очень энергоемкой в холодных средах, где активен термогенез. У мышей экспрессия термогенного гена BAT также регулируется суточным ритмом, который не зависит от холодового стимула [3].
У людей суточный ритм БЖТ прослеживается по отношению к поглощению глюкозы и жирных кислот [4, 5]; однако на сегодняшний день нет данных о суточной регуляции БЖТ или температуры кожи в надключичной области. БЖТ стимулируется активацией симпатической нервной системы и индуцированным норэпинефрином адренергическим сигналингом, который, как было показано, у людей осуществляется через β2-адренергический рецептор, а не через β3-адренорецептор, как у мышей [6]. У людей субстрат для термогенеза обеспечивают внутриклеточные липидные резервуары в БЖТ [7]. Однако активность БЖТ также связана с одновременным поглощением циркулирующих жирных кислот и глюкозы, при этом глюкоза указывает на активное состояние БЖТ, которое можно отслеживать с помощью позитронно-эмиссионной томографии (ПЭТ) / компьютерной томографии (КТ) в сочетании с инъекцией радиофармпрепарата 2-дезокси-2-[18F]-фтор-D-глюкозы (18F-ФДГ).
Активация БЖТ увеличивает скорость метаболизма [8], хотя неоднократное охлаждение или хроническое фармакологическое лечение β-адренергическим агонистом мирабегроном увеличивает чувствительность к инсулину в сочетании с повышением количества чувствительных к холоду клеток БЖТ [9–12]. Наконец, недавнее крупномасштабное ретроспективное исследование продемонстрировало связь активности БЖТ и более низкой распространенности кардиометаболических заболеваний. Молекулярная характеристика и альтернативные подходы к анализу данных ПЭТ/КТ с 18F-ФДГ показывают, что поглощение глюкозы не полностью пропорционально количеству существующих клеток БЖТ [1, 14]. У взрослых людей БЖТ неоднородно состоит из многокапельных и однокапельных адипоцитов и демонстрирует неактивный фенотип [14]; при этом накопление липидов увеличивается с возрастом [15], а потребление глюкозы — сильно снижается [13].
Более того, индуцированное холодом поглощение 18F-ФДГ БЖТ варьируется в зависимости от индекса массы тела (ИМТ) и чувствительности к инсулину [16]. Учитывая ранее упомянутые метаболические преимущества, наряду с присутствием неактивных клеток БЖТ у людей, улучшенная регуляция БЖТ у взрослых может быть потенциальной стратегией предупреждения развития метаболических заболеваний. Погружение в холодную воду приводит к активации симпатической нервной системы, а зимнее плавание в течение одной минуты и менее резко увеличивает уровень норадреналина в плазме, тогда как регулярное зимнее плавание предотвращает такое повышение [17]. Эта адаптация может быть связана с интенсивной иннервацией, которая возникает во время акклиматизации тканей к холоду [18], хотя это еще не было исследовано у зимних пловцов.
Зимнее плавание обычно практикуется с погружениями в холодную воду (бассейны, озера или море/океан), которые чередуются с посещениями горячей сауны. Таким образом, можно ожидать, что зимние пловцы будут лучше адаптироваться как к холодным, так и к жарким условиям. Учитывая терморегулирующую роль БЖТ, авторы предполагают, что у зимних пловцов регуляция этой ткани будет отличаться по сравнению с контрольной группой, соответствующей по возрасту, полу, ИМТ и физической форме.
Авторы проводили оценку путем измерения активности БЖТ на основании данных ПЭТ-сканирования с введением 18F-ФДГ в качестве главного результата. В перекрестном исследовании с вмешательствами, выполняемыми в случайном порядке, мужчины выполняли действия в соответствии с протоколами охлаждения и теплового комфорта.
▶ Читать по теме: Избегание адренергической стимуляции как способ индуцирования термогенеза жировой ткани
Результаты и обсуждение
Обследуемая группа людей
Предыдущие исследования БЖТ человека продемонстрировали большие различия в ее активности, и в ходе последующей обработки информации авторы разделили образцы на БЖТ с высоким и низким уровнем активности на основе экспрессии [19] мРНК UCP1 или негативной и позитивной БЖТ на основе поглощения 18F-ФДГ ее клетками в ответ на охлаждение [20]. Другие исследования показали, что определяющие факторы активности БЖТ включают возраст [21], ИМТ [22, 23] и температуру воздуха [24, 25].
В текущем исследовании авторы стремились сохранить эти факторы. Проводилось изучение опытных пловцов, которые практиковали 2–3 занятия в неделю по плаванию/нырянию в холодной воде и начали по крайней мере свой второй сезон зимнего плавания. Поскольку большинство пловцов, занимающихся зимним плаванием, также пользуются сауной, можно ожидать, что эти лица приспособятся как к холодной, так и к жаркой среде. Основываясь на мощной симпатической активации, происходящей в ответ на воздействие холодной воды [26], авторы предположили, что зимние пловцы будут иметь БЖТ, адаптированную к холоду, с высокой выработкой тепла в ответ на воздействие низких температур.
Для исследования были набраны здоровые молодые мужчин, которые занимались зимним плаванием (n = 8), и контрольная группа (n = 8), состоящая из лиц, соответствующих по возрасту, полу, ИМТ и максимальному потреблению кислорода во время изнурительных упражнений (VO2max). Среди зимних пловцов все, кроме одного исследуемого, пользовались сауной. Лица контрольной группы не посещали сауны и не использовали холодовую или тепловую терапию в течение периода исследования. Первоначальное обследование продемонстрировало более высокий процент общего жира у лиц из контрольной группы (p < 0,007), несмотря на отсутствие различий в ИМТ. Кроме того, наблюдались незначительные различия в биохимии крови натощак, включая более низкий уровень тироксина (Т4), щелочной фосфатазы и трансферрина, а также более высокие уровни калия у зимних пловцов.
Характеристика исследуемых людей и параметры эксперимента
Пероральный глюкозотолерантный тест показал, что все участники исследования имели нормальную толерантность к глюкозе в соответствии с критериями Американской диабетической ассоциации [27], за исключением одного человека из контрольной группы, у которого была нарушена толерантность к глюкозе. В группе зимних пловцов наблюдалась более низкая концентрация глюкозы в плазме крови спустя 120 минут после проведения теста, что свидетельствует о большей утилизации глюкозы по сравнению с контрольной группой. Хотя нынешний дизайн исследования не позволяет делать выводы о случайных эффектах, наблюдения авторов совпадают с предыдущими данными, демонстрирующими, что чувствительность к инсулину у лиц среднего возраста повышается после зимнего купального сезона [28].
Улучшение клиренса глюкозы после акклиматизации к холоду у людей, вероятно, объясняется, по крайней мере частично, более эффективным ее поглощением скелетными мышцами посредством выработки инсулина [29, 30]. Как и ожидалось, у здоровых людей уровни инсулина соответствовали уровню глюкозы в плазме, однако различий между группами не наблюдалось. Затем испытуемые были подвергнуты холодовому прессорному тесту — часто используемому протоколу стресса у людей для оценки симпатической реактивности и способности переносить охлаждение [31].
Испытуемые погружали одну руку в холодную воду при 4 °C на 3 минуты. Этот тест вызвал повышение пульса, систолического и диастолического артериального давления в обеих группах; более выраженный эффект наблюдался в контрольной группе, что свидетельствует об акклиматизации к холоду в группе зимних пловцов. Ни один из участников не соответствовал критериям гиперреактивности. С помощью этого теста авторы пришли к выводу, что обе группы испытуемых реагировали на холод, хотя и с разной чувствительностью. Впоследствии в отдельные дни авторы оценивали субъективную реакцию на охлаждение и состояние теплового комфорта.
Протокол охлаждения был также выполнен на третий день, в течение которого были взяты биопсии брюшной подкожной белой жировой ткани и измерен расход энергии в покое (РЭП). Важно отметить, что дни охлаждения включали в себя периоды состояния теплового комфорта в качестве контрольных периодов (рис. 1G). Начиная с фазы теплового комфорта в течение 45 минут испытуемые получали 195 минут охлаждения и 45 минут повторного согревания.
Температура кожи надключичной области в местах, где БЖТ прилегала к коже, измерялась в реальном времени с помощью инфракрасной термографии (ИКT) на протяжении всего протокола охлаждения до тех пор, пока испытуемые не были просканированы с помощью ПЭТ/магнитно-резонансной томографии (МРТ). Основным результатом было поглощение 18F-ФДГ в БЖТ, что позволило разделить зимних пловцов и контрольную группу и проанализировать их как две отдельные группы, а также исключить одного испытуемого.
Повышение температуры кожи в надключичной области вследствие холодового воздействия
ИКT можно использовать для выполнения неинвазивных измерений температуры кожи в качестве оценки активности БЖТ, когда ИКT-изображения получают вблизи поверхностных депо БЖТ — например, в надключичной области. На сегодняшний день неоднородность в дизайне холодовых исследований человека затрудняет их сравнение [32–35]. В текущем исследовании авторы воспользовались дешевым и неинвазивным методом отбора проб для выполнения непрерывных измерений теплопродукции во время охлаждения или в состоянии теплового комфорта. Важным отличием ИКT по сравнению с методами золотого стандарта, ПЭТ/КТ с 18F-ФДГ или ПЭТ/МРТ [36] является то, что он измеряет результат активности БЖТ (т. е. выделенное тепло), а не поглощение глюкозы, которое количественно оценивается с помощью ПЭТ/КТ или ПЭТ/МРТ.
Температура кожи в надключичной области по-прежнему является косвенным показателем активности БЖТ, потому что помимо производства тепла этой тканью на температуру влияет изоляция от жира/кожи, изменение кровотока, вазодилатация/вазоконстрикция, теплопродукция близлежащими мышцами и температура крови, которая, в свою очередь, будет зависеть от выработки тепла дистальными мышцами или другими органами.
Авторы не нашли альтернативных протоколов для описания состояния теплового комфорта. В лаборатории были проведены пилотные исследования для отработки и выполнения протокола охлаждения, подходящего для продолжительной оценки функции БЖТ в реальном времени с применением ИКТ во время охлаждения и в состоянии теплового комфорта. Авторы использовали систему управляемой гипо/гипертермии Blanketrol® III, которая связана с двумя наполняемыми водой одеялами, что позволяло точно регулировать и регистрировать температуру, которая воздействовала на испытуемых. Температура воды регулировалась в реальном времени на основе восприятия холода с помощью настраиваемой визуальной аналоговой шкалы (ВАШ). ВАШ — это хорошо зарекомендовавший себя способ субъективной оценки ощущений — например, тревожности [39].
Аналогичный метод применялся в исследовании БЖТ для оценки восприятия холода и контроля мышечной дрожи [40]. В день охлаждения испытуемые изначально находились в состоянии теплового комфорта в течение 45 минут, а затем температура воды постепенно снижалась в течение первого часа охлаждения, что соответствует увеличению индивидуальных баллов по ВАШ восприятия холода. Внутренняя температура, измеренная ректальными термометрами, была первоначально стабильной, но снизилась к концу протокола охлаждения. Полученные данные показывают, что воспринимаемая температура не отличалась между группами. Результаты получилось воспроизвести на второй день, когда авторы повторно применили протоколы охлаждения.
В день теплового комфорта активность БЖТ оценивалась в состоянии теплового комфорта с использованием тех же параметров, что и в первый день охлаждения; однако испытуемые находились в субъективном состоянии теплового комфорта, т. е. не ощущали ни холода, ни жара, и оценка состояния по ВАШ варьировалась от 4 до 5 баллов. У испытуемых в обеих группах во время охлаждения повышалась температура кожи в надключичной области, но реакция была более выраженной в группе зимних пловцов, и различия в тепловом состоянии (момент времени 45 минут) наблюдались в нескольких временных точках во время охлаждения.
Температура кожи в области грудины в целом была выше в группе зимних пловцов, но при охлаждении разницы не наблюдалось. При нормализации температуры кожи в области грудины и температуры теплового комфорта температура кожи в надключичной области была выше в группе зимних пловцов, разница была видна на второй день охлаждения. В день испытания на тепловой комфорт авторы наблюдали изменение температуры кожи надключичной области и грудины в зависимости от времени, в то время как никаких конкретных временных точек, отклоняющихся от 45-минутного временного момента, не наблюдалось.
Регистраторы температуры кожи на пяти периферических участках тела показали в целом более высокую периферическую температуру для группы зимних пловцов. Это наблюдение может говорить о большей теплоотдаче в группе зимних пловцов, что согласуется с предыдущими наблюдениями за адаптацией к воздействию тепла [41, 42]; это, вероятно, обусловлено посещением сауны. Поскольку процентное содержание жира в тканях было выше в контрольной группе, авторы рассмотрели вопрос о том, отличалась ли толщина подкожной жировой клетчатки в надключичной области, что могло оказать отрицательное влияние на измерения ИКТ. Для измерения промежутка между поверхностью кожи и активной БЖТ были проанализированы результаты МРТ-сканирования.
Клинические эксперты пришли к выводу, что у всех испытуемых этот промежуток был незначительным, потому что активная БЖТ доходила до кожи в области, где температура БЖТ измерялась с помощью ИКТ. Следовательно, различия в изоляции БЖТ в надключичной области не могли объяснить наблюдаемую разницу в термогенной реакции между группами во время охлаждения. Однако на температуру кожи в надключичной области также может влиять тепло, выделяемое близлежащей мускулатурой или транспортируемое посредством кровообращения из других органов. В заключение следует отметить, что измерение температуры кожи в надключичной области БЖТ с использованием ИКT следует интерпретировать с осторожностью.
Повышенный холодовой термогенез у зимних пловцов
По прошествии 60 минут в условиях протоколов по охлаждению или тепловому комфорту испытуемым вводили 18F-ФДГ, а через 60 минут проводили ПЭТ/МРТ-сканирование в течение еще 60 минут на системе Biograph mMR, Siemens (Эрланген, Германия) с помощью магнита в 3 Тл с катушкой для обследования всего тела.
Все испытуемые, за исключением одного из зимних пловцов (рис. S2A), продемонстрировали поглощение активированного холодом 18F-ФДГ в областях накопления БЖТ, измеренных в районе шеи и до уровня диафрагмы. С целью выявления физиологических различий, связанных с БЖТ, мы решили исключить испытуемого с отсутствующей БЖТ из исследования. На основании ПЭТ/КТ-сканирования с 18F-ФДГ метаболически активная БЖТ была полуавтоматически выделена от основания черепа до верхней части диафрагмы с использованием порога стандартизованного уровня накопления (SUV) 2.0. Авторы рассчитали SUV как захват 18F-ФДГ (введенная доза / вес пациента) в граммах на миллилитр.
Физиологическое поглощение другими структурами — в том числе во рту, носу и щитовидной железе — исключалось вручную. Исходя из выделенного объема интереса (VOI), авторы определили объем БЖТ как объем VOI, максимальный SUV (SUVmax) — как уровень в наиболее активной зоне по захвату 18F-ФДГ в VOI и средний SUV (SUVmean) — как средний уровень накопления внутри VOI. Этот метод является одним из наиболее часто публикуемых методов исследования БЖТ с использованием ПЭТ/КТ-сканирования для определения активности БЖТ и не зависит от данных, полученных при КТ [43]. В то время как между группами не наблюдалось различий в уровнях глюкозы в плазме, у зимних пловцов в целом был ниже уровень инсулина.
Между группами не было отмечено статистически значимой разницы в показателях артериального давления и частоты сердечных сокращений. Поглощение 18F-ФДГ в печени оценивали путем анализа SUVmean в трехсантиметровой сфере в правой доле печени. Двухфакторный анализ ANOVA не выявил различий между группами или видами лечения, хотя наблюдалась тенденция к меньшему поглощению в группе зимних пловцов (среднее значение в контрольной группе 1,7 г/мл по сравнению со средним значением 1,5 г/мл для зимних пловцов, p = 0,06).
Напротив, в состоянии теплового комфорта авторы наблюдали интересную разницу между группой зимних пловцов и контрольной группой: последняя продемонстрировала умеренное поглощение 18F-ФДГ в БЖТ у большинства испытуемых, в то время как у зимних пловцов не было поглощения ни в одной из областей. Причина такого отсутствия поглощения глюкозы в группе зимних пловцов интригует и может быть связана с индивидуальным протоколом субъективного теплового комфорта и возможным изменением ощущения холода по отношению к физиологической реакции в группе зимних пловцов.
С другой стороны, данные могут отражать акклиматизацию к жаре из-за частого пребывания в сауне. Ранее предполагалось, что тепловая акклиматизация приведет к снижению заданной температуры активной зоны [41], что, в свою очередь, отразится на снижении теплопродукции и/или увеличении теплоотдачи. Полученные результаты также показывают, что БЖТ метаболически активна без восприятия холода у многих молодых здоровых мужчин. Эти наблюдения согласуются с ранним выявлением поглощения ФДГ в клинических исследованиях, в которых обсуждалось, что субъекты могли подвергаться умеренному холоду в связи с процедурой сканирования [2].
Данные также согласуются с недавним исследованием, демонстрирующим, что поглощение глюкозы, а также секреция лактата в БЖТ происходит в теплых условиях [44]. Полученные данные наряду с предыдущими подтверждают идею о том, что БЖТ поддерживает температуру тела на уровне теплового комфорта у взрослых людей. Хотя ощущение холода явно приводит к активации несократительного термогенеза, активность БЖТ в состоянии теплового комфорта может быть важна для рассмотрения при обсуждении снижения функции БЖТ, вызванного современным образом жизни. Важно отметить, что при корректировке объема активного поглощения, анализирующего метаболический объем БЖТ, больше не было различий между группами, хотя последующие тесты показали значительный эффект охлаждения только в контрольной группе.
Предыдущее исследование, в котором трехнедельную постоянную фармакологическую стимуляцию БЖТ осуществляли с помощью добавок мирабегрона [12], продемонстрировало повышенное поглощение 18F-ФДГ, особенно в брюшной полости. Поэтому проводилась отдельная количественная оценка БЖТ в паранефральной зоне.
Аналогичная картина была получена во время состояния теплового комфорта: поглощение 18F-ФДГ в группе зимних пловцов оказалось снижено, а в контрольной группе было умеренным. В отличие от БЖТ в вышележащих зонах, разница между группами отсутствовала, и только в группе зимних пловцов происходило значительное увеличение поглощения глюкозы в ответ на охлаждение в паранефральной БЖТ. Было показано, что РЭП во время охлаждения положительно коррелирует с активностью БЖТ [23].
Было обнаружено, что РЭП был выше в группе зимних пловцов во время охлаждения, в соответствии с более высокой температурой кожи в надключичной области. Индуцированный холодом термогенез рассчитывается по дельте увеличения РЭП. В группе зимних пловцов наблюдался значительно более высокий его уровень. Интересно, что расход энергии увеличился на 500–1000 ккал / 24 ч, тогда как в предыдущем исследовании сообщалось, что БЖТ у человека вырабатывает примерно 20 ккал / 24 ч [45], однако участники исследования были примерно на десять лет старше (им было за тридцать), чем нынешние испытуемые (которым было за двадцать). Поэтому, учитывая сильную корреляцию между возрастом и снижением активности БЖТ [13], вполне вероятно, что у участников данного исследования затраты энергии были больше, чем у участников предыдущего исследования.
Тем не менее, разница в затратах энергии, обусловленных холодом, не может быть объяснена различием в поглощении глюкозы БЖТ между группами, что также свидетельствует о дополнительных вкладах в холодовой термогенез. Затем был рассмотрен потенциальный вклад мышц. На основе анализа двухэнергетической рентгеновской абсорбциометрии (ДЭРА) не было обнаружено различий между группами в безжировой массе, что по сути отражает массу скелетных мышц. Чтобы оценить возможность сократительного термогенеза во время протокола охлаждения, проводился контроль мышечной активности с помощью электромиографии (ЭМГ). Этот метод включал постоянную запись и создание большого набора данных.
Также была проанализирована мышечная активность в течение последних 5 минут 45-минутного состояния теплового комфорта и проведено сравнение с 5-минутным периодом после 30 минут охлаждения. В результате было получено 300 000 информационных единиц на каждого субъекта в каждой временной точке. Для каждого испытуемого была проведена оценка различий в мышечной активности в состоянии теплового комфорта и при охлаждении посредством расчета площади под кривой (включая отрицательные пики), а затем сравнивался эффект охлаждения в группах. Используя этот подход, авторы наблюдали эффект охлаждения, который был значимым только в группе зимних пловцов при оценке с помощью заключительного теста; с помощью двустороннего анализа ANOVA различий между группами обнаружено не было.
Было отмечено, что у некоторых испытуемых в ответ на охлаждение наблюдалось поглощение глюкозы в межреберных мышцах. Из-за отсутствия данных компьютерной томографии было невозможно количественно оценить этот сигнал. Тем не менее, клинический эксперт по ПЭТ провел слепую оценку результатов сканирования, и создалось впечатление большего поглощения в межреберных мышцах в группе зимних пловцов по сравнению с контрольной группой. Не было никакой положительной или отрицательной корреляции между поглощением глюкозы БЖТ и мышцами. В заключение стоит отметить, что в то время как БЖТ и мышцы были активированы в ответ на холод, между группами не было четкой разницы в поглощении глюкозы, которая могла бы объяснить более высокий холодовой термогенез, наблюдаемый в группе зимних пловцов и поддерживаемый более высокой температурой кожи надключичной области, наблюдаемой при ИКТ.
Эти наблюдения наводят на мысль о том, что поглощение глюкозы БЖТ не всегда может быть пропорционально активности этой ткани. Несократительный термогенез у взрослых людей основывается на расщеплении жирных кислот, получающихся при гидролизе внутриклеточных триглицеридов (ТГ) у здоровых, худощавых испытуемых [7], в то время как поглощение глюкозы, вероятно, происходит для пополнения внутриклеточных запасов липидов. Ранее сообщалось о повышенном уровне утилизации и обмена жирных кислот у акклиматизированных к холоду мышей [46]. Таким образом, возможное объяснение заключается в том, что длительно адаптированная к холоду БЖТ демонстрирует измененное поглощение питательных веществ с пониженной утилизацией глюкозы, повышенным поглощением свободных жирных кислот и/или использованием жирных кислот, полученных из гидролизованных внутриклеточных ТГ. Авторы провели МРТ-сканирование в прямой связи с ПЭТ.
Несмотря на то, что снимки накладывались друг на друга, было невозможно использовать МРТ для установки пределов обнаружения сигнала ПЭТ. Тем не менее, МРТ также использовалась для оценки содержания воды в БЖТ. Процент воды ранее описывался как маркер митохондриальной активности [47], что является ключевым свойством БЖТ [18]. Таким образом, можно ожидать более высокого процентного содержания воды в БЖТ по сравнению с белой жировой тканью. Более того, БЖТ можно отличить от белой жировой ткани по сравнительно низкой доле жира с меньшим содержанием внутриклеточных липидов и более плотной капиллярной сети [48]. В соответствии с этим было обнаружено, что у участников исследования БЖТ содержала более высокий процент воды, чем белая жировая ткань, тогда как в скелетных мышцах, как и ожидалось, был значительно более высокий процент воды, чем в обоих типах жировой ткани.
В группе зимних пловцов процент воды в мышечной ткани также был выше, чем в жировой; однако между бурой и белой жировой тканью не наблюдалось разницы в процентном содержании воды. Это может свидетельствовать об усилении васкуляризации и митохондриального биогенеза БЖТ в группе зимних пловцов. Аналогичным образом, у адаптированных к холоду испытуемых наблюдалась повышенная вазодилатация в БЖТ [49]. Другой возможностью могут быть изменения в накоплении липидов и обмене веществ в группе зимних пловцов.
Ни в одной из групп не наблюдалось значимого влияния охлаждения на процентное содержание воды в БЖТ. Затем путем оценки экспрессии генов в биопсийном материале подкожной жировой ткани брюшной полости, собранном до и после острой стимуляции холодом, было изучено, существует ли избирательная регуляция маркеров термогенной дифференцировки и метаболизма липидов в БЖТ. Маркеры термогенной дифференцировки, включая PPARGC1A, TBX1, TMEM26 и CKMT2, не определялись ни группой, ни острым охлаждением, что исключало возникновение бурого жира, по крайней мере, в подкожном абдоминальном депо.
В ходе длительного охлаждения мышей было показано, что индуцируется экспрессия генов, участвующих в липолизе, глицеронеогенезе, реэтерификации жирных кислот, окислении жирных кислот и биогенезе митохондрий в БЖТ. Это позволяет предположить, что липогенез в БЖТ способствует формированию худого фенотипа [46]. Как и следовало ожидать, основываясь на их вызванном холодом симпатическом происхождении, некоторые липолитические маркеры либо регулировались острым охлаждением, либо различались между двумя группами испытуемых. PLIN1, кодирующий перилипин 1, который защищает липидные капли от разрушения чувствительной к гормонам липазой [50], имел более низкую экспрессию в группе зимних пловцов. Наконец, ELOVL6 (elongation of long-chain fatty acids family member 6), маркер липогенеза de novo (DNL) [51], имел более высокую экспрессию в БЖТ в группе зимних пловцов.
В целом, эти незначительные различия и регуляция экспрессии генов поддерживают дифференцированный липидный обмен в БЖТ в группе зимних пловцов. Хотя из полученных данных невозможно сделать вывод о том, усиливается ли обмен липидов в БЖТ в группе зимних пловцов, ранее было продемонстрировано, что маркеры липогенеза de novo коррелируют с маркером активности БЖТ UCP1 [52]. Таким образом, видно, что эти две группы различались с точки зрения поглощения 18F-ФДГ при термическом воздействии.
Тем не менее, у зимних пловцов был зафиксирован более высокий холодовой термогенез по сравнению с контрольной группой. Источник этой разницы в расходе энергии между группами не может быть четко определен с помощью текущих измерений. Однако очевидно, что в ее создании участвуют и БЖТ, и скелетные мышцы — возможно, с измененным метаболизмом липидов.
Более низкая внутренняя температура и отчетливо прослеживающийся суточный ритм температуры кожи надключичной области у зимних пловцов
Текущие данные в соответствии с предыдущими наблюдениями [44] позволяют предположить, что БЖТ активна в состоянии теплового комфорта — по крайней мере, в контрольной группе. Предыдущие исследования продемонстрировали суточный ритм метаболизма глюкозы и липидов БЖТ [4, 5]. Поэтому далее была проанализирована суточная терморегуляция у зимних пловцов и контрольной группы в состоянии теплового комфорта. Авторы исследовали изменение температуры БЖТ в течение 24 часов и выясняли, есть ли какая-либо разница между группами из-за предполагаемой адаптации к холоду у зимних пловцов. В подгруппу были включены участники из настоящего исследования (зимние пловцы — 5 человек; участники контрольной группы — 6).
Вышеуказанные испытуемые уже были охарактеризованы с помощью ПЭТ/МРТ с 18F-ФДГ и ИКT в ответ на охлаждение. Чтобы получить постоянную меру термогенеза в БЖТ в течение суток, в качестве основного показателя температуры кожи надключичной области авторы использовали iButtons. ИКT, которая применялась в более раннем эксперименте по охлаждению, оказалась не идеальным вариантом для измерения температуры во время сна, потому что метод требует вертикального положения сидя и точно фиксированного расстояния. Изображения, полученные в эксперименте по охлаждению (как описано ранее) у каждого испытуемого, послужили руководством для определения расположения кнопок iButton для нацеливания на подходящую поверхностную БЖТ.
Ознакомление и акклиматизация начались, когда испытуемые зарегистрировались в лаборатории в 16:00 за день до эксперимента. Свет был выключен в 10:30 вечера, и эксперимент начался на следующее утро в 7:00 утра с размещения кнопок iButton, приема пищи и взятия проб крови в соответствии со схематическим резюме. Все испытуемые были знакомы с ВАШ восприятия температуры тела и проинструктированы стремиться к состоянию теплового комфорта, представленному 4–5 баллами по ВАШ.
Оценка проводилась в течение дня, и испытуемым предлагалось использовать одеяла, носки и тапочки для регулировки восприятия температуры, чтобы достичь состояния теплового комфорта. Испытуемым разрешалось пользоваться своими компьютерами, но их просили как можно дольше оставаться в постели и разрешали только незначительные физические нагрузки, такие как посещение туалета. Количество шагов было записано с помощью шагомеров, и оно не не различалось между группами. Также между группами не было разницы в величинах диастолического и систолического артериального давления. Как и ожидалось, внутренняя температура демонстрировала суточный ритм со снижением температуры в течение ночи, пока испытуемые отдыхали в кровати [53].
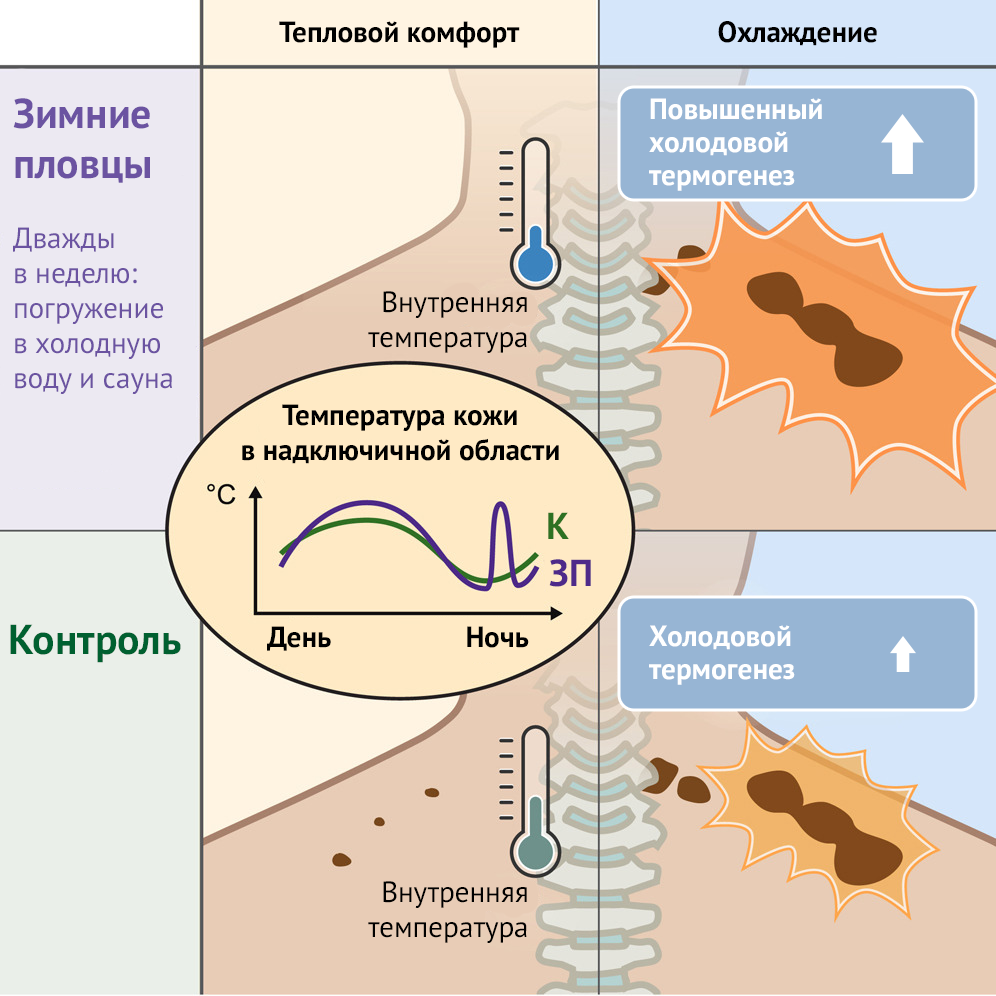
У зимних пловцов температура тела была ниже, чем у испытуемых в контрольной группе в течение 24-часового протокола. Это может быть следствием тепловой акклиматизации из-за регулярных посещений сауны группой зимних пловцов. Сообщалось, что тепловая акклиматизация действительно вызывает снижение температуры тела и увеличение объема крови [42].
Такая акклиматизация происходит за счет увеличения периферического кровотока, а также скорости потоотделения [41]; это позволяет предположить, что тепловая акклиматизация может даже снизить заданную температуру тела. Температура кожи в области грудины не демонстрировала суточного ритма, но здесь у зимних пловцов также была более низкая температура, чем у контрольных испытуемых, что, вероятно, в значительной степени обусловлено различиями в ночное время.
Напротив, авторы обнаружили, что у зимних пловцов температура кожи надключичной области была выше по сравнению с контрольной группой. Кроме того, кожа у левого виска показала более высокую температуру у зимних пловцов по сравнению с контрольной группой, что, возможно, отражает большую потерю тепла у зимних пловцов. Таким образом, авторы наблюдали более низкую внутреннюю температуру и потенциально повышенную теплоотдачу у зимних пловцов, что, возможно, объясняет отсутствие поглощения глюкозы в состоянии теплового комфорта в этой группе.
Затем авторы исследовали, существовали ли последовательные закономерности колебаний. У взрослых людей активность БЖТ регулируется не только холодом, но и постпрандиальной (возникающей после приема пищи) индукцией в той же степени в ответ на умеренный холод [54]. Поэтому удивителен тот факт, что после еды наблюдались лишь незначительные колебания температуры кожи в надключичной области. Это очевидное несоответствие с результатами, полученными Дином с соавт. [54] может отражать значительное влияние кровотока и теплопродукции от других органов на регуляцию температуры кожи надключичной области, снижающее ее ожидаемое повышение.
Кроме того, температура в помещении в течение дня была нестабильной и, следовательно, вероятно, повлияла на индивидуальную терморегуляцию. Напротив, впечатляющая закономерность регуляции проявлялась в течение ночи. Температура надключичной кожи была существенно снижена в соответствии с ритмом внутренней температуры. При увеличении температуры кожи надключичной области у зимних пловцов наблюдался паттерн температурных пиков.
Самый крупный пик появился около 5 часов утра и предшествовал повышению температуры тела до пробуждения в 7 часов утра. Хотя нельзя исключать, что на величину пика влияет взятие пробы крови в 5 часов утра, только два испытуемых сообщили утром, что они бодрствовали во время взятия пробы крови в 5 часов утра. Более того, поскольку этот температурный пик уже начал проявляться около 4:30 утра, то есть до взятия пробы крови в 5 утра, маловероятно, что он отражал изменение, вызванное взятием пробы крови.
Наконец, кровь также была взята в 2 часа ночи с использованием той же процедуры; однако в этот момент времени не наблюдалось пика температуры. В целом, остается маловероятным, что пик температуры можно объяснить воздействием при взятии пробы крови. Важно отметить, что как у зимних пловцов, так и в контрольной группе температура БЖТ ночью снижалась по сравнению с дневной (nightlow), в то время как у зимних пловцов пик температуры в раннее утро (nighthigh) не отличался от дневной температуры.
Температура в помещении была стабильной ночью, но выше днем. Это может повлиять на температуру кожи в течение дня; однако не объясняет различий между группами. Полученные данные свидетельствуют о наличии суточного ритма активности БЖТ и теплопродукции, наблюдаемой в покое в состоянии теплового комфорта. Разница между группами, возможно, объясняется повышенным созреванием и адаптацией БЖТ к холоду в группе зимних пловцов.
Явным преимуществом использования iButtons в этих условиях служит постоянная регистрация температуры непосредственно на коже и без помех для участника исследования. Использование ИКТ-изображения термогенно активированной БЖТ имело решающее значение для точного размещения iButtons. Несоответствие между показателями ИКT и iButtons было отмечено в исследовании, оценивающем эти методики [35], в котором подчеркивалось, что эти подходы могут иметь преимущества при различном применении. Более низкая внутренняя температура и регуляция температуры БЖТ у зимних пловцов способны повлиять на качество сна.
Цикл сна и пробуждения связан с гипоталамо-гипофизарно-надпочечниковой системой (ГГН) через секрецию кортизола [55]. Уровень гормона стресса кортизола наиболее высок утром, а затем постепенно снижается в течение дня. После засыпания уровень кортизола, как правило, продолжает снижаться до 2–3 часов сна, а затем снова начинает повышаться [55]. Такой паттерн регуляции кортизола может быть подтвержден у испытуемых в данном исследовании. В соответствии с предыдущими данными литературы, уровни кортизола были ниже в 10:30 вечера, чем в 8:00 утра в обеих группах.
В группе зимних пловцов, в отличие от контрольной группы, уровни кортизола также были ниже в 8:00 вечера и в 2:00 ночи по сравнению с 8:00 утра. Низкий уровень кортизола в ночное время полезен для качества сна [56]. Хотя в текущем исследовании сон не изучался, все испытуемые сообщили, что выспались хорошо. В 5:00 утра уровень кортизола начал повышаться в обеих группах и, таким образом, был связан с усилением термогенеза в БЖТ, наблюдавшимся в группе зимних пловцов.
С учетом текущих данных невозможно сделать вывод о том, существует ли связь между повышением уровня кортизола и повышением температуры кожи в надключичной области. Поскольку кортизол обладает сосудорасширяющим действием, опосредованный кортизолом рост температуры кожи может быть результатом увеличения притока крови, нагревающей кожу. Однако ранее было показано, что глюкокортикоиды стимулируют как поглощение глюкозы БЖТ, так и термогенез [57], повышая вероятность прямой активации БЖТ кортизолом.
Если смотреть в более широком ракурсе, то известно, что нарушения сна коррелируют с ожирением и другими заболеваниями обмена веществ [56]. Важным регулятором выделения кортизола из надпочечников является интерлейкин-6 (IL-6) [58] — многофункциональный белок, который ранее был исследован на предмет его связи с 1–2 стадиями ночного сна и сном с быстрым движением глаз [59]. В ходе исследования у зимних пловцов были определены более высокие уровни IL-6, что потенциально отражает дифференцированный режим сна.
Наконец, авторы подтверждают, что гормон насыщения лептин подвержен суточной регуляции и достигает максимума около 2–4 часов утра, что соответствует самым низким температурам в БЖТ. Уровни адипонектина в плазме крови не регулировались ни с течением времени, ни между группами в течение дня и ночи. Между группами не было различий в концентрации форменных элементов крови, таких как эритроциты, лейкоциты, лимфоциты, моноциты и нейтрофилы.
Однако авторы заметили, что концентрация форменных элементов крови менялась в течение 24-часового экспериментального цикла. Таким образом, полученные данные показывают более низкую внутреннюю температуру и указывают на увеличение теплоотдачи у зимних пловцов, в то время как при измерении температуры кожи надключичной области у них были отмечены пики перед пробуждением.
▶ Еще одно исследование о влиянии холода: Холод против рассеянного склероза
Заключение
У зимних пловцов, исследованных в этом эксперименте, была выявлена дифференциальная терморегуляция по сравнению с аналогичными контрольными группами. Большинство испытуемых контрольной группы продемонстрировали поглощение глюкозы БЖТ в состоянии теплового комфорта, что указывает на то, что БЖТ способствует поддержанию комфортной температуры тела у молодых людей. Напротив, у зимних пловцов наблюдалась более низкая внутренняя температура вследствие сниженного поглощения глюкозы БЖТ и более высокая температура кожи в нескольких отдаленных зонах во время состояния теплового комфорта, что говорит о потенциальной тепловой акклиматизации с пониженной внутренней температурой, вызванной увеличением теплоотдачи и снижением теплопродукции.
Эти различия могут также объяснить более выраженный холодовой термогенез у зимних пловцов по сравнению с контрольной группой. Хотя основной источник повышенной теплопродукции не был определен, вероятно, это была комбинация БЖТ и скелетных мышц. В заключение отметим, что полученные данные подчеркивают роль БЖТ у взрослых людей как части системы терморегуляции человеческого тела наравне со скелетными мышцами и кровотоком.
Кроме того, настоящее исследование наводит на мысль о том, что БЖТ у людей может участвовать в регуляции режима сна, что придает интерес изучению такого предположения в будущем. Наконец, полученные результаты мотивируют на исследование зимнего плавания как способа изменения образа жизни для увеличения расхода энергии у лиц с ожирением в качестве потенциальной стратегии снижения веса.
