Вакцинация беременных на фронте борьбы с гепатитами В и С

Для уничтожения вируса гепатита В (ВГВ) необходима надежная профилактика передачи вируса от матери к ребенку и более совершенные вакцины для защиты взрослых. У большинства людей, инфицированных перинатально, развивается хроническая инфекция, при которой иммунный ответ не эффективен, что приводит к опасным для жизни осложнениям. Поэтому особенно важно, чтобы эффективные вакцины и инновационные подходы были доступны, особенно в странах с низким и средним уровнем дохода (СНСД). Например, в Африке к югу от Сахары не менее 87 000 людей умирают от ВГВ ежегодно и инфицируются около 350 000 новорожденных. В 2021 г. Томпсон и соавторы изучили возможность добавления скрининга на ВГВ и противовирусной терапии для беременных женщин, инфицированных ВГВ, а также моновалентной вакцины против ВГВ при рождении к существующим дородовым мероприятиям по охране здоровья матери и ребенка от ВИЧ в Демократической Республике Конго. Такая двойная профилактика передачи инфекции от матери к ребенку показала эффективность и высокую приемлемость среди беременных женщин (> 80 %).
▶ Подкасты по теме:
Среди 4016 женщин, прошедших скрининг на наличие поверхностного антигена ВГВ (HBsAg) при постановке на учет по беременности, у 109 был положительный результат, из них 90 были включены в исследование; средний срок беременности составлял 19 недель. Девять женщин с высокой вирусной нагрузкой получали противовирусную терапию (тенофовира дизопроксила фумарат 300 мг/день) в период между 28 и 32 неделями беременности и до 12 недель после родов. Только 68 % родившихся младенцев получили вакцину при рождении, и из них 77 % получили ее своевременно (в течение 24 часов после рождения); несмотря на такое неоптимальное введение вакцины, передачи ВГВ от матери к ребенку не было зарегистрировано. Все младенцы родились в медицинских учреждениях, что необходимо для подобного подхода к профилактике, и подчеркивает важность популяризации родов в медицинских учреждениях в СНСД. Высокий уровень приемлемости такого подхода среди беременных женщин позволяет предположить, что интеграция тестирования и лечения ВГВ в деятельность учреждений, специализирующихся на лечении ВИЧ, особенно в странах Африки южнее Сахары, не приведет к усилению стигматизации и дискриминации и действительно обеспечит профилактику передачи ВГВ от матери к ребенку. Другие комплексные меры для повышения охвата вакцинацией взрослого населения включают использование платформ для иммунизации против COVID-19, но для повышения иммуногенности вакцины против ВГВ требуются дополнительные разработки. Vesikari с соавт. определили основные проблемы вакцинации уязвимых групп взрослого населения и разработали крупное исследование (PROTECT) с широким географическим распределением, чтобы определить, будет ли иммунный ответ на два дополнительных антигена HBV лучше, чем на стандартные моноантигенные вакцины против ВГВ.
Они также оценили показатель серопротекции после введения двух доз триантигенной рекомбинантной вакцины против ВГВ по сравнению со стандартной схемой введения трех доз моноантигенной вакцины, полученной в дрожжах, с алюминием в качестве адъюванта. Нужно учитывать, что пожилые люди с хроническими заболеваниями обычно не участвуют в клинических испытаниях вакцин или в программах догоняющей вакцинации. Однако для успешной ликвидации новых случаев инфицирования ВГВ вакцинация взрослого населения требует дополнительных усилий со стороны общественного здравоохранения. Триантигенная вакцина, содержащая малый, средний и большой антигены ВГВ, демонстрирует быстрый ответ и высокий показатель серопротекции после введения двух доз у здоровых молодых людей. История безопасного и эффективного использования этой вакцины для профилактики ВГВ в Израиле как у детей, так и у взрослых, насчитывает двадцать лет. Эти данные подтверждаются результатами III фазы исследования PROTECT, опубликованными в 2021 году, в которых документально подтверждены иммуногенность и безопасность трех доз триантигенной вакцины против ВГВ (796 человек) по сравнению с моноантигенной вакциной (811 человек) у взрослых в возрасте > 18 лет. Триантигенная вакцина превосходила моноантигенную вакцину, демонстрируя более высокий уровень серопротекции через четыре недели после третьей вакцинации у взрослых в возрасте 45 лет и старше. Полученные данные показали, что триантигенная вакцина более иммуногенна, и поэтому может быть использована для взрослых, в том числе с хроническими заболеваниями. Это исследование наряду с другим исследованием фазы III (CONSTANT; NCT03408730) может сыграть решающую роль в элиминации ВГВ в этой популяции (рис. 1).
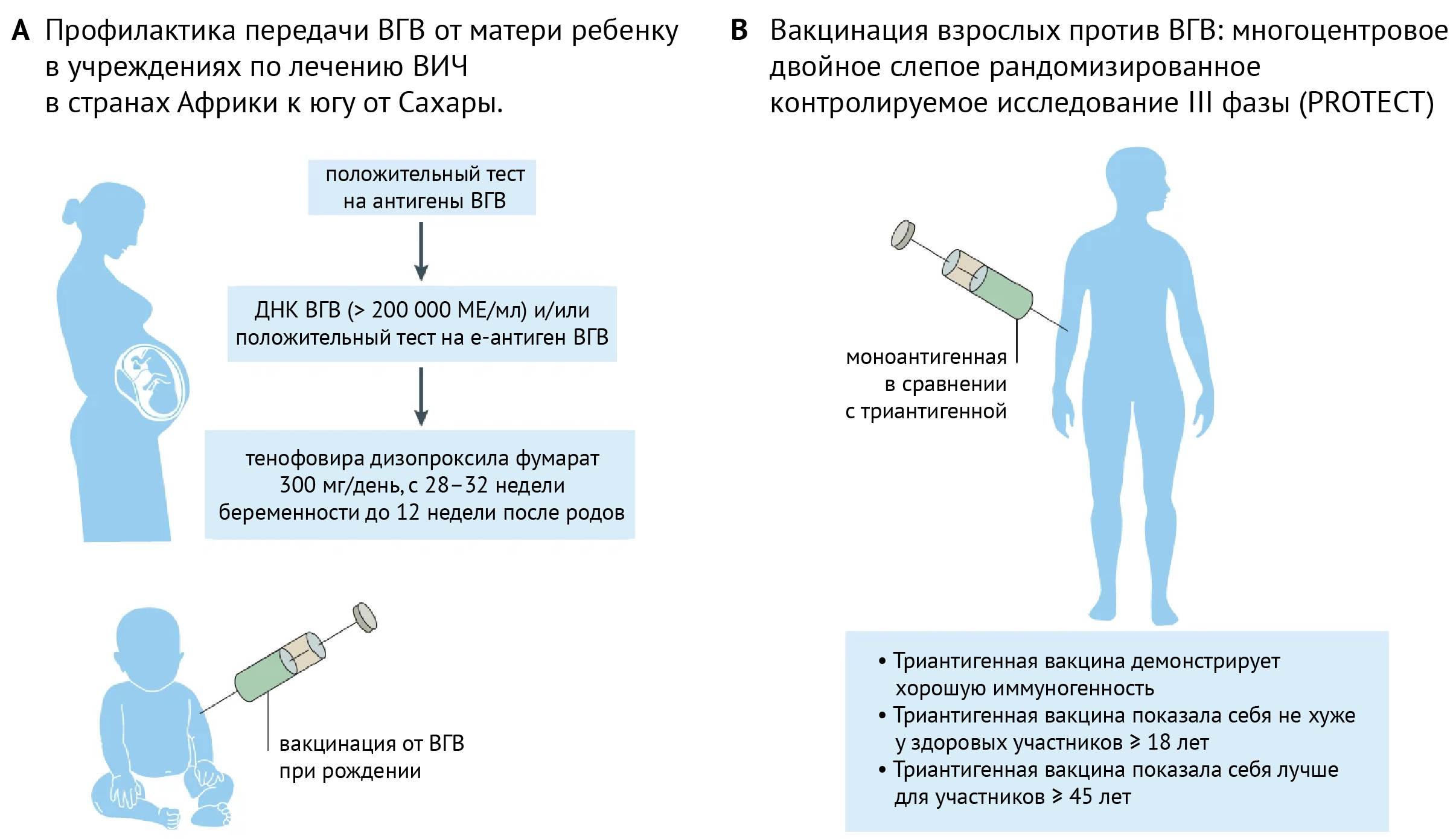
B | Многоцентровое рандомизированное контролируемое исследование (PROTECT) триантигенной рекомбинантной вакцины против ВГВ в сравнении с моноантигенной дрожжевой вакциной с алюминием в качестве адъюванта.
HBeAg, е-антиген гепатита В; HBsAg, поверхностный антиген гепатита В.
Вакцины также необходимы для профилактики ВГС. Несмотря на значительный прогресс в терапии ВГС, связанный с разработкой противовирусных препаратов прямого действия (ПППД), новые случаи инфекции продолжают опережать случаи излечения, что подчеркивает необходимость вакцины против ВГС. Помимо огромного разнообразия ВГС, которое затрудняет разработку вакцины, невероятные сложности связаны и с проведением исследования для оценки эффективности вакцин-кандидатов. Хотя основные результаты первого испытания вакцины против ВГС на людях, опубликованные в 2021 году, были неудачными, следует поздравить Кимберли Пейдж, Андреа Кокс и их коллег, так как они приложили огромные усилия к разработке, проведению и завершению этого исследования.
В качестве подхода для первичной и бустерной вакцинации использовали рекомбинантный вектор аденовируса 3 шимпанзе и модифицированный вирус осповакцины Анкара, экспрессирующие неструктурные белки ВГС. В двойном слепом исследовании фазы I/II 548 человек, ранее не инфицированных ВГС, но употреблявших инъекционные наркотики, были распределены в две группы — вакцинации или плацебо; у них отслеживали случаи инфекции ВГС. В общей сложности 455 участников (228 привитых и 227 в группе плацебо) получили обе дозы. В обеих группах у 14 участников развилась хроническая инфекция ВГС, что свидетельствует об отсутствии эффективной защиты от острой или хронической инфекции с помощью вакцины. Несмотря на то, что результат оказался неуспешным, из этого исследования были извлечены важные выводы. Вакцина была иммуногенной, ее применение приводило к ВГС-специфическим Т-клеточным ответам у 78 % получивших вакцину, по сравнению с 3 % в группе плацебо. Интересно, что средний геометрический пик РНК ВГС после инфицирования был ниже в группе вакцинированных, чем в группе плацебо (152,51×103 МЕ/мл и 1804,93×103 МЕ/мл, соответственно). Вакцина хорошо переносилась без каких-либо побочных эффектов.
Ясно, что создание вакцины против ВГС — очень сложная задача. Несмотря на многообещающие доклинические результаты у шимпанзе и выработку иммунного ответа, который подавлял виремию, вакцина не предотвращала инфекцию и не способствовала спонтанной элиминации вируса. Однако, важнее оказалось то, что это масштабное исследование было проведено на сложной для набора и последующего наблюдения популяции и продлилось шесть лет. Повторение такого рода эксперимента для каждой вакцины-кандидата неосуществимо, что повышает перспективность новых подходов, включая использование модели контролируемой инфекции человека ВГС для быстрого тестирования вакцин-кандидатов. Хотя все еще необходимо преодолеть этические, вирусологические и логистические проблемы, модель контролируемой инфекции человека ВГС может стать важным инструментом для разработки вакцин.
Действительно, данные Hensel с соавт. говорят о значительных иммунологических препятствиях при разработке вакцины. Хронический гепатит С приводит к истощению Т-клеточного звена. Подробные транскриптомные данные, полученные на отдельных клетках, показывают, что клиренс ВГС с помощью ПППД приводит к поляризации ВГС-специфических CD8+ Т-клеток в сторону фенотипа, подобного клеткам памяти, с потерей истощенных CD8+ клеток. Однако профиль клеток, подобных клеткам памяти, не изменился после клиренса, вызванного лечением, и четко отличался от профиля клеток пациентов, которые спонтанно излечились от инфекции, указывая на наличие «иммунологического рубца», несмотря на клиренс вируса. Эти данные свидетельствуют о том, что элиминации антигена недостаточно для устранения иммунологического истощения после установления хронического течения болезни, и это может способствовать раннему лечению во время острой инфекции. Это не только объясняет отсутствие защиты от реинфекции ВГС после излечения хронического ВГС с помощью ПППД, но и вызывает опасения, что вакцинация ранее инфицированных лиц может быть особенно сложной из-за персистенции направленных на ВГС CD8+ Т-клеток, которые размножаются, продуцируя только истощенные клетки. Т-клетки. Эффективная доставка существующих и упрощенных вакцин против ВГВ должна стать глобальным приоритетом. Первое испытание вакцины против ВГС было огромным достижением, но оно лишь подчеркнуло масштабные проблемы, которые еще предстоит решить. Если мы хотим добиться успеха в разработке вакцин, ключевого инструмента для элиминации инфекций, нам необходимо понимание иммунологии и рассмотрение новых подходов, таких как модели контролируемой инфекции человека.
