Нетоз при заживлении ран: когда уже довольно?

Aннотация
Нейтрофильные внеклеточные ловушки (НВЛ, англ. NETs) представляют собой ячеистую сеть хроматина, гистоновых и негистоновых белков, а также микробицидных агентов, которая распространяется за пределы клетки в результате серии событий, затрагивающих ядро и цитоплазму. Эти события в совокупности получили название нетoз. Нетоз, первоначально считавшийся защитным/апоптотическим механизмом, теперь рассматривается как способ защиты в экстремальных ситуациях, который в отдельных случаях оказывает сильные неблагоприятные эффекты на физиологию тканей, усугубляя патологию. Примером может служить опосредованное НВЛ повреждение органов у пациентов с COVID-19. Положительное влияние НВЛ на заживление ран связывают с их антимикробной активностью, в то время как неблагоприятные эффекты чаще встречаются при патологических состояниях (таких как диабет) и связаны с усилением нетoза. Новые данные позволяют предположить, что у НВЛ существуют другие положительные эффекты при заживлении ран, которые заслуживают более глубокого изучения.
Введение
Нейтрофилы, также известные как нейтрофильные гранулоциты или полиморфноядерные лейкоциты (ПЯЛ) — наиболее многочисленные белые кровяные клетки в кровеносном русле человекаа. Они играют ключевую роль во врожденной иммунной защите от бактерий, грибов и вирусов, и они также представляют потенциальную опасность для хозяина.
Нейтрофилы — очень многофункциональные и сложные клетки, способные удлинять свою продолжительность жизни в зависимости от статуса активации и взаимодействия с другими иммунными клетками. В настоящее время считается, что время полужизни нейтрофилов в кровотоке длиннее, чем полагалось ранее (несколько дней в противоположность нескольким часам) [1].
Активация и микробицидная активность нейтрофилов строго контролируются множеством стимулов, и новые данные свидетельствуют, что они довольно многофункциональны. Нейтрофилы могут выполнять неожиданные функции, например, возвращаться в кровяное русло, взаимодействовать с популяциями других лейкоцитов и регулировать их активность [1].
Механизмы противомикробного и цитотоксического действия нейтрофилов включают в себя фагоцитоз, образование активных форм кислорода (АФК), и дегрануляцию ряда микробицидных факторов, таких как α-дефензины, кателицидин, эластаза, катепсин G и лактоферрин. Нейтрофилы также обладают примечательной способностью к de novo биосинтезу хемокинов C-X-C и C-C; провоспалительных, противовоспалительных и иммунорегуляторных цитокинов, а также ангиогенных и фиброгенных факторов и матриксных металлопротеаз [1–4].
Помимо различных реакций, составляющих защитный ответ нейтрофилов, был изучен другой, особый способ уничтожения патогенов с помощью ловушек. В 2004 году Brinkmann с соавт. [5] сообщили о выбросе нейтрофилами ячеистой сети из хроматиновых фибрилл, несущих высвобожденные из гранул антимикробные пептиды и ферменты, способные убивать грамположительные и грамотрицательные бактерии. По способу защитного действия такая ячеистая сеть получила название нейтрофильных внеклеточных ловушек (НВЛ). НВЛ, как было обнаружено, также эффективны в защите организма хозяина от грибов [6], но для защиты от покрытых оболочкой вирусов в них нет необходимости [7].
НВЛ состоят из сильно деконденсированных фибрилл хроматина и имеют диаметр от 15 до 17 нм. Фибриллы образуются из компонентов ядер, сопровождаются гистоновыми белками, а также формируют комплексы с микробицидными глобулярными белками, такими как эластаза, катепсин G и миелопероксидаза, которые в норме запасаются в нейтрофильных гранулах [5, 8].
НВЛ высвобождаются во внеклеточное пространство, где в хроматиновой сети застревают микробы; это ограничивает их распространение и позволяет концентрировать факторы самих нейтрофилов, таким образом усиливая микробицидное действие [9]. Выброс НВЛ представляет собой фундаментальный защитный механизм в тех случаях, когда размер патогенов делает процесс фагоцитоза невозможным [10].
Дальнейший механизм, посредством которого НВЛ проявляют свою микробицидную активность, связан со способностью ДНК индуцировать хелатирование ионов марганца и других. В частности, марганец играет важную роль в пролиферации и выживании микроорганизмов. Совместно с другими бивалентными катионами он используется для транспорта электронов через плазматическую мембрану — этот фундаментальный процесс бактерии используют для получения химической энергии для своей жизнедеятельности [11]. Как следствие хелатирующей активности ДНК в составе НВЛ, ослабление ионного транспорта препятствует выживанию микроорганизмов [12, 13]. Далее было выявлено, что НВЛ не только активно функционируют для элиминации патогенов, но также регулируют местные воспалительные процессы [14, 15].
Изначально формирование НВЛ рассматривали как особый тип клеточной гибели, отличный от апоптоза или некроза (нет активности каспаз, фрагментации ДНК или активации сигналов некротической гибели, характерной для регулируемого варианта некроза — некроптоза) [15], который завершает короткую жизнь активированных нейтрофилов взрывным событием с микробицидными последствиями. В соответствии с такой интерпретацией процесс назвали нетозом [16].
Однако выявление стадий формирования НВЛ недавно привело ученых к пересмотру концепции нетоза (Рисунок 1). Образование НВЛ начинается с растворения ядерной оболочки и высвобождения деконденсированных нитей хроматина в цитоплазму. Затем также исчезают мембраны гранул, что позволяет компонентам гранул и ядра смешиваться; на протяжении этого процесса плазматическая мембрана остается интактной. На заключительном этапе нити хроматина и компоненты гранул выбрасываются в ходе процесса, при котором сохраняется плазматическая мембрана полиморфноядерных клеток (ПЯК) [15]. Даже лишенные ядра, остатки нейтрофилов продолжают свою защитную антимикробную деятельность путем активного фагоцитоза, пусть всего и несколько часов [14, 15, 17].
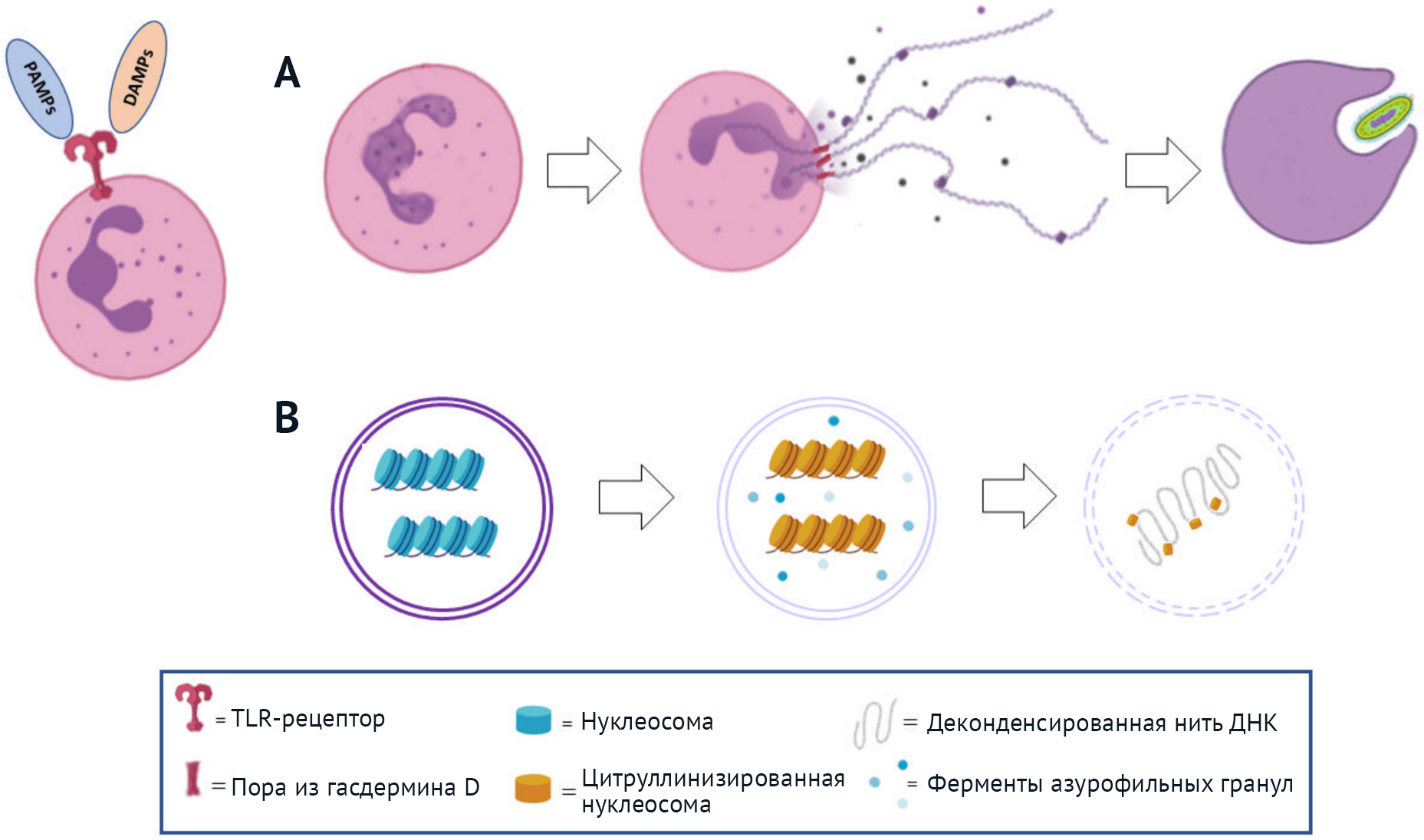
Это последнее наблюдение привело к гипотезе, что данный процесс невозможно должным образом рассматривать как процесс клеточной гибели, поскольку нейтрофилы остаются живыми после экструзии НВЛ. В этом плане нетoз не отличается от других взрывообразных защитных процессов — как, например, тех, в которых задействованы АФК, которые помимо эффективного микробицидного действия также приводят к гибели иммунных клеток [18].
С этой точки зрения некоторые исследователи подвергли критике применение термина «нетoз», предпочитая «формирование НВЛ» [19]. Формирование НВЛ представляется широко распространенным явлением при ответах иммунных клеток; помимо нейтрофилов, как сообщается, и другие иммунные клетки способны к образованию внеклеточных ловушек [20–23], поэтому был предложен более широкий термин «этoз» (от англ. ET — extracellular trap, — прим. перев.) [24].
Нейтрофилы, как и моноциты, работают для поддержания целостности и здоровья организма. Они осуществляют надзор за молекулярными паттернами микробов, известные как молекулярные паттерны, ассоциированные с патогеном (PAMPs), и/или молекулами из поврежденных клеток организма хозяина, которые называют молекулярными паттернами, связанными с повреждением (DAMPs), используя рецепторы распознавания паттернов (PRRs). Распознавание PAMPs и/или DAMPs опосредует активацию ответа иммунной системы. PAMPs представляют собой различные молекулы: компоненты бактериальной клеточной стенки, такие как липополисахариды (ЛПС), пептидогликаны, липотейхоевые кислоты, а также липопротеины клеточной стенки, компоненты жгутика, такие как флагеллин, или β-глюкан, входящий в состав клеточной стенки грибов [25].
DAMPs представляют собой молекулы, продуцируемые клеткой в норме; в отсутствие патологии они остаются внутри клеток. Когда DAMPs выявляются снаружи от клеток вследствие стресса или повреждения, они могут запускать мощную реакцию иммунной системы. К типичным DAMPs относят ядерные белки, в том числе гистоны, АТФ, компоненты митохондрий — такие как митохондриальная ДНК, и мочевая кислота [26, 27]. Когда DAMPs узнаются PRR, такими как toll-подобные рецепторы (TLR), происходит активация ответа иммунной системы. Это позволяет устранить погибшие клетки, которые запускают воспаление, и это необходимо для регенерации тканей [26, 28].
Формирование NET начинается с активации нейтрофилов при распознавании стимула, которое приводит их к сборке и активации НАДФH-оксидазного (NOX) комплекса через путь протеинкиназа C (PKC)/Raf/MERK/ERK, а также через повышение концентрации цитозольного Ca2+ [29, 30].
Бактерии могут запускать продукцию НВЛ путем активации TLR4 [22, 31]. Стимуляция TLR4 запускает путь, основные участники которого — это НАДФН-оксидаза 2 (NOX2) — фермент, вырабатывающий АФК, миелопероксидаза (MPO) и пептидиларгининдеаминаза 4 (PAD4) [32]. После начального стимула до завершения процесса требуется от одного до четырех часов.
В ходе формирования НВЛ теряется разделение хроматина на эу- и гетерохроматин [33]. В этом процессе участвуют ферменты азурофильных гранул, эластаза и миелопероксидаза, которые неизвестным способом перемещаются в ядро на ранних стадиях нетоза. Первой в ядро поступает эластаза; там она расщепляет линкерный гистон H1 и модифицирует коровую часть нуклеосомы [33]. Действие эластазы — это первый фундаментальный лимитирующий фактор при формировании ловушек; у мышей, дефицитных по данному ферменту, выработка НВЛ невозможна [33]. Затем в ядро входит MPO и усиливает деконденсацию хроматина — скорее всего, путем синтеза гипохлорита; у людей с изменениями гена MPO НВЛ не образуются [29, 34].
Еще один фермент, участвующий в этом пути — пептидиларгининдезаминаза 4 (PAD4), которая вызывает дезаминирование остатков аргинина в цитруллин в гистонах H3 и H4 (цитруллинация или деметилирование гистонов), что приводит к ослаблению их связывания с ДНК и деконденсации хроматина [8, 29, 30, 34]. Роль PAD4 в формировании НВЛ изучали в нокаутных мышах, неспособных образовывать НВЛ [8, 29, 35, 36]. Наконец, было доказано, что порообразующий белок гасдермин D участвует в нетозе, обеспечивая выброс ДНК и связанных с ней белков за пределы клетки [30, 37, 38].
Недавно было показано, что в образовании НВЛ участвует НАДФН-зависимая аутофагия [39]. Стимуляция нейтрофилов форболмиристатацетатом (ФМА) приводит к образованию гигантской вакуоли, сходной с аутофагосомой [40, 41]. В регуляции формирования НВЛ задействован и цитоскелет: образование микротрубочек может направлять движение гранул при экзоцитозе и фагоцитозе [42].
Недавно был описан особенно кроткий путь формирования НВЛ, при котором вместо ядерной ДНК выбрасывается ДНК митохондрий. Этот процесс АФК-зависимый, быстрый и происходит в 80 % нейтрофилов в течение 15 минут, следуя за распознаванием C5a или ЛПС [43].
Темная сторона нетoза
Роль нейтрофилов обычно считается полезной для хозяина, но их неадекватная активация может также приводить к повреждению тканей в ходе аутоиммунной реакции или чрезмерного воспаления [44–47] (Рисунок 2).
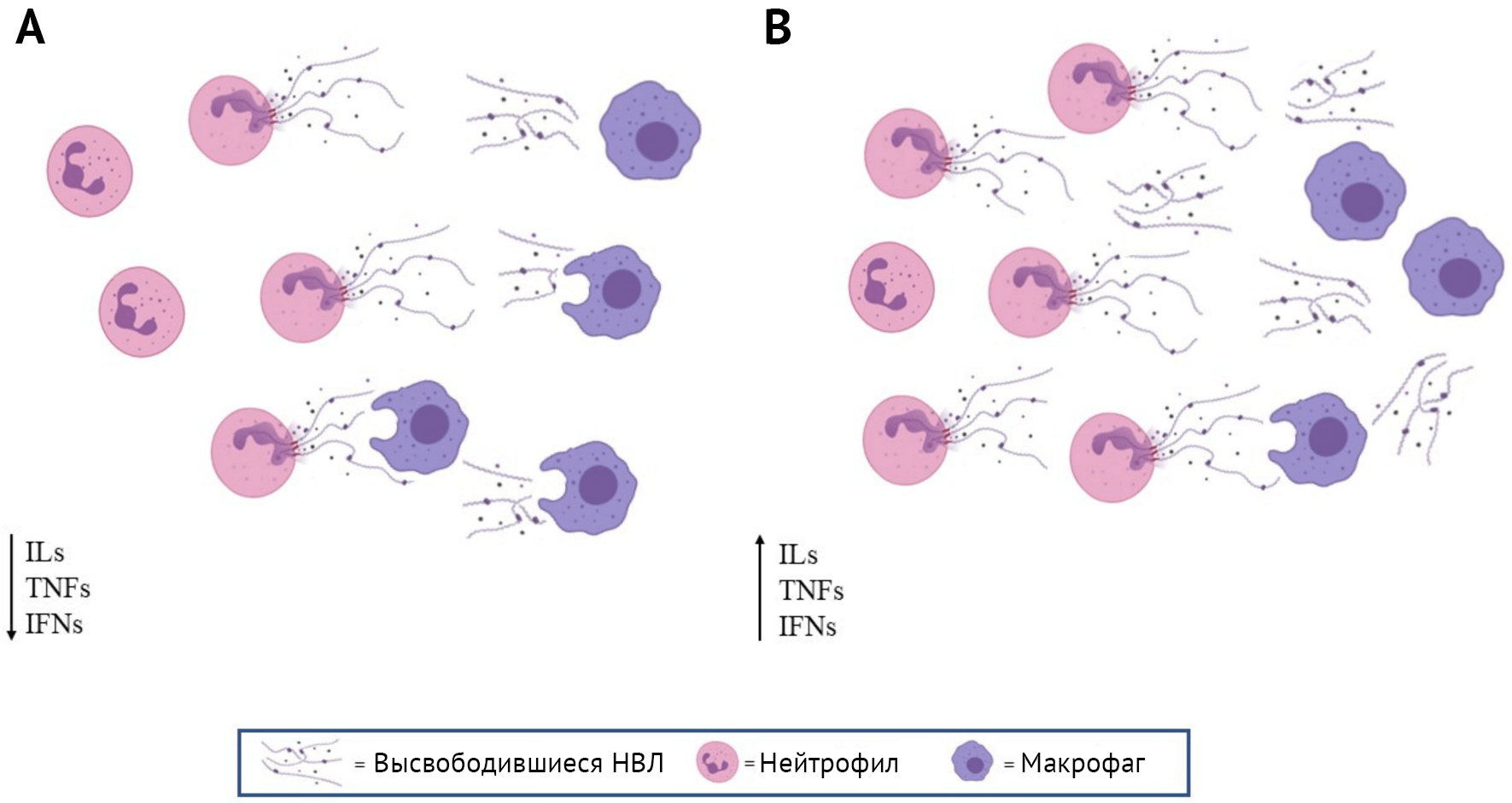
(A) Выброс НВЛ соответствует защитному противомикробному действию, и позже НВЛ устраняются макрофагами; концентрация воспалительных факторов падает.
(В) Базальная или индуцированная экструзия НВЛ усиливается, и макрофаги не могут их эффективно устранить; количество воспалительных факторов возрастает, что приводит к длительному воспалению.
Нейтрофилы участвуют в протекании острых инфекций и воспаления. Чрезмерная активация нейтрофилов может приводить к развитию синдрома полиорганной недостаточности, при котором основной мишенью поражения служат легкие — как, например, при остром повреждении легких (ОПЛ) и более тяжелой его форме — остром респираторном дистресс-синдроме [48].
НВЛ действуют, способствуя дифференциации легочных фибробластов в активные миофибробласты, ответственные за фибротизацию; в биоптате пациентов с фиброзной интерстициальной болезнью легких НВЛ обнаруживаются вблизи от фибробластов, экспрессирующих альфа-гладкомышечный актин (α-SMA) [49].
НВЛ участвуют в хронических воспалительных заболеваниях и болезнях, связанных с возрастом, таких как атеросклероз, псориаз, ревматоидный артрит, воспалительные заболевания кишечника, диабет и злокачественные опухоли [36].
В новообразованиях неоднозначность роли нетоза очевидна, так как НВЛ демонстрируют противоопухолевую активность, но в то же время способны стимулировать опухолевую инвазию [50] и защищать клетки опухолей от активности цитотоксических лимфоцитов [51]. В частности, в модели рака молочной железы у мышей НВЛ способствуют развитию метастазов благодаря белковым факторам, строго ассоциированным с сетью ДНК. Присутствие НВЛ наблюдалось вблизи метастазирующих клеток, а ДНКазная активность блокировала способность клеток к инвазии [52]. Примечательно, что количественный анализ формирования НВЛ был предложен в качестве прогностического биомаркера неоплазии [52–55] или в качестве потенциальной мишени для новых терапевтических подходов с использованием ДНКазы I для устранения эффекта ДНК-сети или же ингибиторов PAD4 [52, 56].
У пациента с диабетом уровень спонтанного нетоза нейтрофилов был повышен, что вызвало значительные изменения в процессе заживления ран [57].
Утверждается, что НВЛ ответственны за аутоиммунный ответ при системной красной волчанке [37, 58, 59]. В экспериментальной модели волчанкоподобного аутоиммунного заболевания у мышей происходило аномальное формирование НВЛ и последующее неконтролируемое высвобождение медиаторов воспаления. Эти события могут замедлять макрофагозависимое ослабление воспаления, что приводит к слишком продолжительному присутствию аутоантигена [60], ответственного за ухудшение состояния при системной красной волчанке [58].
В частности, использование элементов хроматина при формировании НВЛ поставило вопрос, служит ли формирование НВЛ причиной развития некоторых форм аутоиммунных состояний, поскольку собственные антигены становятся доступны для надзора со стороны иммунных клеток [61].
Макрофаги участвуют в устранении НВЛ: макрофаги M1 (провоспалительный тип) и M2 (противовоспалительный и отвечающий за ремоделирование тканей тип) в равной степени участвуют в очистке тканей [62]. Отсроченный клиренс макрофагами может играть важную роль в поддержании факторов, запускающих аутоиммунные реакции [60, 63].
ДНК и гистоны в составе NETs активируют тромбоциты и каскад свертывания крови. НВЛ образуют агрегаты, называемые AгНВЛ, которые служат остовом для эритроцитов и активированных тромбоцитов. В то же время эластаза инактивирует главные ингибиторы свертывания — антитромбин III и ингибитор пути тканевого фактора (TFPI), и дальнейшее образование тромбов в кровеносных сосудах происходит с последующим повреждением легких, сердца и почек [64].
В настоящее время уже найдены молекулы, которые способны противодействовать образованию НВЛ нейтрофилами [65, 66]. Более того, учитывая участие нейтрофилов в свертывании крови, имеет смысл оценить активность нейтрофилов и формирование НВЛ у пациентов с врожденной (например, гемофилия A) или приобретенной (например, синдром диссеминированного внутрисосудистого свертывания) коагулопатией. Таким образом, согласно Barnes с соавт. и Tomar с соавт., разработка новых терапевтических стратегий, направленных на нейтрофилы, таких как ингибирование рекрутирования нейтрофилов или формирования НВЛ, может снизить уровень тромбозов и смертности у пациентов с COVID-19 [67, 68], а также сердечно-сосудистых осложнений, вызванных другими патогенами.
Недавно было предложено, что чрезмерный ответ нейтрофилов и образование НВЛ может участвовать в развитии пневмонии и/или ОРДС при COVID-19 [67, 69], поскольку обширная продукция НВЛ также вызывает острые повреждения сердца и почек, которые часто встречаются у пациентов с тяжелой формой COVID-19 [70].
В случае COVID-19 неконтролируемое и прогрессирующее воспаление вследствие цитокинового шторма вызывается нарушением взаимодействия между макрофагами и нейтрофилами [67]. Нейтрофилия служит предиктором неблагоприятного исхода у пациентов с COVID-19 [71].
В заключение можно сказать, что чрезмерное формирование НВЛ влияет на воспалительный ответ, усугубляя повреждение тканей при патологических состояниях.
Светлая сторона нетoза
Помимо участия НВЛ в противомикробных защитных механизмах некоторые авторы показали, что НВЛ могут играть определенную роль и при разрешении воспаления, как было продемонстрировано для подагрического артрита [72], даже если для полного разрешения данного заболевания этого недостаточно [73, 74].
Рекрутирование нейтрофилов к области воспаления индуцирует высвобождение особой формы НВЛ, называемой агрегированными НВЛ, которые регулируют воспаление путем связывания с провоспалительными цитокинами, такими как IL-1β и IL-6, и их секвестрирования; затем цитокины подвергаются деградации сериновыми протеазами, прикрепленными к сетям [75].
Таким образом, НВЛ также могут выступать в качестве регуляторов воспалительного процесса, поскольку они могут действовать как ключевой компонент в инициации и разрешении воспаления. Про- или противовоспалительный эффект нетoза зависит от качества, количества и длины НВЛ, что подчеркивает новые, замысловатые и сложные механизмы, используемые нейтрофилами для выполнения своей роли в иммунной защите и воспалении [36]. Тем не менее, разнообразие экспериментальных условий, использованных при изучении формирования НВЛ, пока не смогло показать четкую корреляцию между эффектами НВЛ и количеством/качеством сетей [75, 76].
Подводя итоги о темной и светлой сторонах НВЛ, мы сталкиваемся с механизмом, который усиливает микробицидные свойства нейтрофилов и регулирует воспалительный ответ. Нейтрофилы поддерживают баланс между своим про- и противовоспалительной активностью, но в условиях, усиливающих формирование НВЛ, они становятся патогенными [30, 36].
Формирование НВЛ при заживлении ран
При заживлении ран двойственность эффектов НВЛ задокументирована плохо (Рисунок 3). В частности, показано, что усиленный нетоз нарушает заживление ран при множестве патологических состояний [77], включая развитие опухолей кожи [78]. Более того, сообщалось, что у пациентов с диабетом вследствие формирования НВЛ происходит задержка ранозаживления [46, 79].
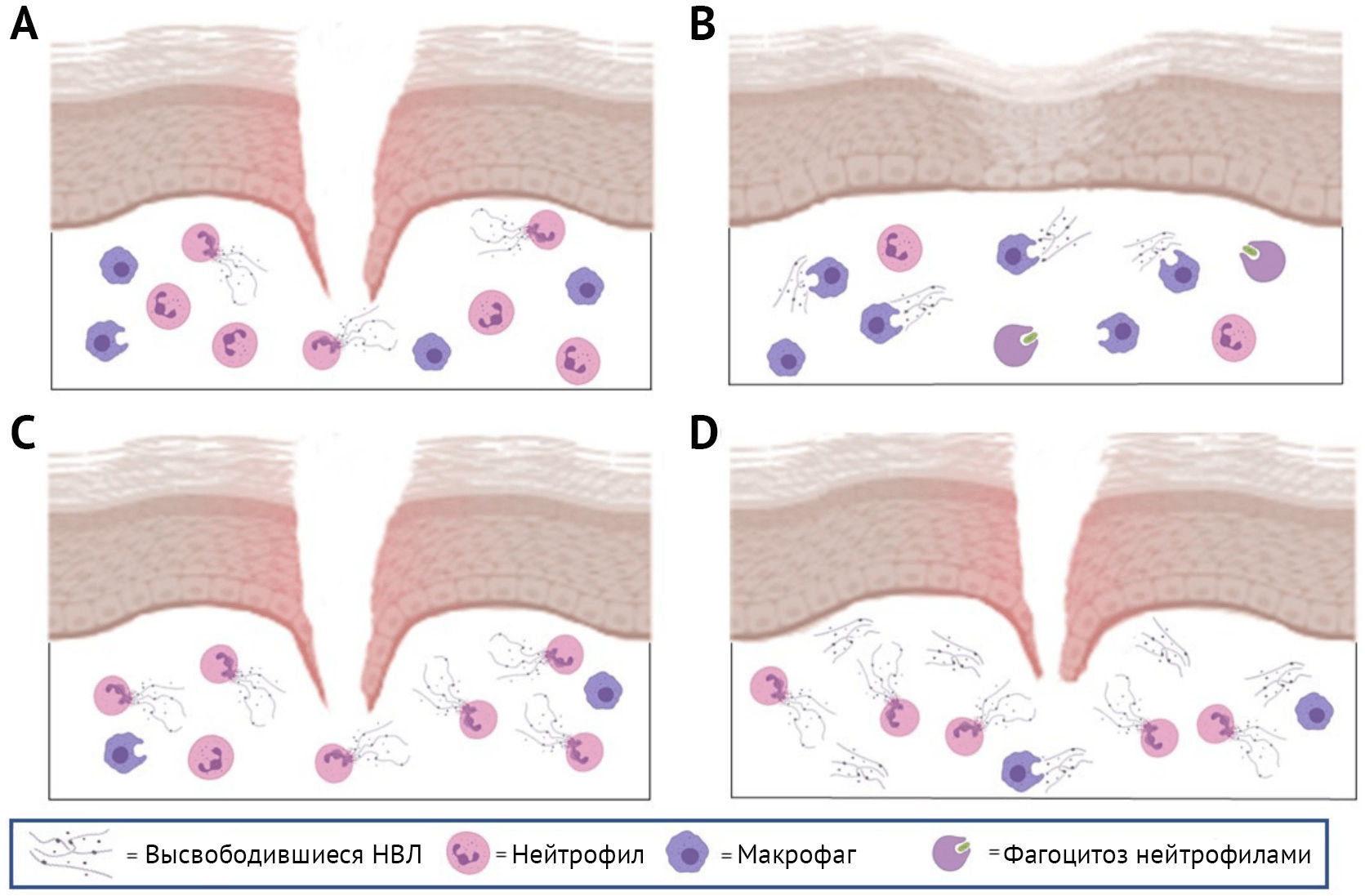
У таких пациентов усиленное формирование НВЛ, опосредованное PAD4, связано с повышенным выделением эластазы, которая отвечает за деградацию внеклеточного матрикса и задержку заживления ран [80–82]. Кроме того, у мышей Padi4−/− с диабетом заживление ран ускоряется [83].
Важность чрезмерной продукции НВЛ в контексте проявления или прогрессирования заболевания получила дальнейшие подтверждения в эффективности лечения диабета метформином. Метформин — хорошо известный лекарственный препарат первой линии для лечения сахарного диабета второго типа, и в дополнение к его недостаточно ясному механизму снижения уровня глюкозы было выявлено, что он способен уменьшать концентрацию компонентов НВЛ путем ингибирования пути PKC/НАДФH-оксидазы, который ответственен за первые метаболические стадии, ведущие к образованию НВЛ [84]. И снова эти результаты подтверждают, что наблюдаемое повреждение ткани, вызванное НВЛ, лишь отражает изменения в их образовании и само по себе не служит проявлением вредоносного механизма защиты.
Нарушения регуляции нетоза также могут быть вызваны хроническим воспалением — механизмом, ответственным за задержку процесса ранозаживления, как было продемонстрировано на пациентах с язвой при диабетической стопе (ЯДС), у которых усилена активность сигнальной оси NLRP3 (NOD-like receptor protein 3)-инфламмасома/НВЛ по сравнению как с контролем, так и с пациентами с диабетом, но без язвы [85, 86]. Таким образом, НВЛ рассматриваются как маркеры нарушения заживления ран у пациентов с язвой при диабетической стопе [87].
Модель нарушения регуляции нетoза, вызывающего хроническое воспаление, хорошо проявляется на примере псориаза. Патогенез псориаза зависит от уровней IL-17 и IL-23, и для контроля заболевания используются препараты, действие которых направлено на эти цитокины [88]. Эффективность данного способа лечения связывают с подавлением выработки IL-17 определенным подтипом Т-лимфоцитов (называемыми Th17) и блокированием их распространения, которое вызывается IL-23, IL-21 и IL-1β [89–92]. Однако основными источниками IL-17 в коже и при псориазе служат тучные клетки и нейтрофилы. В частности, IL-17 выделяется при формировании нейтрофилами внеклеточных ловушек, в то время как IL-23 и IL-1β участвуют в дегрануляции и создании внеклеточных ловушек тучными клетками [22, 37].
О другом процессе, который опосредуется IL-17, сообщают Frangou с соавт. Остов НВЛ, декорированный тканевым фактором (TF) и интерлейкином-17A (IL-17A), участвует в развитии тромбовоспаления и фиброза легких у пациентов с системной красной волчанкой (СКВ) [93]. IL-17A — провоспалительный цитокин, который связан с усилением и распространением фиброзного процесса в нескольких различных тканях, включая легкие, кожу, печень и другие, но не затрагивает почки [94]. У пациентов с СКВ НВЛ, которые образуются вследствие нарушения механизмов аутофагии, обогащены белками TF и IL-17A, оба из которых активно функционируют: TF вызывают образование тромбина, а IL-17A способствует отложению коллагена [93].
Помимо влияния НВЛ на внеклеточный матрикс и иммунный ответ были изучены их прямые эффекты на клеточные популяции, участвующие в заживлении ран. Так, при воспалении в ходе ОПЛ/ОРДС НВЛ индуцируют поляризацию провоспалительных макрофагов M1 [48], в то время как в диабетических ранах НВЛ повышают экспрессию NLRP3 и уровни про-IL-1β в макрофагах через сигнальный путь TLR-4/TLR-9/NF-κB, поддерживая местную воспалительную реакцию [85].
НВЛ усиливают экспрессию факторов роста соединительной ткани, продукцию коллагена и пролиферацию/миграцию фибробластов, экспрессирующих α-SMA [49], и были обнаружены в непосредственной близости от этой клеточной популяции в биоптате пациентов с рубцовой тканью кожи [49].
Стоит отметить, что воздействие НВЛ на эндотелиальные клетки (ЭК) и ангиогенез при заживлении ран не изучались детально. Единственный источник информации о взаимодействии между эндотелиоцитами и НВЛ — исследования патофизиологии атеросклероза [95] или других сосудистых заболеваний. Высокие уровни НВЛ вызывают гибель эндотелиальных клеток при васкулите [96] и эндотелиально-мезенхимный переход при волчаночном нефрите [97]. Так или иначе, НВЛ способны индуцировать пролиферацию, дестабилизировать межклеточные контакты и повышать уровень подвижности ЭК, a также усиливать ангиогенез in vitro через TLR4 [98]. Интересно отметить, что концентрации НВЛ, способные стимулировать ангиогенез, измерены не были.
При заживлении ран ключевую роль в ходе начального защитного процесса играют кератиноциты, рекрутирующие нейтрофилы, макрофаги и другие лейкоциты и, таким образом, они необходимы для процесса восстановления. На своей поверхности кератиноциты экспрессируют различные типы TLR [99, 100]. При этом, по-видимому, TLR4 участвует в остром заживлении ран, поскольку блокада TLR4 задерживает миграцию нормальных первичных эпидермальных кератиноцитов человека (NHEK) и препятствует фосфорилированию p38 и JNK/MAPK, а также выработке IL-1β [101]. На поверхности клеток находятся внешние TLR1, TLR2, TLR4, TLR5, и TLR6; они узнают лиганды преимущественно бактериального и грибного происхождения. Внутриклеточные члены семейства TLR (TLR3, TLR7, TLR8 и TLR9) локализованы в эндосомах, где их главной функцией является обнаружение микробных и эндогенных нуклеиновых кислот [100]. Недавно в различных исследованиях с участием людей и на моделях у грызунов было показано, что эндосомные TLR, по-видимому, вносят вклад в процесс воспаления [102, 103].
TLR9 распознает неметилированные остатки CpG в ДНК, поглощенной путем эндоцитоза, и связывается с ними [104]. Затем внешний домен TLR9 расщепляется с образованием функционального рецептора для рекрутирования адаптерных молекул и активации NF-κB или интерферона (IFN) [103]. Протеолитическое расщепление TLR9 служит предпосылкой для его активации, так как после протеолиза один из фрагментов связывается с Myd88 и активирует нижележащие сигнальные молекулы в различных типах клеток [103]. TLR9 у человека экспрессируется некоторыми подтипами B-лимфоцитов и дендритными клетками; он участвует как в местном, так и в системном воспалении [105]. Более того, рецептор TLR9 вовлечен в интернализацию двуцепочечной ДНК макрофагами при ее везикулярном захвате [106]. TLR9 экспрессируется и кератиноцитами, а его активация стимулирует INF I типа [100]. При псориазе усиление ответа TLR9 вызывает выработку больших количеств IFN-β, характеризующих псориатическое поражение [107].
НВЛ также могут иметь положительное стимулирующее значение в процессе ранозаживления, хотя данный вопрос только начинают исследовать. НВЛ воздействуют на кератиноциты благодаря интернализации двуцепочечной ДНК рецепторами TLR9, что вызывает NF-κB-зависимую пролиферацию кератиноцитов [108], на которую также влияет концентрация НВЛ. Низкие или высокие концентрации НВЛ оказывают противоположное действие на заживление ран in vitro [108]; в первом случае пролиферация кератиноцитов усиливается. Такой эффект по отношению к пролиферации кератиноцитов и заживлениею ран in vitro, зависящий от концентрации НВЛ, значительно ослаблен у пожилых людей (старше 65 лет). Более того, нейтрофилы пожилых лиц, стимулированные ЛПС, продуцируют НВЛ в более высоких концентрациях, нежели нейтрофилы взрослых (20–40 лет), но такие НВЛ обладали менее выраженными бактерицидными свойствами и слабее способствовали пролиферации кератиноцитов (Sabbatini с соавт., неопубликованные данные).
Эти результаты противоречат данным, полученным Tseng с соавт. на модели инфекции золотистым стафилококком (Staphylococcus aureus) у мышей, в которой в нейтрофилах, полученных из старых животных, выработка НВЛ была снижена по сравнению с таковой нейтрофилами молодых [109], в то время как у людей с возрастом наблюдалось уменьшение формирования НВЛ, вызванного IL-8 и ЛПС [110].
Различные результаты по крайней мере отчасти можно объяснить различиями в экспериментальных моделях и способах стимуляции нейтрофилов. Более того, НВЛ пожилых людей содержат более крупные фрагменты ДНК по сравнению с НВЛ молодых людей (Sabbatini с соавт., неопубликованные данные), а крупные фрагменты ДНК менее эффективно хелатируют ионы — это свойство является ключевым для антимикробного действия [111].
Более того, крупные фрагменты ДНК менее эффективны при взаимодействии с TLR9 и его активации [112], что объясняет отсутствие НВЛ-индуцированной пролиферации кератиноцитов. Наконец, в мышиной модели нетoз/активность PAD4 усиливались с возрастом; а PAD4/НВЛ участвуют в развитии фиброза органов, связанного со старением [80].
Неоднозначность продукции НВЛ становится особенно явной при сравнении неэффективной противомикробной защиты и процесса заживления ран у пациентов с диабетом.
Известно, пациенты с сахарным диабетом второго типа (СД2) подвергаются повышенному риску инфекций и нарушения ранозаживления, что отчасти связано с отложенным выбросом короткоживущих НВЛ [57, 113]. У пациентов с СД2 НВЛ несут небольшое количество кателицидина (LL-37), который обладает слабым противомикробным действием — возможно, вследствие дефектов остова внеклеточных нитей НВЛ, вызванных постоянной гипергликемией.
При лечении пациентов макролидом кларитромицином антибактериальные свойства восстанавливаются благодаря повышению экспрессии LL-37 в НВЛ [114]. В то же время благодаря активации и дифференцировке фибробластов кожи улучшается заживление ран [114]. Эти данные указывают на положительную физиологическую роль НВЛ в ранозаживлении помимо их защитного противомикробного действия. Однако физиологическое значение НВЛ при заживлении ран остается слабо изученным.
Заключение
Формирование НВЛ представляет собой физиологический ответ нейтрофилов, который сдерживает внедрение внешних агентов в ткани и регулирует воспаление.
Этот процесс хорошо разрешается и требует сбалансированного устранения НВЛ с помощью макрофагов, но при высоком уровне спонтанного или индуцированного нетоза могут проявиться и его негативные эффекты, поскольку НВЛ могут способствовать развитию хронического воспаления, нарушать заживление ран и вызывать повреждение тканей и органную недостаточность.
Тем не менее, сведения о благоприятных эффектах НВЛ помимо их противомикробных свойств многообещающие. В будущем НВЛ могут стать полезным терапевтическим инструментом.
