Органоиды человеческого мозга влияют на поведение крыс

В условиях in vitro из стволовых клеток можно вырастить ткань, напоминающую кору человеческого головного мозга. Путем пересадки такой ткани в мозг крысы, развивающийся в ходе эмбриогенеза, можно добиться созревания и интеграции этой ткани в нейронные цепи мозга животного и, таким образом, повлиять на его поведение.
Ученых по всему миру охватил настоящий восторг, когда впервые удалось вырастить сложную трехмерную нервную ткань из плюрипотентных стволовых клеток, полученных из образцов кожи [1, 2]. Такие зачаточные образования in vitro, или органоиды (англ. organoid — подобный органу), открыли новую эпоху в исследованиях человеческого мозга [3, 4]. Сейчас существуют протоколы создания органоидов, напоминающих многие участки мозга [5], однако главное препятствие на этом пути — это невозможность правильного созревания нервной ткани органоидов в условиях in vitro. Revah с соавт. [6] сообщают, что им удалось преодолеть это ограничение путем трансплантации ткани в развивающуюся кору головного мозга крысы. Особенно важно, что пересаженная человеческая нервная ткань повлияла на поведение животного — это открывает новое «непаханое поле» для изучения эмбрионального и филогенетического развития человеческого мозга и его заболеваний.
Зрелый человеческий мозг чрезвычайно сложно устроен, поэтому технологии выращивания органоидов нервной ткани необходимо усовершенствовать настолько, чтобы стало возможно исследовать нейронные цепи и поведение, опосредованное ими. Но в условиях in vitro это пока невозможно, поскольку органоид человеческого мозга — лишь модель, никак не связанная с иными частями полноценного организма, которыми можно управлять. Пересадка животным человеческих клеток на разных стадиях эмбриогенеза и органоидов, или ксенотрансплантация — возможное решение данной проблемы: жизнедеятельность созревающих клеток и тканей поддерживается физиологическими системами. Благодаря этой методике стало возможным клеточное и морфологическое созревание человеческих кишечных органоидов у грызунов-реципиентов, которое почти полностью соответствовало нормальному эмбриональному развитию [7,8]. Также удалось показать, что в мозге грызунов клетки-предшественники нервной ткани человека могут созревать и устанавливать нейронные связи между человеческими клетками и клетками животного, при этом сохраняя специфические для человека признаки [9,10]. Кроме того, трансплантация неповрежденных сложных кортикальных органоидов человека в мозг взрослой мыши обеспечила васкуляризацию органоидов (это усилило приток питательных веществ) и их инфильтрацию микроглиоцитами, которые специфичны для головного мозга, но обычно не присутствуют в органоидах [11].
Эти исследования показывают, что функциональные связи между человеческими нейронами и нейронами животного-реципиента могут образовываться в условиях in vivo, что дает возможность изучать функционирование зрелых нейронов и поведение. Однако пересадка развивающейся нервной ткани в зрелый мозг представляет явную проблему хронологической несостыковки, потому что во взрослом организме нейронные цепи уже сформированы. У нейронов, «опоздавших на вечеринку», могут возникнуть проблемы с встраиванием в уже существующие цепи до той степени, которая позволяет регулировать поведение. Напротив, ксенотрансплантация развивающейся нейрональной ткани человека в мозг молодой крысы может позволить человеческим нейронам встроиться в цепи по мере их формирования.
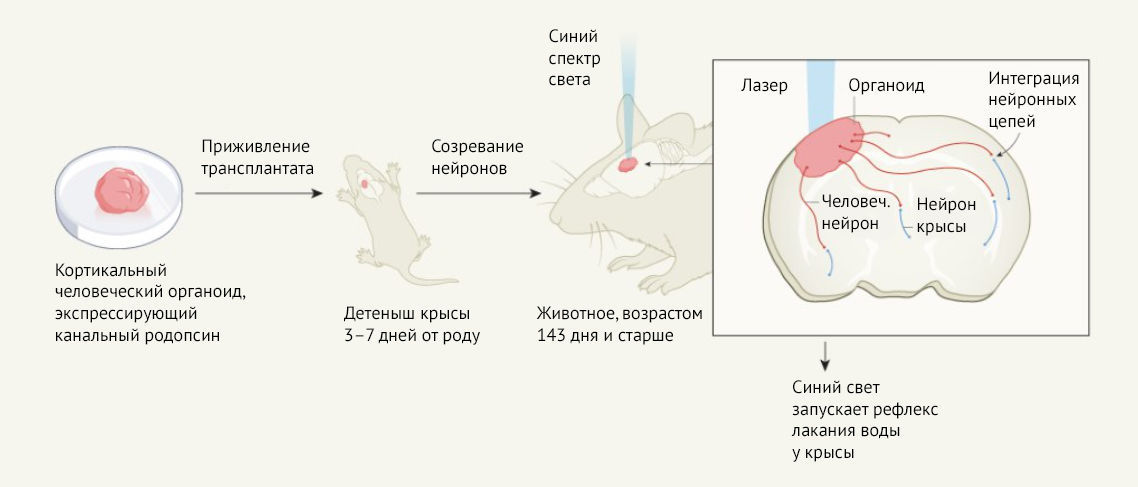
Revah с соавт. сфокусировались на дифференцировке человеческих стволовых клеток в развивающейся ткани коры головного мозга. Затем ученые пересадили человеческие органоиды в кору молодых иммунодефицитных крыс, благодаря чему пересаженная человеческая ткань не будет отвергнута организмом-реципиентом. Авторы отмечают, что для ксенотрансплантации они выбрали такой момент в эмбриологическом развитии, при котором нейронные цепи головного мозга еще не полностью сформированы, что дает время для развития человеческих нейронов и взаимодействия с развивающимися нейронами организма-реципиента. Эффективность приживления трансплантируемых органоидов оказалась высокой (более 80 %), как и выживаемость организма-реципиента спустя год (более 70 %).
Исследователи обнаружили, что архитектура тканей в пересаженном органоиде неточно воспроизводит план строения нормального человеческого мозга. Например, у органоидов не выявлялась многоуровневая структура, наблюдаемая в коре головного мозга человека, и отсутствовали некоторые типы клеток. Тем не менее, нейроны в органоидах оказались намного крупнее, обладали более сложной структурой связей, чем обычно наблюдается у органоидов в культуре клеток. В ходе измерения экспрессии генов было подтверждено ускоренное созревание, по сравнению с аналогичными органоидами, существующими в условиях in vitro.
Далее, Revah с соавт. применили созданную ими же систему для изучения последствий генетических мутаций, связанных с заболеванием, на зрелых нейронах. Авторы вырастили органоиды ткани коры из стволовых клеток пациентов с синдромом Тимоти — заболевания, неврологические симптомы которого обусловлены мутацией гена, кодирующего белок кальциевого канала Cav1.2. Этот белок, который модулирует электрический потенциал мембраны клетки, ответственен за различное функционирование клеток. Авторы обнаружили, что нейроны из таких органоидов обладали менее сложной морфологией, чем пересаженные нейроны из контрольных органоидов, а также различными синаптическими связями с другими нейронами и модифицированной электрической активностью. Поэтому особенности синдрома Тимоти можно исследовать на примере зрелых пересаженных тканей.
Возможно, самое главное достижение этого исследования состоит в демонстрации того, что аксоны нейронов человеческих органоидов проникают в толщу тканей мозга крысы и формируют синапсы с нейронами ее мозга. Кроме того, как удалось показать Revah с соавт. с помощью оптогенетики, нейроны человеческих органоидов могут оказывать влияние на поведение животных. Суть оптогенетики в том, что нейроны генетически модифицированы для экспрессии светочувствительных белков — канальных родопсинов. Синий спектр света активирует эти белки и, таким образом, активирует нейрон, экспрессирующий эти белки. Авторы использовали эту методику для стимуляции человеческих нейронов, пересаженных крысам, которые были обучены облизывать носик поилки, чтобы получить награду в виде воды. Они обнаружили, что стимуляция нейронов побуждало крысу лизать поилку, тогда как красный спектр света или же воздействие синего света на крыс, которым не были пересажены органоиды, не приводили к подобному эффекту. Таким образом, нейроны человеческих органоидов участвуют в процессе обучения крыс по принципу «вознаграждение-реакция» (рис. 1).
Нейроны человека отличаются от нейронов других видов позвоночных животных, и различия в скорости, с которой развиваются крысиные и человеческие нейроны, ограничивают то, насколько хорошо ксенотрансплантаты, пересаженные от человека грызуну, могут отражать работу человеческого мозга. Тем не менее способность формировать зрелые нервные ткани человека после пересадки органоида, интегрированные с организмом животного на уровне нейронных цепей, предоставляет интересные возможности для изучения эмбриогенеза и основ биологии нейронных цепей человека. Также это представляет новую систему для испытания терапевтических методов для лечения неврологических заболеваний человека.
В будущем исследования могут быть сосредоточены на том, чтобы пересаживать другие части мозга человека в развивающийся мозг крысы (например, ткани коры или полосатого тела), для формирования более сложных нейронных цепей, подобных человеческим. Однако по мере планирования таких экспериментов возникают важные этические вопросы, например, связанные с тем, как следует контролировать такие исследования, как осуществлять контроль получения человеческих биоматериалов, а также вопрос согласия донора. Другие аспекты, которые следует принять во внимание: способны ли такие исследования привести к появлению новых методов терапии для заболеваний человека, и каковы преимущества работы с органоидами с точки зрения снижения общего количества исследований на животных, необходимых для создания терапевтических методов. Наконец, важным вопросом остается, сможет ли органоид иметь сознание и моральный статус? Чтобы разработать рамки и границы научных исследований, посвященных органоидам, и моделирующих работу нейронных цепей мозга человека, необходимо активное сотрудничество между исследователями, специалистами по биоэтике, регулирующими структурами и общественностью [12,13].
