Обратная транскриптаза митохондриальной теломеразы — новая мишень в патогенезе сердечно-сосудистых заболеваний
Взгляд на статью «Неклассическая роль теломеразы в регуляции окислительно-восстановительного состояния клеток микрососудов в контексте ишемической болезни сердца»
Эндотелиальная дисфункция — это неспособность эндотелиоцитов сосудов осуществлять свои нормальные биологические функции. Дисфункцию связывают с развитием сердечно-сосудистых заболеваний, например, ишемической болезни сердца и артериальной гипертонии. Оксид азота (NO) — основной медиатор эндотелия, который оказывает противовоспалительное и антиоксидантное действие. Он снижает степень выраженности патологий эндотелия и гладкой мускулатуры сосудов, которые связаны с сердечно-сосудистыми заболеваниями [1]. Другим важным медиатором вазодилатации, помимо NO и простациклина, является эндотелиальный фактор гиперполяризации (EDHF — от англ. endothelium-derived hyperpolarizing factor). В нормальных условиях кровообращения, когда NO действует как основной вазодилататор, EDHF играет лишь небольшую роль в расширении сосудов, связанной с ауторегуляторной способностью коронарных артерий. EDHF (аналогом которого является H2O2) действует как компенсаторный механизм в случае резкого снижения выработки NO для поддержания сосудорасширяющей реакции. Соответственно, во время постишемического реперфузионного повреждения коронарного кровотока H2O2 вырабатывается для защиты от дальнейшего повреждения миокарда. Таким образом, наличие коронарных факторов риска или непосредственно заболевания коронарных артерий увеличивает степень влияния H2O2 на механизм поток-опосредованной дилатации (ПОД) [2]. Хотя этот дилатационный механизм играет важную роль в поддержании перфузии миокарда при снижении синтеза NO, он также открывает путь воспалительному влиянию H2O2 на сосуды, которые уже находятся в состоянии дисфункции.
Теломераза состоит из теломеразного РНК-компонента (TERC) и обратной транскриптазы теломеразы (TERT) — каталитического компонента. Этот фермент ответственен за поддержание и увеличение длины теломер. С каждым эпизодом клеточного деления длина теломер постепенно укорачивается, а при уменьшении до критической длины клетка стареет, после чего — переходит к апоптозу. Известно, что помимо «хронологического» старения, некоторые стрессоры окружающей среды способны раньше положенного вызывать укорочение теломер и клеточное старение (рис. 1, левая часть).
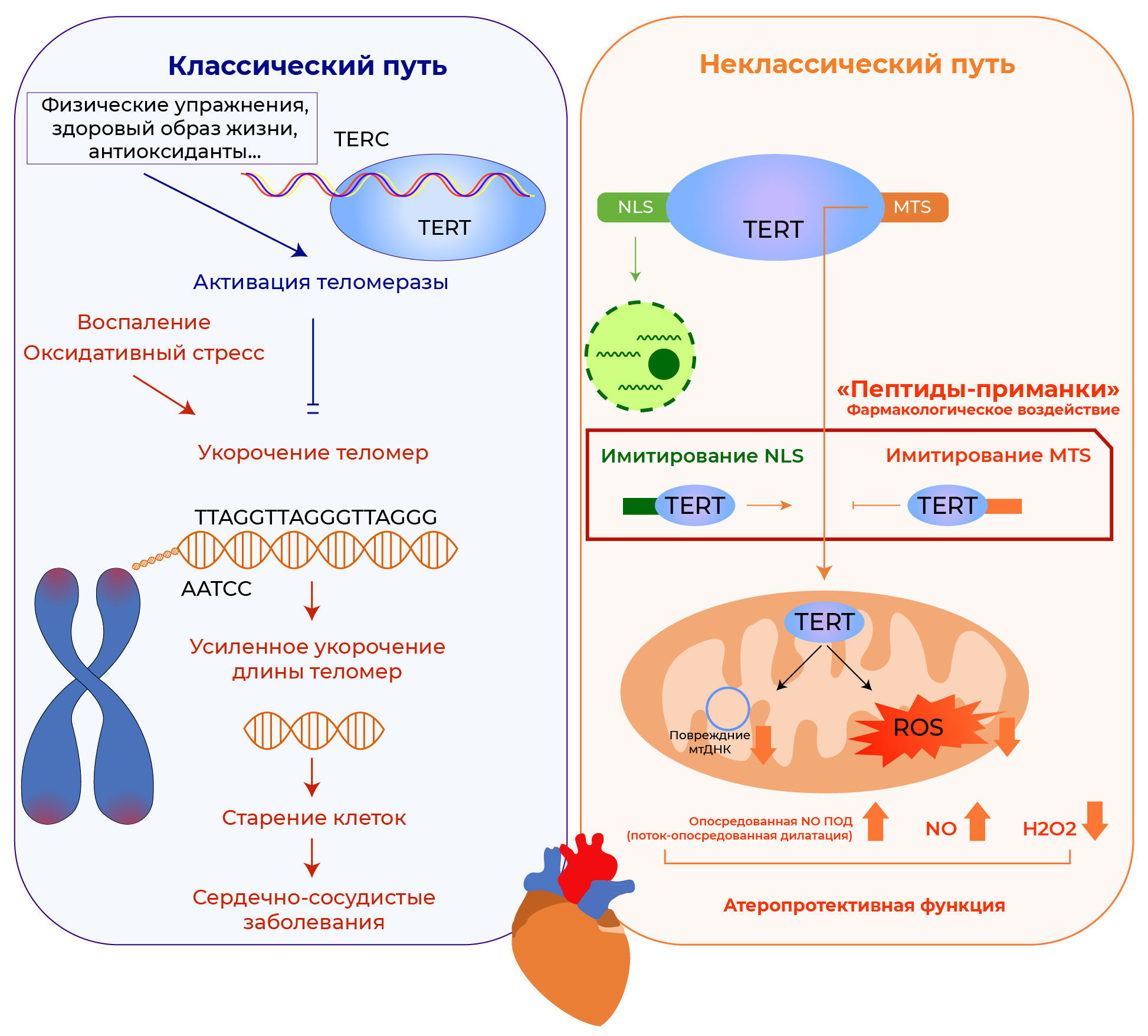
NLS — целевая ядерная последовательность;
MTS — митохондриальная целевая последовательность;
NO — оксид азота;
мтДНК — митохондриальная ДНК;
АФК — активные формы кислорода;
H2O2 — перекись водорода.
Установлено, что такие факторы риска сердечно-сосудистых заболеваний, как курение, гиподинамия, ожирение и гипертония, связаны с более короткими теломерами [3]. Теломеры нокаутных по TERT мышей оказались укорочены, а также у них наблюдались возрастные патологические состояния [4]. Помимо своей основной роли в поддержании гомеостаза теломер, были открыты и другие функции TERT. Интересно, что у мышей с дефицитом TERT в первом поколении физические нагрузки не защищали от индуцированного доксорубицином апоптоза клеток сосудов. У этих грызунов присутствует дефицит активности теломеразы, однако длина теломер в норме. Это указывает на то, что для положительного эффекта физических упражнений на сердечно-сосудистую систему требуется функционирование TERT по неклассическому пути [5, 6]. Аналогичным образом, неклассическое функционирование TERT необходимо для сохранения эндотелиоцитов и их функций, а также для защиты от сосудистого стресса, индуктором которого является ангиотензин II [7]. Помимо локализации в ядре, TERT также расположена в митохондриях, взаимодействуя с ее ДНК и защищая от повреждений [3]. Таким образом, митохондриальная TERT обеспечивает сохранение способности этих органелл к тканевому дыханию и снижает в них количество активных форм кислорода. Неизвестно, какая фракция TERT участвует в вышеупомянутой защите эндотелия: ядерная или митохондриальная. Кроме того, было крайне трудно различить перекрывающие друг друга функции TERT в ядре и митохондриях. Предыдущие исследования проводились на моделях мышей и культурах клеток с дефицитом TERT или после экспрессии мутантных форм TERT. Эти мутантные формы специфичны для определенных клеточных органелл с сохраненной экспрессией эндогенной формы белка.
В настоящем исследовании в качестве экспериментальной модели использовались сосуды пациентов с ишемической болезнью сердца. Ait-Aissa с соавт. продемонстрировали, что увеличение митохондриальной TERT восстанавливает физиологические механизмы ПОД, тогда как ядерная TERT способствует патологической, опосредованной H2O2, клеточной пролиферации [8]. Авторы презентовали новый «пептид-приманку», который может управлять внутриклеточной локализацией TERT, и показали, что патологическая вазодилатация у пациентов с ишемической болезнью сердца может быть восстановлена до физиологических значений. «Пептиды-приманки» — это фармакологические средства для разделения эффектов ядерной и митохондриальной фракций TERТ, а также потенциально новая терапевтическая мишень для митохондриальной фракции (рис. 1, правая панель). Эти результаты согласуются с результатами предыдущего исследования, где использовались мышиные модели, у которых TERT содержалась только в ядре или только в митохондриях. Таким образом, митохондриальная фракция TERT важна для защиты сердца от ишемически-реперфузионного повреждения [3].
Хотя регуляция транскрипции человеческой TERT (hTERT) уже тщательно изучена, много вопросов остается в регуляции посредством процессинга мРНК. Было обнаружено более 20 вариантов транскрипции hTERT, при этом два наиболее изученных вариантов альтернативного сплайсинга TERT происходили в α- и β-сайтах. Интересно, что сверхэкспрессия β-делеции конкурирует с теломеразной РНК и ингибирует эндогенную теломеразную активность [9]. Сверхэкспрессированные белки β-делеции также локализуются в ядре и митохондриях. В настоящем исследовании авторы показали, что у пациентов в сосудах сердца повышается уровень [экспрессии генов] вариантов TERT с α- и β-делецией, а степень экспрессии полноразмерной мРНК TERT — снижается. Было продемонстрировано, что усиленная β-делеция TERT изменяет функцию эндотелия микрососудов в сторону патологической вазодилатации, в то время как ее подавление приводит к физиологически нормальной вазодилатации. Однако связь между β-делецией TERT и функцией митохондрий остается не до конца ясной. Кроме того, углубленное изучение этих вариантов сплайсинга TERT может открыть новые терапевтические мишени для лечения сердечно-сосудистых заболеваний.
Сигнальные пути, инициирующие опосредованную потоком функцию эндотелия, различаются у разных биологических видов и тканей, и в первую очередь распознаются мембранным гликокаликсом, механочувствительными ионными каналами и фокальными межклеточными контактами [10]. Вторичные эффекторные пути включают протеинкиназы, которые активируют эндотелиальную-NO-синтазу и другие вазоактивные медиаторы [10]. В настоящем исследовании доказывается, что митохондриальная фракция TERT участвует в этих путях и регулирует переключение сосудорасширяющих медиаторов. Хотя в эти механизмы вовлечены митохондриальные активные формы кислорода, точно описать все нюансы пока трудно. В будущем необходимы дальнейшие исследования для выяснения механизмов, с помощью которых внутриклеточное распределение TERT и вариантов сплайсинга этого фермента модулирует функцию эндотелия микрососудов, включая различия в сигнальных путях и взаимосвязь между антиоксидантной системой и метаболизмом митохондрий.
