Клиническое значение кишечного микобиома в норме и при патологии

Аннотация
Микобиом (совокупность грибкового населения кишечника) — небольшой, но важный компонент кишечного микробиома человека. Кишечные грибки регулируют гомеостаз хозяина, патофизиологические и физиологические процессы и состав соседствующего бактериального микробиома. За последнее десятилетие накопились исследования, характеризующие кишечный микобиом в норме и в условиях патологии. В настоящем обзоре авторы рассматривают разнообразие состава и функций кишечного микобиома в здоровой популяции от рождения и до взрослого возраста. Они описывают факторы, влияющие на кишечный микобиом, и роль кишечных грибов, особенно Candida и Saccharomyces spp, при заболеваниях и их лечении, уделяя особое внимание их синергизму с бактериальным микробиомом кишечника и иммунитетом хозяина. Наконец, авторы обсуждают недооцененные эффекты кишечных грибков в клинической практике и концентрируются на будущих терапевтических методах, задействующих грибки и учитывающих трехстороннюю связь между кишечным микобиомом, бактериальным микробиомом и иммунитетом хозяина, цель которых — восстановить основной кишечный микобиом и микробиом, а также улучшить клиническую эффективность.
Введение
Помимо бактерий и вирусов, желудочно-кишечный тракт человека служит домом для большого числа грибков, составляющих 0,1% от общего количества микроорганизмов и играющих ключевую роль в поддержании кишечного гомеостаза человека и патогенезе заболеваний [1, 2]. Благодаря прогрессу технологий глубокого секвенирования (таблица 1) [13] и культивирования микроорганизмов, в последнее десятилетие продолжает описываться большое разнообразие грибков в кишечнике человека, в том числе ключевые виды, имеющие фундаментальное значение для здоровья человека или связанные с началом или прогрессией заболеваний. Дисбиоз (т. е. нарушение баланса в составе микробного сообщества, включающее утрату симбионтов, избыточный рост патобионтов или оппортунистов и нарушение конкуренции между микроорганизмами и их разнообразия) кишечной микобиоты вовлечен в развитие ряда заболеваний, включая аутоиммунные [14–16], метаболические [17, 18] и неврологические расстройства [19, 20] и злокачественные новообразования [21]. Колонизация кишечника оппортунистическими грибковыми патогенами и их рост могут вызывать нарушения иммунных реакций хозяина, влияя таким образом на течение заболевания [22, 23]. Кроме того, кишечные грибки — в частности, Candida spp — сложным образом влияют на состав и функцию бактериального микробиома кишечника (другого ключевого регулятора физиологии хозяина) через клеточные контакты за счет сотрудничества или конкуренции за доступные питательные вещества, выработки вторичных метаболитов и антимикробных пептидов и физико-химических изменений кишечной ниши [24–27]. В целом, эти механизмы взаимодействия между кишечными грибками, бактериями и иммунитетом хозяина служат основой иммунного гомеостаза человека, участвуя в поддержании здоровья и развитии заболеваний.
Таблица 1 PDF (с кликабельными ссылками)
Накапливающиеся исследования позволили получить представление о составе кишечного микобиома у людей [1, 28] и заложили основу для изучения того, как кишечные грибки связаны с различными заболеваниями или даже служат их причиной, а также о том, как регулировать кишечный микобиом для лечения этих заболеваний. Настало время изучить и раскрыть функции кишечных грибков, а также их межцарственных взаимодействий с бактериальным микробиомом кишечника, в патогенезе и терапии заболеваний. Важно отметить, что кишечные грибки по-прежнему в значительной степени игнорируются в контексте разработки терапевтических средств на основе микробиоты, а имеющиеся данные о микобиоме не полностью используются в клинической практике. Таким образом, авторы обзора рассматривают достижения в области фундаментальных и трансляционных исследований микобиома кишечника, определяют роль патобионтных, пробиотических и условно-патогенных грибков в развитии заболеваний и подчеркивают экологический эффект кишечных грибково-бактериальных взаимодействий в физиологии и патофизиологии хозяина. Также обсуждаются недооцененные ранее влияния основанных на микобиоме терапевтических подходов на кишечный микобиом в клинических условиях и освещаются возможности для применения знаний о кишечном микобиоме в клинической практике, особенно в терапии.
Кишечный микобиом у здоровых людей
Развитие кишечного микобиома у человека
Формирование грибкового сообщества в кишечнике происходит до рождения, на что указывают как культуральные методы, так и технологии ампликонного секвенирования [29]; тем не менее, этот вопрос все еще остается предметом споров, поскольку существует множество противоречивых данных, указывающих как на внутриутробную колонизацию, так и на формирование микобиома после рождения [30, 31]. В исследованиях обнаружилось, что в кишечном микобиоме младенцев в течение первого месяца жизни преобладают Saccharomycetales и Malasseziales spp, затем следует плавное снижение количества Malasseziales, и к пятимесячному возрасту они практически не выявляются [32]. В возрасте одного-двух лет, который является критическим временем для перехода с молока на твердую пищу, Saccharomyces cerevisiae становится наиболее многочисленным видом одновременно с появлением Cystofilobasidium spp, Ascomycota spp и Monographella spp [33], что указывает на значительную роль рациона в формировании кишечного микобиома. После этого кишечный микобиом претерпевает дальнейшие изменения и созревает до взрослого грибкового сообщества, характеризующегося значительно большим разнообразием и преобладанием отделов Ascomycota, Basidiomycota и Zygomycota [1, 34]. В микобиоме кишечника здорового взрослого человека наиболее распространенные роды — Candida, Saccharomyces и Cladosporium [1, 34]; однако увеличение количества Candida spp и его обратная корреляция с разнообразием бактериального микробиома, наблюдаемые при заболеваниях, связанных с урбанизацией (т. е. заболеваний, морбидность которых положительно ассоциирована с жизнью в городе, таких как ожирение и воспалительное заболевание кишечника) [15, 19, 27, 35]. Это подчеркивает пагубную роль Candida spp при таких заболеваниях и формировании бактериального микробиома кишечника. У пожилых людей (старше 65 лет) Penicillium, Candida, Saccharomyces и Aspergillus — наиболее представленные в кишечном микобиоме роды [36, 37], и доминирующим снова оказывается Candida spp [38]. В совокупности эти исследования позволяют предположить, что хорошо развитый кишечный микобиом, находящийся в мутуалистических взаимоотношениях с бактериальным микробиомом кишечника, имеет большое значение для здоровья человека.
Основные факторы формирования микобиома кишечника
Поскольку грибки, рано колонизирующие кишечник, в основном определяются пищевым рационом и окружающей средой, по сравнению с бактериальным микробиомом, кишечный микобиом демонстрирует высокую изменчивость между индивидуумами и нестабильность в течение времени [1, 39]. В начале жизни на колонизацию кишечника младенца грибками влияют рацион матери, способ родов, срок беременности при рождении, тип вскармливания и окружающая среда [40]. После достижения зрелости основными определяющими факторами для кишечного микобиома остаются география населения, этническая принадлежность, урбанизация, образ жизни и тип питания [28]. У лиц с сильно различающимся паттерном рациона различается состав кишечного микобиома; особенно заметны различия между вегетарианцами и приверженцами западной диеты (т. е. в типичном случае содержащей высокую долю насыщенных жиров, белков, сахаров, очищенных зерновых продуктов, соли и алкоголя) [34]. Богатая углеводами диета связана с высоким содержанием Candida spp [41, 42], в то время как рацион, богатый белками, ассоциирован с меньшим количеством Candida spp и бактерий Methanobrevibacter у здоровых индивидуумов [41, 42]. Популяционное исследование микобиома кишечника, проведенное в 2021 году, также показало, что большое количество многих видов кишечных грибков связано со специфическими рационами определенных этнических групп [28]. Так, китайская национальная кухня, при которой употребляют чай с маслом и молоком, связана с присутствием в кишечнике грибков из родов Penicillium и Naumoyozyma [28]. Кроме того, у жителей городов в кишечнике увеличено количество S. cerevisiae и уменьшено число линий бактерий, вырабатывающих короткоцепочечные жирные кислоты (КЦЖК) [28, 43, 44], в то время как у сельских жителей и малых этнических популяций по сравнению с горожанами содержатся разнообразные виды малоизученных полезных грибков.
Было обнаружено, что помимо рациона и среды на разнообразие кишечного микобиома влияют факторы, связанные с хозяином, такие как генетика, возраст, пол и прием лекарственных препаратов [45]. У мышей с дефицитом дектина 1 (кодируется геном Clec7a) наблюдалось распространение Candida tropicalis и повышенная чувствительность к химически индуцированному колиту, что было результатом изменения реакций на собственные кишечные грибки [46]. Сходным образом, однонуклеотидный полиморфизм — CARD9 (кодируется геном CARD9S12N) — у пациентов с воспалительным заболеванием кишечника связан с присутствием в слизистой оболочке кишечника Malassezia spp. Дальнейшие исследования позже подтвердили взаимосвязь между CARD9 и усугублением воспаления кишечника у мышей [23]. Эти исследования подтверждают, что генетический полиморфизм у людей также вносит вклад в изменчивость состава кишечного микобиома, вовлеченную в физиологические и патологические процессы хозяина. Отсюда следует, что весьма необходим широкомасштабный полногеномный мета-анализ связей между генетическими вариантами у человека и кишечным микробиомом с учетом родословных. Такие знания улучшат понимание двунаправленных причинно-следственных связей между микобиомом кишечника и рисками заболеваний.
Кишечный микобиом при патологии
Дисбиоз кишечного микобиома при различных заболеваниях
Исследования на мышах показали, что нарушение кишечного грибкового сообщества вследствие перорального приема противогрибковых препаратов усиливает колит и усугубляет аллергические заболевания дыхательных путей [47]; это дает основания предполагать, что дисбаланс в кишечном микобиоме может принимать участие в патогенезе как кишечных, так и внекишечных заболеваний. Сходным образом, накапливаются исследования на людях, направленные на сравнение микобиома кишечника здоровых индивидуумов с таковым у лиц с различными кишечными и внекишечными патологиями. В то же время появляющиеся исследования механизмов позволяют понять причинную роль определенных грибков в различных заболеваниях (таблица 2). Дисбиоз микобиома кишечника тесно связан с кишечными расстройствами, такими как воспалительное заболевание кишечника [14–16, 23, 41–48], синдром раздраженного кишечника [105] и целиакия [106]. Кроме того, изменения кишечного микобиома также ассоциативно или причинно связаны с развитием и прогрессией злокачественных новообразований, таких как колоректальный рак [65–68] и протоковая аденокарцинома поджелудочной железы [21], и развитием кишечной реакции «трансплантат против хозяина» (РТПХ) после аллогенной трансплантации гемопоэтических клеток [62–64].

Микобиом кишечника также вовлечен в заболевания органов за пределами желудочно-кишечного тракта, включая алкогольную болезнь печени [72] и неалкогольный стеатогепатоз [78]. Было обнаружено, что хроническое употребление алкоголя увеличивает кишечную грибковую нагрузку и транслокацию грибкового β-глюкана и кандидализина в системный кровоток, вызывая таким образом воспаление печени у мышей [72, 73]. В трех исследованиях, проведенных за последние четыре года, также сообщалось о значительных изменениях кишечного микобиома при инфекционных заболеваниях, включая бактериальную инфекцию Clostridioides difficile [27] и заражение COVID-19 [82]; при обоих заболеваниях было обнаружено увеличение количества Candida albicans, сопровождающееся бактериальным дисбиозом [27, 81, 107]. Нарушения в грибковом сообществе кишечника найдены также при других вирусных заболеваниях, таких как гепатит B и ВИЧ-инфекция [83, 85]. Один из предполагаемых механизмов подразумевает, что экзофильная кислота — вторичный метаболит грибков — ингибирует проникновение вирусов в клетку хозяина [84]. За последнее десятилетие в ходе эпидемиологических исследований удалось очертить участие кишечных грибков в метаболических и неврологических расстройствах, включая ожирение [17, 18], диабет [89, 90, 92, 93], атеросклероз [96, 97], множественный склероз [99], синдром Ретта [100, 101], расстройства аутистического спектра [19, 20], болезни Паркинсона [108] и Альцгеймера [103, 104], шизофрения [109, 110] и расстройства пищевого поведения [111]. Исследования на мышах показали, что ряд определенных грибков, таких как Candida parapsilosis и Stereum hirsutum, оказывали как вредное, так и полезное влияние на метаболические расстройства [86–89], а грибки слизистых оболочек могут поддерживать барьерную функцию кишечника и влиять на социальное поведение мышей благодаря воздействию на клеточный иммунитет с участием Т-хелперов 17 типа (Th17) [52]. Эти исследования позволяют предполагать обширное влияние кишечных грибков на системном уровне и на ось «кишечник — мозг» в организме хозяина. В целом эти наблюдательные изыскательные исследования микобиома кишечника пациентов подчеркивают связь между дисбиозом кишечного микобиома и патогенезом заболеваний. Тем не менее, взаимоотношения причин и последствий в течение болезни могут переплетаться и варьировать в зависимости от заболевания, поэтому в дальнейшем требуется глубокое изучение функций и клинического значения различных грибков при различных патологиях.
Пагубная роль кишечных грибков, связанных с заболеваниями
Рост C. albicans в микобиоме кишечника постоянно наблюдается при многих заболеваниях, включая воспалительное заболевание кишечника [14, 15, 50], РТПХ [16], инфекции C. difficile [27], болезни печени [74], астму [112], шизофрению [109, 110] и COVID-19 [81]. Хотя способ, которым C. albicans участвует в патогенезе этих заболеваний, до конца непонятен, один из хорошо установленных механизмов заключается в том, что колонизация C. albicans может управлять Th17-опосредованными иммунными реакциями и нарушать состав кишечного микробиома, что усугубляет заболевание [26, 53, 54]. Маннаны — высококонсервативные компоненты клеточных стенок грибков — образуются в результате индуцированных Candida spp ответов Th17 и IL-23 путем активации рецепторов распознавания образов, что усугубляет как РТПХ, так и колит у мышей [62–55]. Воспаление кишечника повышает количество C. albicans, что индуцирует противогрибковые клетки Th17. Они обладают перекрестной реактивностью по отношению к другим видам грибков, включая распространяющийся по воздуху грибок Aspergillus fumigatus [113]. Это приводит к расширению популяции клеток Th17 в легких и, таким образом, к воспалению дыхательных путей, что подтверждает системную дистальную связь между кишечными грибками и респираторной патологией [113]. Malassezia restricta — еще один хорошо изученный грибок, широко представленный при многих заболеваниях [23, 97]. Было обнаружено, что M. restricta усугубляет воспаление кишечника как у мышей, так и у людей с воспалительным заболеванием кишечника, особенно у пациентов с болезнью Крона, гомозиготных по полиморфизму CARD9S12N [23, 114]. Кроме того, Malassezia spp (в частности, Malassezia globosa) могут провоцировать рост опухоли у мышей с раком поджелудочной железы через активацию каскада C3-компонента комплемента [21]. В более новом исследовании 2021 года выявлено, что воспаленные слизистые оболочки пациентов с болезнью Крона были обогащены Debaryomyces hansenii — грибком, широко применяемым в пищевой индустрии. С механистической точки зрения, это исследование показало нарушение заживления толстого кишечника из-за повышения уровня производимых миелоидными клетками IFN 1 типа и CCL5 в ответ на введение D. hansenii травмированным, выращенным при обычных условиях или гнотобиотическим мышам [22]. Напротив, роль типичных грибков — дрожжей S. cerevisiae — при патологиях противоречива [15]. У пациентов с болезнью Крона по сравнению со здоровыми людьми повышено количество антител к S. cerevisiae, что используется в клинике в качестве серологического маркера для диагностирования этого заболевания [115, 116]. На сегодняшний день роли, которые играет множество кишечных грибков при различных заболеваниях, еще предстоит выяснить и полностью исследовать, что прольет свет на новые мишени и подходы в терапии.
Нарушение взаимодействий между кишечными грибками и бактериями лежит в основе заболеваний
Микобиом кишечника представляет собой экосистему, которая включает в себя сложные взаимодействия микроорганизмов, которые определяют устойчивость всего сообщества. Динамика взаимодействия между грибками и бактериями лежит в основе как патогенеза, так и прогрессирования заболеваний [117]. В исследовании, проведенном в 2021 году, для изучения траектории развития экологии кишечного микробиома оценивали продольную абсолютную распространенность видов бактерий и грибков в кишечнике недоношенных детей [26]. Исследователи обнаружили, что на формирование кишечного микробиома могут влиять межцарственные направленные взаимодействия; в кишечнике недоношенных детей наблюдалась обратная корреляция между бактериальной и грибковой нагрузкой, а один вид грибков (C. albicans) в ходе развития младенца ингибировал несколько доминирующих родов кишечных бактерий [26]. Эти данные подразумевают, что C. albicans существенно нарушает формирование бактериального микробиома кишечника. В подтверждение этой гипотезы в предыдущем исследовании было выявлено, что как у мышей, так и у людей присутствие в кишечнике C. albicans значительно снижает эффективность трансплантации фекальной микробиоты (ТФМ) для лечения инфекции C. difficile. Это говорит о том, что C. albicans ингибирует трансплантацию, образование колоний и рост в кишечнике реципиентов ТФМ [27]. Кроме того, существенное увеличение числа грибково-бактериальных взаимодействий наблюдается у пациентов с язвенным колитом и не наблюдается у пациентов с болезнью Крона; оба этих состояния являются подтипами воспалительного заболевания кишечника [15]. Напротив, у мышей рацион с высоким содержанием жиров приводит к значительному снижению количества грибково-бактериальных взаимодействий [118]. Хотя большинство проводимых в настоящее время исследований кишечного микобиома при заболеваниях человека направлено на выявление видов грибков, вызывающих болезнь, в будущем следует уделить внимание межцарственным взаимодействиям грибков и бактерий и подробно их изучить. Сложные внутри- и межцарственные взаимосвязи могут быть особенно актуальны в тех случаях, когда оказывается, что один вид грибков (например, S. cerevisiae) играет противоположные роли в контекстах различных заболеваний.
Сложные взаимоотношения между кишечными грибками, бактериями и иммунитетом хозяина
Взаимодействие между кишечными грибками и иммунитетом хозяина
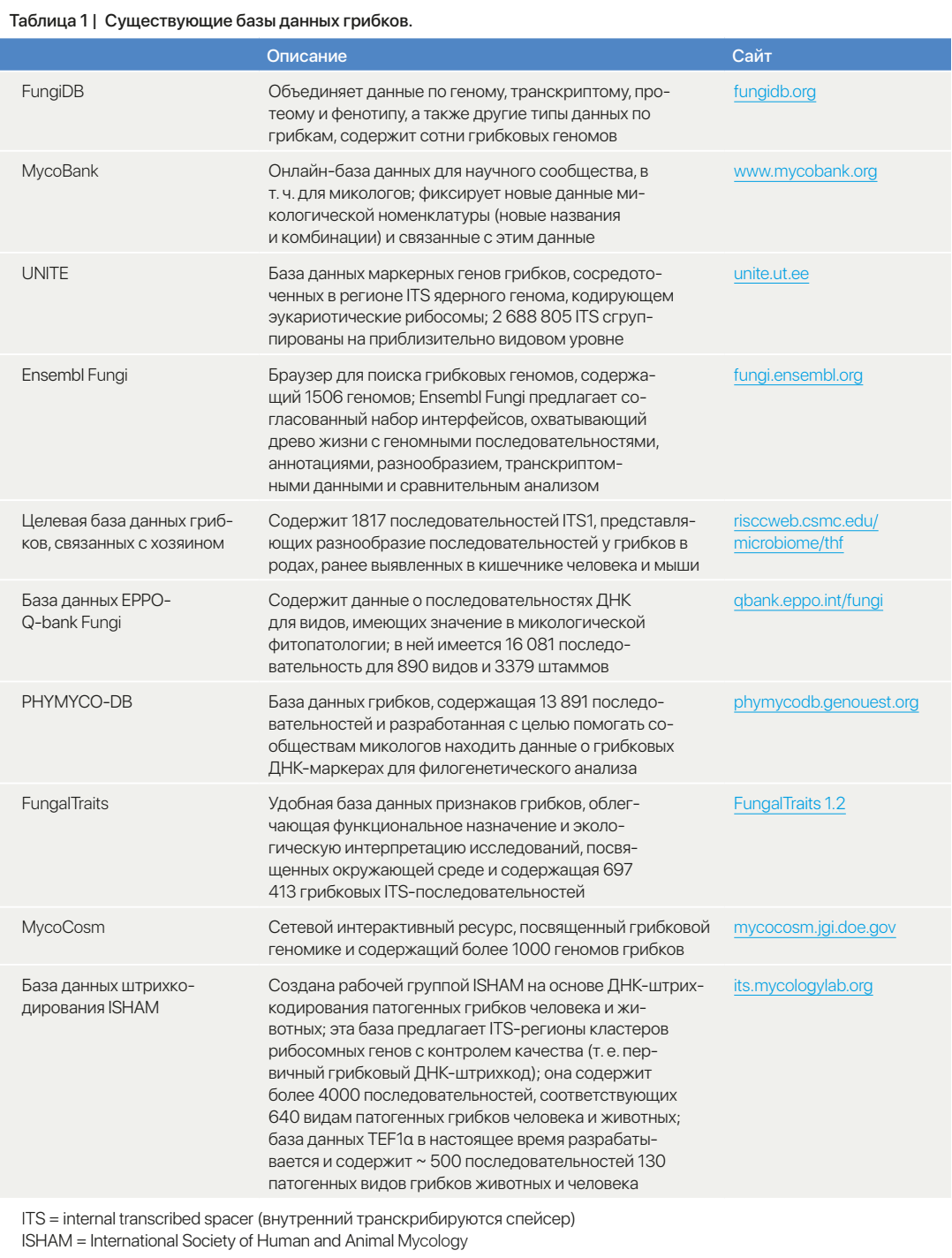
Грибки, населяющие кишечник, представляют собой иммунологически высокореактивный компонент кишечной микробиоты. В устойчивом состоянии кишечные грибки осуществляют симбиотические взаимодействия с организмом хозяина-млекопитающего (рисунок 1). Исследования на мышах показали, что восприимчивость к колиту и инфекции вируса гриппа А при уничтожении кишечных симбиотических бактерий (с помощью антибиотиков) эффективно устранялась моноколонизацией C. albicans или S. cerevisiae [119]. Позже было обнаружено, что защитные эффекты грибков-комменсалов опосредуются маннанами [119]. Эти результаты показали, что кишечные грибки могут функционально заменять бактерии, обеспечивая защиту от инфекционных и воспалительных заболеваний. В дополнение к маннанам, другие компоненты клеточных стенок грибов, такие как β-глюканы, хитин и комплексы, связанные с маннозой, узнаются рецепторами распознавания образов, включающими лектиновые рецепторы С-типа, Toll-подобные и NOD-подобные рецепторы внутри или на поверхности клетки хозяина, запуская каскады передачи сигналов, которые отвечают за противогрибковый иммунитет [120–122]. На клеточном уровне было обнаружено, что мононуклеарные фагоциты CX3CR1+, которые экспрессируют рецепторы лектина С-типа, необходимы для инициации как врожденных, так и адаптивных иммунных ответов на кишечные грибки с участием Syk-сигнального пути, что подчеркивает ключевую роль этой популяции миелоидных клеток и пути Syk в противогрибковом иммунитете [123]. Образующееся при этих врожденных реакциях цитокиновое и хемокиновое микроокружение способствует преимущественной дифференцировке Th17, вырабатывающих IL-17; Th1, вырабатывающих IFN-γ и Th1 или Th17-лимфоцитов, совместно продуцирующих IL-17 или IFN-γ [124], усиливает привлечение нейтрофилов в собственную пластинку слизистой оболочки кишечника и таким образом ограничивает рост кишечных грибков [125].
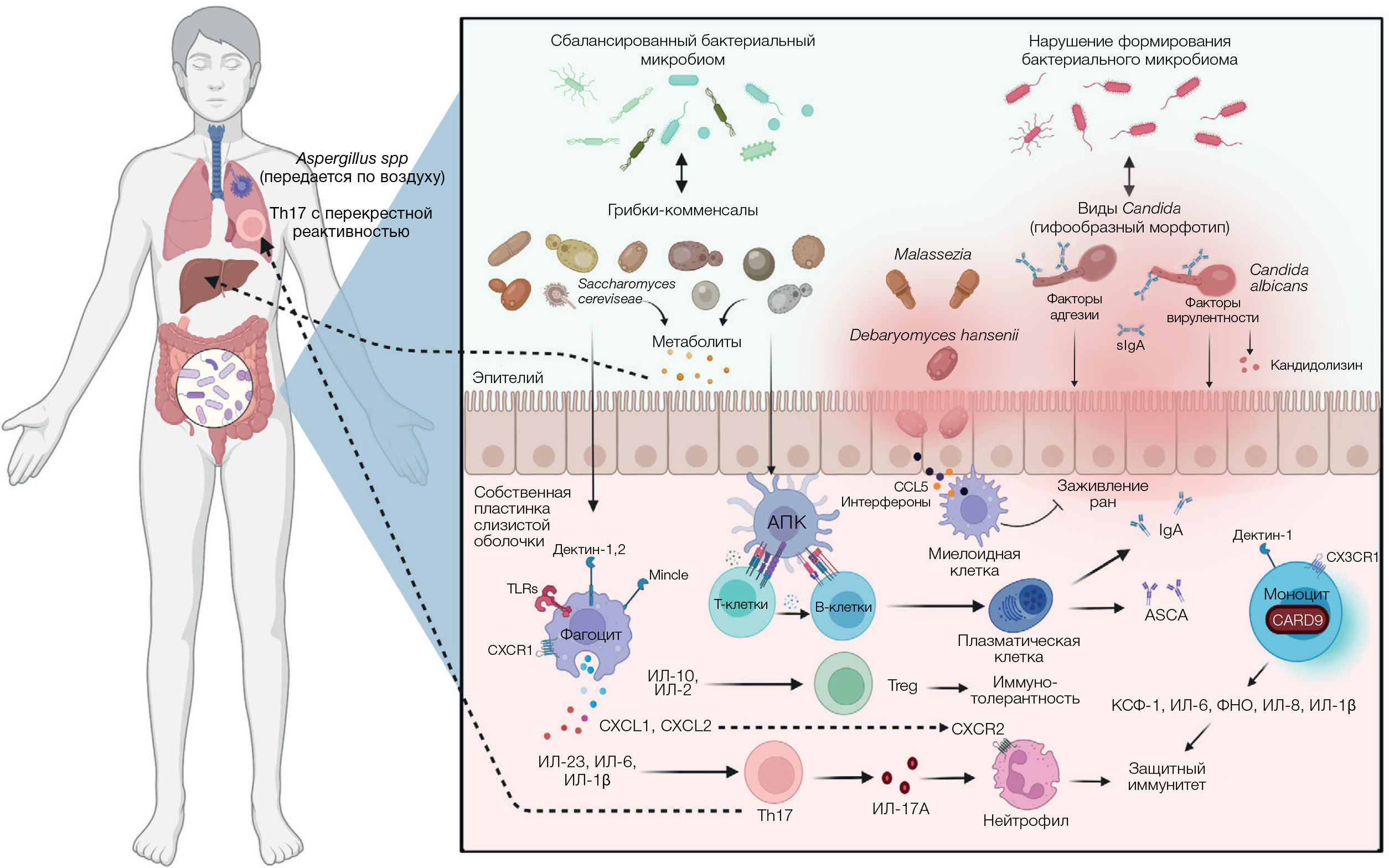
Рисунок 1 | Взаимодействие между кишечным микобиомом и иммунитетом хозяина в связи с формированием бактериального микробиома
АSC = антитела против Saccharomyces cerevisiae. Treg = регуляторные T-клетки. Th17 = T-хелперы 17 типа.
Более того, антитела к грибковому β-глюкану и другим грибковым антигенам обнаруживаются как в сыворотке здоровых лиц, так и у пациентов с воспалительным заболеванием кишечника; это позволяет предположить, что грибки также активируют гуморальный иммунитет хозяина [126, 127]. В этих исследованиях изучали репертуар человеческих антител против кишечных грибков и определяли грибковые популяции и молекулы, связанные с системными антителами IgG1 и кишечными секреторными антителами IgA [127–129]. Секреторные антитела IgA гораздо лучше связывались с гифообразным морфотипом C. albicans, чем с дрожжеподобным (известно, что гифообразный морфотип более вирулентен, чем дрожжеподобный) — в частности, с ассоциированными с гифами факторами вирулентности, включая молекулы адгезии и инвазии, такие как Als3 и Sap6 [128, 129]. Увеличение количества зернистых гиф в смывах слизистой у пациентов с болезнью Крона по сравнению со здоровыми людьми коррелирует со снижением титра противогрибковых секреторных антител [129]. Было подтверждено, что клинически значимая вакцина против адгезина, который вырабатывается гифообразными формами грибков, способна защищать мышей с колитом от повреждений, связанных с C. albicans [128]. В совокупности эти данные дают основания предполагать, что антитела IgA в слизистых оболочках служат ключевыми регуляторами кишечных грибков-комменсалов за счет подавления гифообразной формы грибков, а также их факторов вирулентности, и нарушение этого механизма может привести к воспалению кишечника. В целом, равновесие или дисбиоз — по морфологии, составу или же по обоим этим параметрам — кишечных грибков определяет защитный или провоспалительный иммунный ответ хозяина. В свою очередь, такие реакции хозяина в совокупности организуют сбалансированное кишечное грибковое сообщество, в котором оппортунистическая экспансия некоторых грибков может вызывать воспаление и другие патологические процессы. Хотя понимание иммунитета хозяина в отношении грибковых инфекций и противогрибковых иммунных реакций при поддержании гомеостаза и заболеваниях человека значительно продвинулось вперед за последнее десятилетие, разнообразие и сложность иммунных ответов, функций и иммунной памяти в отношении основного микобиома и его компонентов еще предстоит полностью изучить.
Взаимодействия между грибками и бактериями в кишечнике в связи с патофизиологией хозяина
Помимо прямого влияния кишечных грибков на организм хозяина, они также активно взаимодействуют с популяциями кишечных бактерий (рисунок 2). Грибки также могут продуцировать противомикробные пептиды, алкоголь и другие метаболиты, влияя таким образом на колонизацию кишечника бактериями [130, 131]. Бактерии, в свою очередь, модулируют размножение грибков и рост гифов путем производства жирных кислот [132, 133]. C. albicans снижает количество растворенного кислорода в своем окружении, усиливая таким образом рост анаэробных бактерий, включая C. difficile [134, 135]. Взаимодействие между C. albicans и Helicobacter pylori (вид бактерий, тесно связанный с развитием язвы желудка) обнаруживается в биопсийных образцах желудка, при этом H. pylori содержится в вакуолях клеток C. albicans — возможно, для выживания в условиях низких значений pH, характерных для желудка [136, 137]. В еще одном исследовании на мышах сообщалось, что при применении антибиотиков усиливается колонизация желудка C. albicans; это сопровождается воспалением, которое подавляет реколонизацию штаммами бактерии-комменсала Lactobacillus [137].
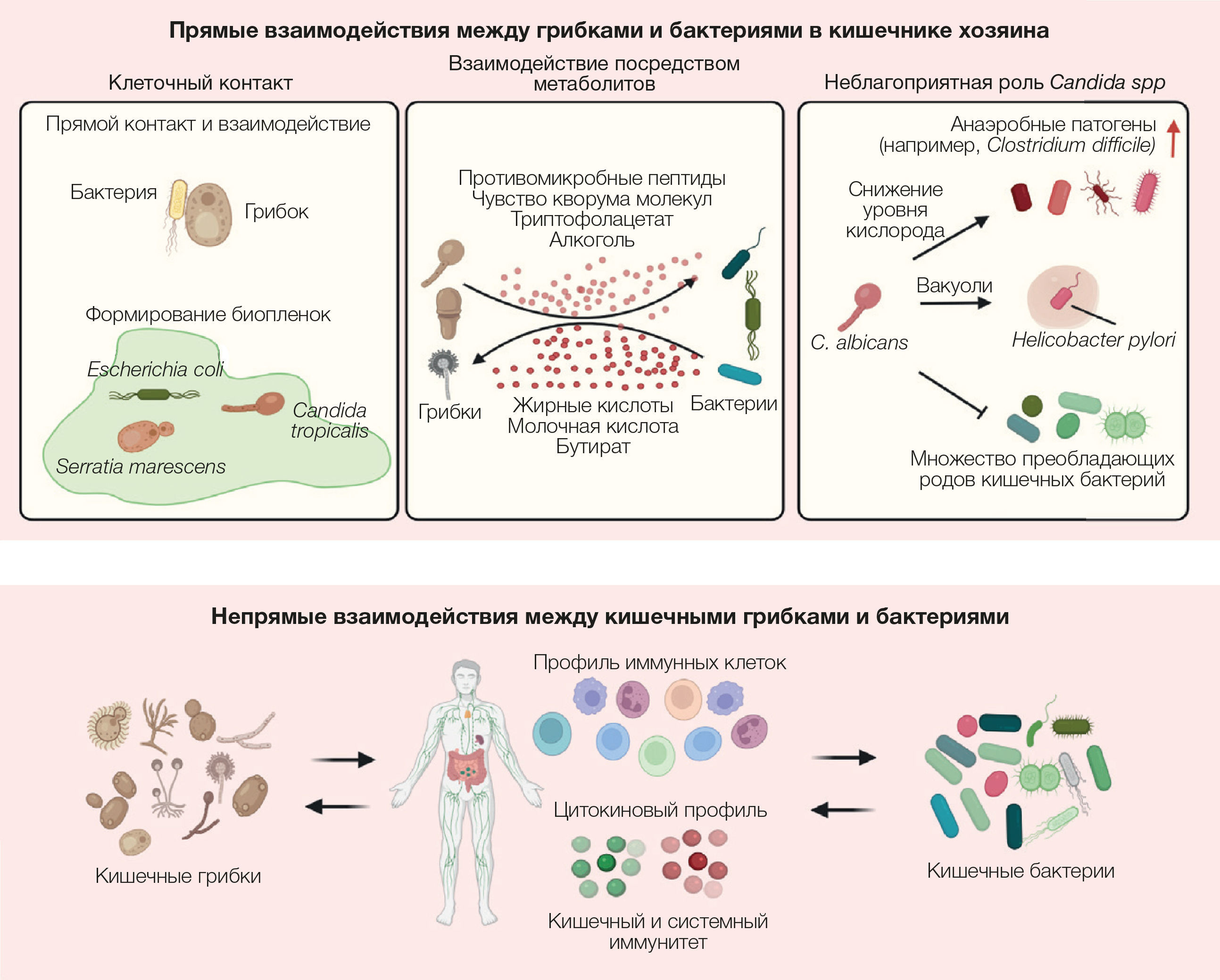
Рисунок 2. Межцарственные взаимодействия между грибками и бактериями в кишечнике хозяина
Взаимодействие кишечных грибков и бактерий может влиять на патофизиологию хозяина. В модели колита у мышей, индуцируемого декстран сульфатом натрия (ДСН), применение противогрибковых средств приводило к тяжелому колиту и изменениям в бактериальном микробиоме [138]. В исследовании, проведенном в 2018 году, обнаружено, что устранение бактерий семейства Enterobacteriaceae из кишечника сводило на нет как полезное влияние грибка Saccharomyces boulardii, так и патогенное влияние грибка C. albicans на колит, индуцированный ДСН. Кроме того, восстановление популяции Enterobacteriaceae восстановило и воздействие обоих видов грибков на ДСН-индуцированный колит [139], что позволяет предположить решающую роль кишечных бактерий в опосредовании действия кишечных грибков на организм хозяина. В 2020 году ван Тилбург Бернардес и его коллеги [140] обнаружили, что грибковая колонизация в отсутствие бактерий недостаточна для индукции каких-либо физиологических изменений у безмикробных мышей, в то время как совместная колонизация грибками и бактериями усугубляет воспаление толстой кишки, что еще раз подчеркивает синергию влияния кишечных грибков и бактерий на организм хозяина.
Клиническое применение кишечного микобиома
Хорошо известно, что кишечный микобиом в значительной степени участвует в регуляции физиологии иммунитета хозяина, влияя таким образом на патогенез и прогрессирование различных заболеваний. Следовательно, модуляция микобиома кишечника для лечения заболеваний представляет собой новую многообещающую стратегию. Все современные терапевтические подходы, затрагивающие микробиом и включающие ТФМ, противогрибковые средства, антибиотики, изменения рациона и пробиотики (как грибковые, так и бактериальные штаммы), демонстрируют значительное влияние на регуляцию кишечного микробиома в совокупности с клинической эффективностью (рисунок 3). В этом разделе авторы рассматривают ранее недооцененную роль грибков в терапии на основе микробиома и клинические результаты, а также обсуждают терапевтический потенциал модуляции кишечного микробиома при лечении заболеваний.
Рисунок 3. Терапевтические подходы, основанные на модификации кишечного микобиома, применяющиеся в клинических условиях
Трансплантация фекальной микробиоты
Впервые было обнаружено, что ТФМ — перенос фекальной суспензии от здорового донора в желудочно-кишечный тракт пациента с целью восстановления кишечной микробиоты — высокоэффективен при трудно поддающейся лечению инфекции C. difficile [141]. С тех пор накоплены данные клинических испытаний о применении ТФМ для лечения множества других заболеваний. Тем не менее, клиническая эффективность варьирует в зависимости от индивидуума и патологии, и только бактериальным переносом невозможно полностью объяснить вариации в исходах лечения. Появляются исследования, указывающие на значение кишечных грибков в терапии ТФМ. В исследовании терапии ТФМ у пациентов с рецидивирующей инфекцией C. difficile выявлено, что пересадка грибков от здоровых доноров сопровождается повышенной скоростью приживления трансплантата кишечной микробиоты, что позволяет предположить полезную роль трансплантации кишечного микробиома как единого целого [18]. Однако, как наличие C. albicans у доноров, так и персистирующее повышенное количество C. albicans у реципиентов связаны с плохими исходами ТФМ у пациентов с инфекцией C. difficile [27], в то время как у мышей-реципиентов эффективность ТФМ восстанавливалась после уничтожения C. albicans противогрибковым агентом (например, флуконазолом) [27]. В другом исследовани лечения с помощью ТФМ пациентов с рецидивирующей инфекцией C. difficile чрезмерное количество грибков рода Yarrowiaу у пациентов перед ТФМ было связано с неэффективной ТФМ [142]. Эти данные дают основания предполагать, что преобладание определенных грибков у реципиентов или доноров перед ТФМ может уменьшать терапевтическую эффективность этой процедуры. Кроме того, в этом исследовании изучали функциональность кишечного микобиома и бактериома с помощью объемной метатранскриптомики у 49 пациентов с инфекцией C. difficile [143]. Результаты показали, что обогащенные микробные пути при инфекции C. difficile были преимущественно ассоциированы с выработкой биопленок, белками-сенсорами численности популяции и двухкомпонентными системами, связанными с такими функциями, как осмотическая регуляция, метаболизм линолевой кислоты и сборка жгутиков. Общие нарушения функциональности кишечных грибков и бактерий могут влиять на эффективность ТФМ, и этот вопрос заслуживает дальнейших исследований.
Помимо инфекции C. difficile, была изучена роль кишечных грибков при лечении ТФМ язвенного колита — этому посвящено исследование 2020 года [56]. В РКИ ТФМ при язвенном колите большое количество Candida spp у реципиентов до ТФМ было связано с успехом процедуры, в то время как снижение Candida spp после ТФМ — с уменьшением тяжести заболевания [56]. Результаты для язвенного колита не согласуются с таковыми для инфекции C. difficile; это указывает на то, что кишечные грибы могут играть различные роли при ТФМ в зависимости от типа заболевания, что требует дальнейшего исследования механизмов; хотя было показано, что ТФМ предотвращает инфицирование крови грибками у пациентов с C. difficile или язвенным колитом [144, 145]. Авторы обнаружили размножение Candida dubliniensis в кишечнике одного пациента с РТПХ после получения четырех отдельных доз ТФМ, что говорит о потенциальном риске кандидоза, вызываемого ТФМ [146]. Примечательно, что авторы также выявили присутствие C. dubliniensis в донорских фекалиях. Неясно, способствует ли донор росту C. dubliniensis после ТФМ; при процедуре рекомендован скрининг донора с полным чекапом на грибки-оппортунисты (например, C. albicans, C. parapsilosis, C. tropicalis и C. dubliniensis). Напротив, те доноры, микобиом которых содержит полезные грибки, должны использоваться при ТФМ для лечения заболеваний. В целом, клинические и трансляционные исследования, оценивающие эффективность различных конфигураций кишечного микобиома доноров при лечении различных заболеваний, по-прежнему скудны. Более того, следует должным образом применять индивидуально подобранную ТФМ или даже трансплантировать фекальный микобиом на основе исследований состава микобиомов донора и реципиента.
Противогрибковые средства и антибиотики
Противогрибковые средства — препараты первого выбора для подавления роста патогенных грибков при заболеваниях, возникающих вследствие грибковых инфекций. В настоящее время противогрибковые препараты используются и при других заболеваниях, связанных с нарушениями кишечного микобиома. Было обнаружено, что лечение флуконазолом эффективно предотвращает колонизацию кишечника C. albicans у пациентов с язвенным колитом и снижает индекс активности язвенного колита у животных [147]. Сходным образом, фунгициды могут ослаблять висцеральную гиперчувствительность у крыс с синдромом воспаленного кишечника [57]. Хотя противогрибковые средства могут неспецифически воздействовать на грибки, колонизирующие кишечник, затрагивая и полезные линии, по-прежнему сложно использовать противогрибковые препараты широкого спектра действия в качестве терапии заболеваний, не относящихся к грибковым инфекциям. Более того, длительное лечение фунгицидами может нарушить кишечную микробиоту (как бактериальный, так и грибковый компонент), благоприятствуя появлению патогенных грибков со множественной лекарственной устойчивостью, усиливая тяжесть колита и аллергию дыхательных путей [47, 140]. Существуют и другие проблемы, связанные с клинической эффективностью противогрибковых средств. Некоторые из них метаболизируется прежде, чем достигнут нижних отделов желудочно-кишечного тракта [48]. Кроме того, гипоксическая микросреда в биопленках нитчатых грибков усиливает их выживаемость при использовании современных методов противогрибковой терапии, что приводит к ее низкой эффективности [148]. Таким образом, современные подходы противогрибковой терапии следует модифицировать для точного воздействия на виды грибков, вызывающих конкретное заболевание.
Хотя антибиотики повсеместно применяются для борьбы с бактериальными инфекциями, их влияние на грибковое сообщество кишечника обычно игнорируется. Прием антибиотиков может нарушать сообщество бактерий-комменсалов, таким образом обеспечивая нишу для инвазивных грибков — в частности, Candida spp [149, 150]. Силбайндер с соавт. [151] оценили влияние антибиотиков на разрушение и устойчивость состава грибковых сообществ у людей. Они показали, что антибактериальные препараты превращают мутуалистические грибок-грибковые взаимодействия в конкурентные даже в том случае, если кишечная микробиота восстанавливалась через три месяца после лечения; это позволяет предположить, что антибиотики обладают более долгосрочным эффектом по отношению к грибковому компоненту кишечной микробиоты по сравнению с бактериальным [151]. Более того, распространение оппортунистов-патогенов, вызванное антибиотиками, было связано с неблагоприятными результатами лечения. Было обнаружено, что антибиотики снижают эффективность химиотерапии вследствие экспансии популяций грибков-комменсалов [152]. В целом, как противогрибковые средства, так и антибиотики оказывают обширное влияние на кишечный микробиом, влияют на исход заболеваний и клиническую эффективность препаратов. Таким образом, в будущих исследованиях и клинической практике нужно использовать более направленные и индивидуальные подходы против грибков, вызывающих заболевания.
Пробиотики и их долгосрочная польза
Пробиотический подход подразумевает добавление в рацион полезных для хозяина видов бактерий; было показано, что он может служить альтернативной противогрибковой стратегией. В отличие от антибиотиков, пробиотики могут достигать нижних отделов желудочно-кишечного тракта, бороться с формирующими биопленки грибками, снижать распространение грибков со множественной лекарственной устойчивостью и минимизировать влияние на кишечный микробиом. Пробиотические бактерии Lactobacillus acidophilus, Bifidobacterium lactis, Bifidobacterium longum и Bifidobacterium bifidum могут ингибировать колонизацию кишечника грибками путем выработки липопептида и снижать уровень сепсиса, вызванного инвазивными грибками, у новорожденных с низкой массой тела [153]. Помимо бактериальных пробиотиков для борьбы с грибковыми инфекциями и лечения различных заболеваний можно использовать грибковые пробиотики и получаемые из грибков вещества. Множество клинических испытаний указывает на то, что S. boulardii эффективен при дополнения к лечению желудочно-кишечных инфекций, а также заболеваний с участием инфекции C. difficile [154], воспалительного заболевания кишечника [155] и синдрома раздраженного кишечника [156]. S. boulardii может усиливать гуморальный и врожденный иммунитет, улучшать целостность кишечного эпителия и восстанавливать состав кишечной микробиоты [157]. Было обнаружено, что β-глюканы — натуральные грибковые продукты, выделенные из клеточных стенок S. cerevisiae, — способствуют предотвращению и лечению злокачественных опухолей, уменьшают потерю веса, снижают уровень холестерина и усиливают радиопротекцию [158]. Метаболит триптофолацетат, продуцируемый пробиотическими дрожжами, блокировал чувство кворума ряда патогенных грамотрицательных бактерий, подавляя таким образом их вирулентность [159]. У мышей лизоцим, полученный из грибка Acremonium alcalophilum и представляющий собой хорошо охарактеризованный пептид с защитными свойствами по отношению к организму хозяина, как было обнаружено, ослабляет индуцированное ДСН воспаление и нарушения работы желудочно-кишечного тракта, вызванные диетой с высоким содержанием жиров. Это происходит путем модуляции бактериальной микробиоты кишечника — в частности, Akkermansia muciniphila [160]. Помимо природных и наивных пробиотических грибковых штаммов и метаболитов при лечении заболеваний применяют и сконструированные пробиотики (с модификациями, направленными на мишень). В 2021 был разработан пробиотик на основе конструкта из S. cerevisiae, полученного путем направленной эволюции и синтетических биологических подходов так, чтобы воспринимать провоспалительные молекулы хозяина (например, внеклеточный АТФ) и генерировать саморегулирующийся противовоспалительный ответ (с помощью секреции фермента, вызывающего деградацию внеклеточного АТФ — апиразы). Этот пробиотик применяли для лечения воспалительного заболевания кишечника [161].
Хотя Saccharomyces spp — мощный пробиотик, который можно использовать в терапии заболеваний, следует аккуратно оценивать усиление роста грибков, вызываемое его применением [162, 163]. Кроме того, прием пробиотиков может ингибировать формирование как полостного, так и слизистого микробиома в кишечнике людей и мышей [164, 165].
Таким образом, при лечении различных заболеваний пробиотиками следует проявлять осторожность. С точки зрения целостной микробной экологии кишечника, помимо индивидуального приема пробиотиков, должны применяться терапевтические методы, основанные на восстановлении основного кишечного микобиома.
Изменение рациона
Изменение рациона представляет собой довольно умеренный и мягкий подход к регуляции кишечного микробиома, в том числе микобиома. Было обнаружено, что западная диета поддерживает существование основы кишечного микобиома, состоящей из грибковых семейств Debaryomycetaceae (Debaryomyces spp и Candida spp), Malasseziaceae (Malassezia spp), Dipodascaceae (Galactomyces spp и Geotrichum spp) и Davidiellaceae (Cladosporium spp) [34, 166], большая часть которых связана с желудочно-кишечным воспалением. В соответствии с этим наблюдением, употребление углеводов с пищей положительно коррелирует с присутствием Candida spp в кишечнике человека [42, 167, 168]. Напротив, микобиомы при вегетарианской диете демонстрируют большее количество спорообразующих и пищевых грибков (Fusarium spp и Penicillium spp) по сравнению с таковыми у лиц, употребляющих в пищу мясо. Эти данные подчеркивают, что рацион обладает модулирующим эффектом по отношению к кишечному микобиому относительно здоровья организма хозяина.
В появляющихся исследованиях начинают изучать возможность изменения рациона и манипуляций с кишечным микобиомом при различных заболеваниях. Диета, богатая кокосовым маслом, снижала доступность длинноцепочечных жирных кислот в кишечнике и изменяла программу метаболизма грибков, ингибируя таким образом колонизацию желудочно-кишечного тракта мышей C. albicans [169]. В исследованиях детей с болезнью Крона, находящихся на эксклюзивном энтеральном питании, которое является терапевтическим подходом первой линии при этом заболевании, была выявлена отрицательная корреляция между началом эксклюзивного питания и большого количества C. albicans, Clavispora lusitaniae и Cyberlindnera jadinii в фекалиях [170]. Хотя эти виды грибков ранее связывали с патогенезом болезни Крона, это позволяет предположить, что эксклюзивное энтеральное питание является эффективным терапевтическим подходом при этом заболевании, учитывая его благотворное влияние как на клинический исход, так и на модуляцию кишечного микобиома.
Ферментированное питание, содержащее большое количество дрожжей или нитчатых грибков, представляет собой хороший источник кишечных грибков. В 2021 году авторы сообщили, что кишечный микобиом этнических меньшинств, которые употребляют ферментированные продукты (в рамках региональных и культурных диет), обогащен S. cerevisiae, что сопровождается низкой частотой воспалительных заболеваний кишечника в популяции [28]. В другой когорте обнаружено, что у индивидуумов, которые часто употребляют сыр, в кишечном микобиоме уменьшается присутствие Candida spp [171]. Эти исследования указывают на то, что ферментированные продукты могут быть полезными для людей благодаря модуляции состава кишечного микобиома и предотвращению заболеваний. Добавление пищевых волокон представляет собой стратегию лечения таких заболеваний, как диабет второго типа и воспалительные заболевания кишечника. Одним из распространенных механизмов противодействия пищевых волокон этим заболеваниям считается повышение выработки короткоцепочечных жирных кислот (КЦЖК) за счет бактериальной ферментации [172]. Было обнаружено, что КЦЖК подавляют рост C. albicans путем стимуляции иммунитета слизистой оболочки; это указывает на то, что пищевые волокна могут регулировать кишечный микобиом в сочетании с бактериальным микробиомом [173]. Таким образом, разработка контролируемых лечебных диет с учетом тонкой модуляции кишечных грибков и бактерий в дополнение к обеспечению питания при лечении определенного заболевания может позволить получить полезный клинический эффект.
Текущие трудности и перспективы на будущее
За последнее десятилетие в этой области были достигнуты огромные успехи благодаря достижениям метагеномики, и в результате понимание кишечного микобиома значительно расширилось. Однако знания о кишечных грибках все еще неполные, и нет единого мнения о том, сколько генетического и фенотипического разнообразия микобиома кишечника человека еще предстоит открыть. Учитывая высокую межиндивидуальную и внутрииндивидуальную изменчивость кишечного микобиома, недостаточные выборки популяций на разных континентах и в разных этнических группах, существенную гетерогенность грибковых штаммов среди индивидуумов, возможно, нам еще предстоит узнать много нового [28, 43, 44].
Причинно-следственная связь между изменениями кишечного микобиома и заболеваниями во многом неясна, и ее предстоит установить в будущем. Кишечные грибки могут вызывать патологии и/или быть их результатом. Например, у пациентов с инфекцией C. difficile, воспалительным заболеванием кишечника и COVID-19 наблюдалось повышение уровня C. albicans [15, 27, 81]. Оно частично может быть следствием приема антибиотиков или нарушения равновесия микробиома кишечника у этих пациентов. Кроме того, различия в разнообразии штаммов и молекулярное разнообразие одного и того же вида грибков у разных людей могут функционально вызывать разные фенотипические и терапевтические реакции. Таким образом, учитывая множество «белых пятен» во взаимосвязях между кишечными грибками и патогенезом и терапией болезней, для перевода знаний о кишечном микобиоме в клиническую практику требуются обширные исследования.
Микробиом кишечника представляет собой сложное межцарственное собрание разнообразных микроорганизмов (включая бактерии, грибы, вирусы и археи). B основе здоровья и благополучия человека лежат не только грибково-бактериальные взаимодействия, но и взаимодействия между кишечными вирусами (в т. ч. фагами) и бактериями, а также археями и бактериями [174, 175]. В целом, кишечные бактериом и виром более таксономически разнообразны и гетерогенны между индивидуумами, чем кишечный микобиом; факторы, связанные с географией, этнической принадлежностью и рационом хозяина, могут объяснить соответственно 30,8; 15,6 и 9,8% относительной изменчивости кишечного микобиома здоровых лиц, в то время как за остальные вариации отвечают неизученные факторы хозяина и окружающей среды [28, 176]. В настоящее время взаимосвязи между микробными компонентами в кишечнике выяснены слабо. Не менее важно и то, что взаимодействие между кишечными микробами и хозяином (такие как иммунитет, транскриптом, эпигеном, метаболом и питание) — более сложный уровень функциональных путей, которые еще предстоит изучить для улучшения здоровья человека.
Заключение
Результаты проведенных в последнее десятилетие исследований подтверждают ключевую роль кишечного микобиома в поддержании здоровья и развитии различных заболеваний человека совместно с бактериальным микробиомом. Сложные, многосторонние взаимоотношения между кишечными грибками, бактериями и иммунитетом хозяина лежат как в основе физиологического гомеостаза хозяина, так и патогенеза, прогрессирования и даже терапевтического исхода различных заболеваний. Большое разнообразие кишечных грибков играет различные роли в зависимости от заболевания и контекста, на которые влияют факторы окружающей среды и хозяина, включая остальной микробиом, рацион, урбанизацию, лекарства, возраст, генетику и иммунную систему. В будущем возможно использование кишечного микобиома для диагностики и прогнозирования заболеваний, а также в качестве терапевтического вмешательства как части прецизионной медицины. Опираясь на базовые, трансляционные и клинические знания о микобиоме и микробиоме кишечника и патофизиологии человека, будущие терапевтические возможности, направленные на микробиомы или основанные на них, нужно коренным образом изменить и адаптировать для синергетического воздействия на кишечные грибы и бактерии с целью повышения клинической эффективности.
