Хроническая болезнь почек: главное из исследований
Выявляя генетический риск, нарушая фиброз и останавливая воспаление
Оценка риска на основе генома для всех
Текущие оценки предполагают, что от одной четверти до половины риска развития хронической болезни почек (ХБП) у человека может быть связано с его генами. Однако в сборниках генетических данных, на которых основаны эти оценки, преобладают лица европейского происхождения, что сводит на нет усилия по разработке прогностических тестов, которые можно широко применять в разных популяциях. Это представляет особую проблему, поскольку известны различия в факторах риска между расовыми и этническими группами. В частности, люди африканского происхождения с большей вероятностью являются носителями вариантов гена APOL1, которые повышают вероятность развития ХБП. Команда под руководством ученых из Колумбийского университета в Нью-Йорке разработала шкалу мультигенного риска, которая может выявить людей с наибольшим риском развития ХБП. В ее основе лежат комбинации эффектов нескольких вариантов геномной последовательности, связанных с заболеванием, — независимо от расы или этнической принадлежности человека.
Авторы начали с выявления вариантов генов, которые имеют сильную статистическую связь с нарушением функции почек, на основе метаанализа генетических данных одного миллиона участников в 2019 году. Поскольку это исследование имело уклон в сторону лиц европейского и восточноазиатского происхождения, авторы настоящего исследования также включили данные о риске от когорты из 7158 доноров африканского происхождения из британского биобанка. В частности, они сосредоточились на специфических факторах риска, связанных с вариантами гена APOL1.
В дальнейшем исследователи проверили эффективность оценки риска на 15 когортах различного происхождения. В их число вошли шесть групп участников африканского происхождения, а также четыре когорты восточно- и южноазиатского происхождения и две когорты латиноамериканцев. Авторы последовательно оценивали все популяции, и у лиц, оказавшихся в числе верхних 2% риска, вероятность диагностирования ХБП оказалась в три раза выше. Будущие версии такой системы оценки могут помочь профилактически предотвращать развитие ХБП у людей с высоким риском и, возможно, указывать направление для скрининга и отбора органов для донорства почки.
Nature Med. 28, 1412–1420 (2022).
Гуманизация исследований болезней почек
Одна из проблем в разработке эффективных терапевтических подходов для лечения ХБП состоит в том, что модели на животных не полностью отражают биологию человека и далеко не всегда способны предсказать эффективность и безопасность для людей. Исследование, проведенное учеными из Массачусетской больницы общего профиля в Бостоне и их коллегами, показывает, как модели органов человека на основе стволовых клеток, воспроизводящие ключевые структурные и функциональные особенности почки, могут дать представление об основных механизмах ХБП, которые могут иметь клиническое значение.
Начав с индуцированных плюрипотентных стволовых клеток — клеток взрослого организма, которые были экспериментально переведены в эмбрионоподобное состояние, — авторы применили систему культивирования, которая способствовала созреванию и самоорганизации клеток в почечные органоиды. Органоиды содержали характерные трубчатые структуры, характерные для тканей почки и окруженные поддерживающими клетками, включая фибробласты и перициты. Эта модель позволила авторам исследовать ранние стадии ХБП, когда неоднократное повреждение приводит к состоянию, при котором нарушенная структура почечных канальцев не полностью восстанавливается, открывая путь для дальнейшего повреждения тканей и фиброза.
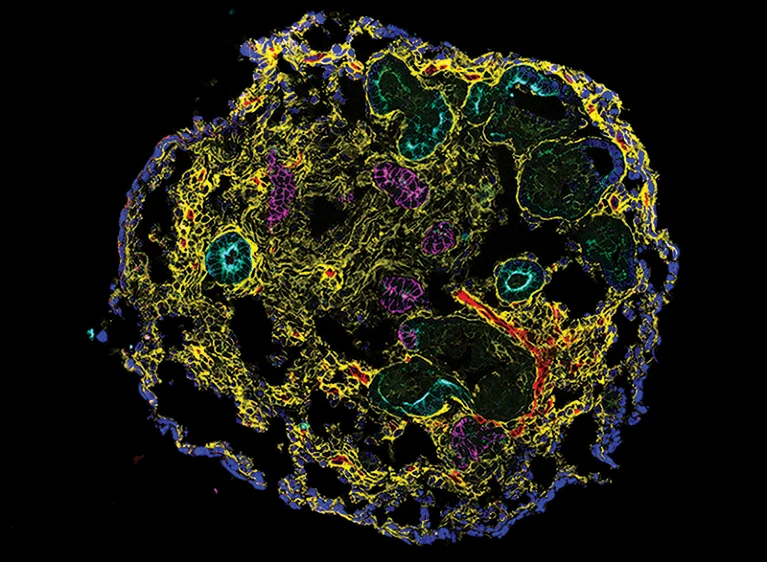
Ограноид почки, содержащий эпителиальные клетки нефрона и строительные клетки. N. Gupta et al. Sci. Transl. Med. 14, eabj4772 (2022).
Воссоздав эти условия в органоидах, авторы проанализировали изменения в экспрессии генов поврежденных клеток канальцев. Их данные выявили несколько генов репарации ДНК, которые активировались во время успешного восстановления тканей, но экспрессия которых резко снижалась, если канальцы восстанавливались не полностью. Затем авторы подтвердили такой сдвиг экспрессии фермента репарации под названием FANCD2 в образцах биопсии.
На основании этих данных они обработали свою органоидную модель препаратом, который стимулирует активность FANCD2, продемонстрировав, что такое воздействие может предотвратить атрофию и фиброз поврежденных канальцев. Эти эксперименты подчеркивают перспективность использования моделей на основе органоидов человека в качестве инструмента для исследования ХБП.
Sci. Transl. Med. 14, eabj4772 (2022).
Иммунные агенты при фиброзе почек
Формирование и накопление фиброзной рубцовой ткани играет центральную роль в прогрессировании ХБП, и в основе этого процесса лежит хорошо известный воспалительный компонент. Тем не менее, то, какие именно субпопуляции иммунных клеток задействованы и как эти клетки взаимодействуют с тканью почек, изучено плохо.
Группа исследователей из Пенсильванского университета в Филадельфии и их коллеги решили этот вопрос с помощью эксперимента с применением углубленного сравнительного транскриптомного анализа. Матричную РНК десятков тысяч клеток из ткани почек здоровой мыши сравнивали с мРНК, полученной из клеток почек животной модели ХБП для выявления различий в активации и ингибировании генов. Используя для классификации разных типов клеток экспрессию генов, авторы обнаружили, что фиброзная ткань почек имеет тенденцию к сильно повышенному содержанию базофилов. Это редкий подтип воспалительных клеток, который ранее связывали с иммунными заболеваниями почек, но не конкретно с ХБП.
Последующий анализ показал, что при фиброзе почек клетки в проксимальных канальцах — важной части фильтрационного аппарата почки — экспрессируют белок, называемый CXCL1, который может активно рекрутировать базофилы. Впоследствии они высвобождают множество сигнальных молекул, провоцирующих воспаление. Этот механизм был дополнительно подтвержден на образцах тканей человека с четко определяемым увеличением экспрессии CXCL1 и агрегацией базофилов в фиброзных почках. Исследователи проверили свои результаты на мышах и обнаружили, что воздействие, которое либо избирательно устраняет базофилы, либо блокирует эффект их воспалительных сигналов, может уменьшить или даже предотвратить фиброз. Выявление специфической субпопуляции иммунных клеток, лежащей в основе прогрессирования заболевания, должно позволить разработать терапевтические методы, сохраняющие здоровье и функцию почек.
Nature Immunol. 23, 947–959 (2022).
Шанс остановить воспаление
Сфингозин-1-фосфат (С1Ф) представляет собой провоспалительную биомолекулу, которая способствует образованию фиброзной ткани в почках при прогрессировании ХБП. Для инактивации С1Ф можно использовать лекарственные препараты, ингибирующие его рецептор, но было показано, что они плохо действуют на людей с заболеваниями почек и могут вызывать серьезные побочные эффекты.
Исследователи из университета Вирджинии в Шарлоттсвилле и их коллеги проанализировали роль С1Ф в развитии фиброза почек и определили механизм, с помощью которого они могут эффективно нарушить этот процесс. Особое внимание они уделили роли периваскулярных клеток почек, которые выстилают почечные капилляры и тесно связаны с иммунной системой. Более ранние работы также убедительно показали, что выработка С1Ф в этих клетках напрямую связана с началом фиброза.
Сначала авторы подтвердили, что ингибирование продукции С1Ф этими почечными клетками подавляет провоспалительную реакцию, которая обычно возникает в ответ на повреждение почек. Затем они определили, что ответ зависит от белка под названием Spns2. Периваскулярные клетки используют Spns2 для выделения новосинтезированного С1Ф во внеклеточное пространство, где он может связываться со своим рецептором и тем самым запускать воспаление.
Это позволило предположить, что существует возможность разорвать последовательность иммунологических событий, ведущих к фиброзу. Авторы протестировали обнаруженный недавно низкомолекулярный ингибитор Spns2 и показали, что он может смягчать воспалительную реакцию в культивируемых периваскулярных клетках человека. Они также наблюдали защитное действие этого препарата на модели фиброза почек у грызунов, тогда как существующее лекарство, блокирующее рецептор С1Ф, такого эффекта не имело. Еще неизвестно, удастся ли перенести эти терапевтические эффекты на людей с ХБП, но первые результаты показывают, что направленное воздействие на Spns2 может открыть многообещающий путь для предотвращения или замедления фиброза.
Sci. Transl. Med. 14, eabj2681 (2022).
Защита здоровья сердца
Многие люди с ХБП также страдают гипертонией — состоянием, которое может еще больше усугубить заболевание почек, а также ухудшить состояние сердечно-сосудистой системы. Клиническое испытание, проведенное исследователями из университета Индианы в Индианаполисе, в настоящее время демонстрирует, что лекарство, уже применяемое для лечения высокого кровяного давления, также может обеспечить безопасную и значимую защиту людям с прогрессирующей ХБП.
Хлорталидон — мочегонное средство, которое, как известно, снижает риск инсульта и сердечной недостаточности, но относительно назначения его или родственных соединений людям с поздней стадией ХБП были некоторые опасения. Чтобы проверить, может ли хлорталидон принести пользу людям на этой стадии заболевания, авторы рандомизировали 160 человек с тяжелой ХБП и высоким кровяным давлением для приема хлорталидона либо плацебо в течение 12 недель наряду со стандартным курсом других антигипертензивных препаратов.
В терапевтической группе по сравнению с группой плацебо наблюдалось заметное снижение артериального давления в течение четырех недель после начала лечения. Разница в артериальном давлении между двумя группами сохранялась на протяжении всего исследования и оставалась статистически значимой через 12 недель, когда лечение было прекращено. После этого кровяное давление в группе лечения снова начало расти. У тех, кто принимал хлорталидон, также наблюдались другие признаки клинического улучшения, в том числе потеря веса и снижение уровня различных биомаркеров риска сердечной недостаточности в крови. Важно отметить, что в терапевтической группе наблюдалось лишь незначительное усиление побочных эффектов в целом, с меньшим количеством серьезных событий, требующих госпитализации, нежели в группе плацебо.
Хотя это было небольшое исследование с недостаточным числом женщин и лиц азиатского или латиноамериканского происхождения, его данные говорят о том, что хлорталидон может защищать функцию сердца и почек у людей с ХБП. Авторы говорят, что необходимо провести фазу III клинических испытаний, чтобы продемонстрировать эффективность препарата на большей когорте.
