Доказательная медицина нового поколения

Аннотация
В последнее время достижения в области портативных технологий, науки о данных и машинного обучения начали трансформировать доказательную медицину, предлагая заманчивую возможность заглянуть в будущее «глубинной» медицины следующего поколения. Несмотря на ошеломляющие успехи в фундаментальной науке и технике, основные области медицины отстают в вопросах внедрения результатов новых открытий в клиническую практику. Хотя пандемия COVID-19 выявила внутренние системные ограничения в ландшафте клинических испытаний, она также способствовала некоторым положительным изменениям, включая разработку нового дизайна испытаний и переход к более ориентированной на пациента и интуитивно понятной системе сбора данных. В этой связи автор статьи делится своим эвристическим видением будущего клинических испытаний и доказательной медицины.
Главное
Последние 30 лет стали свидетелями беспрецедентных, захватывающих дух достижений в научных исследованиях — от улучшения понимания патофизиологии основных процессов течения заболеваний и изучения клеточных механизмов с атомарным разрешением до разработки методов лечения, которые изменяют течение и исходы заболеваний во всех областях медицины. Более того, эти достижения стимулировали экспоненциальный прогресс в области геномики, иммунологии, протеомики, метаболомики, микробиома кишечника, эпигенетики и вирусологии параллельно с наукой о больших данных, вычислительной биологией и искусственным интеллектом (ИИ). Кроме того, зарождение технологий CRISPR-Cas9 открыло множество заманчивых возможностей для персонализированной медицины.
Несмотря на эти достижения, в большинстве областей медицины их внедрение в клиническую практику, а также клинические исследования отстают. Для всех заинтересованных сторон ландшафт разработки лекарств и клинических испытаний по-прежнему остается дорогостоящим и несет высокий риск неудач. В частности, для лекарств на ранней стадии развития уровень отсева довольно высок, и более двух третей соединений не преодолевают «долину смерти» между исследованием и клиническим применением [1, 2]. Чтобы успешно довести препарат до прохождения всех фаз разработки, требуется более 1,5–2,5 миллиарда долларов [3, 4]. В сочетании с присущими системе здравоохранения недостатками и неэффективностью это приводит к кризису в клинических исследованиях. Таким образом, необходимы инновационные стратегии для привлечения пациентов и получения необходимых данных для продвижения новых достижений в клинику, чтобы они могли улучшить здоровье населения. Для этого традиционные модели клинических исследований должны уступить место авангардным идеям и новому дизайну испытаний.
До пандемии COVID-19 проведение клинических исследований оставалось почти неизменным в течение 30 лет, а некоторые нормы и правила проведения исследований не подвергались сомнениям, хотя и были архаичными. Пандемия выявила многие системные ограничения, присущие проведению испытаний [5], и вынудила соответствующие исследовательские предприятия переоценить все процессы — таким образом, она разобщила, катализировала и ускорила появление инноваций в этой области [6, 7].
Хронические заболевания продолжают влиять на миллионы жизней и создают для общества серьезные финансовые проблемы [8], но исследования затрудняет тот факт, что большая часть данных хранится в обособленных базах данных. Узкая специализация клинических профессий привела к разрозненности внутри специальностей и между ними; кажется, что все специализированные области медицины работают совершенно независимо. Тем не менее, наилучшая клиническая помощь предоставляется при междисциплинарном подходе, когда вся необходимая информация доступна и удобна. Более качественные клинические исследования для создания совместной модели, обеспечивающей высококачественную междисциплинарную помощь и постоянные инновации в медицине должны использовать знания, полученные в каждой из специальностей. Поскольку в медицине многие дисциплины рассматривают одни и те же заболевания по-разному (например, для специалистов по инфекционным заболеваниям COVID-19 — прежде всего вирусное заболевание, а для специалистов в области кардиологии — воспалительное), междисциплинарные подходы должны учитывать подходы других дисциплин. Хотя единая модель может не подходить для всех заболеваний, междисциплинарное сотрудничество сделает систему более эффективной для получения наилучших доказательных данных.
В течение следующего десятилетия применение машинного обучения, глубоких нейронных сетей и мультимодального биомедицинского ИИ должно способствовать многостороннему продвижению клинических исследований, включая открытие лекарств, интерпретацию изображений, оптимизацию электронных медицинских карт, улучшение рабочего процесса и, в конечном счете, усовершенствовать общественное здравоохранение (рисунок 1). Кроме того, инновации в области портативных устройств, сенсорных технологий и архитектуры Интернета медицинских вещей (IoMT) открывают множество возможностей (и проблем) для сбора данных [9]. В этой перспективе автор делится своим эвристическим видением будущего клинических испытаний и получения данных, а также обсуждает основные моменты, которые нуждаются в улучшении, в областях дизайна и проведения клинических испытаний и сбора данных.
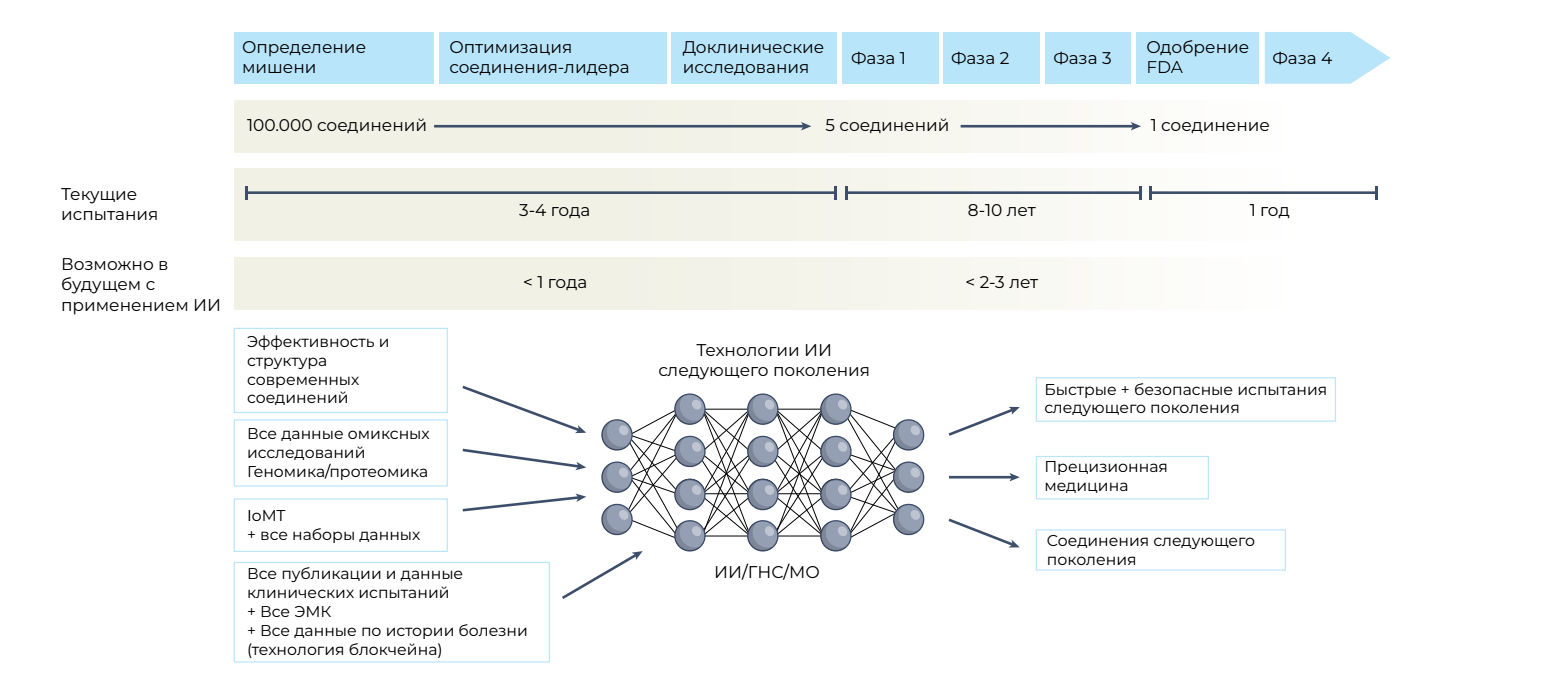
ГНС — глубокая нейронная сеть; ЭМК — электронные медицинские карты; IoMT — Интернет медицинских вещей; МО — машинное обучение.
Дизайн клинических испытаний
Дизайн исследования — один из самых важных его этапов: более совершенный дизайн протокола способствует более качественному проведению клинических испытаний и более быстрому принятию решения «пройдено / не пройдено». Более того, потери от плохо спланированных, неудачных испытаний носят не только финансовый, но и социальный характер.
Проблемы с рандомизированными контролируемыми испытаниями
Рандомизированные контролируемые испытания (РКИ) стали золотым стандартом для получения доказательств во всех областях медицины, поскольку они позволяют объективно оценить эффект лечения без влияния искажающих факторов. В идеале каждое медицинское воздействие или вмешательство должно быть проверено с помощью мощного и хорошо контролируемого РКИ. Тем не менее, проведение РКИ не всегда осуществимо из-за проблем со своевременным получением данных, стоимости, дизайна для узких групп населения, исключающего возможность обобщения, этических барьеров и времени, необходимого для проведения этих испытаний. К моменту завершения и публикации РКИ быстро устаревают и в некоторых случаях уже неприменимы к текущему контексту. Только в области кардиологии 30 000 РКИ не были завершены из-за проблем с набором участников [10]. Более того, испытания разрабатываются изолированно, при этом многие клинические вопросы остаются без ответа. Таким образом, традиционные парадигмы дизайна испытаний должны адаптироваться к современным стремительным достижениям в области геномики, иммунологии и прецизионной медицины [11].
Прогресс в дизайне клинических испытаний
Для клинической практики необходимы данные высокого качества, традиционно получаемые с помощью РКИ [12]. За последнее десятилетие был достигнут значительный прогресс в разработке, проведении и внедрении основных протоколов (общих протоколов, которые применяются к нескольким субисследованиям), что привело ко многим изменениям в практике и существенно уменьшило стагнацию РКИ. Кроме того, основные протоколы могут включать параллельные интервенционные исследования при одном или нескольких заболеваниях, определяемых биомаркерами или нозологической формой [12]. В основные протоколы включены четыре различных класса исследований: зонтичное исследование, корзинное исследование, платформенное исследование и основное обсервационное исследование (ООИ) (рис. 2). Каждый из них представляет собой уникальный дизайн исследования, который может включать независимые группы с контрольными воздействиями и анализироваться индивидуально и/или коллективно и обладает дополнительной гибкостью [13, 14]. Область онкологии возглавила эти усилия в большей степени, чем любая другая дисциплина, благодаря достижениям в области геномики (для выявления молекулярных изменений), открытию терапевтических средств и быстрому применению в клинике, став началом эры прецизионной онкологии.
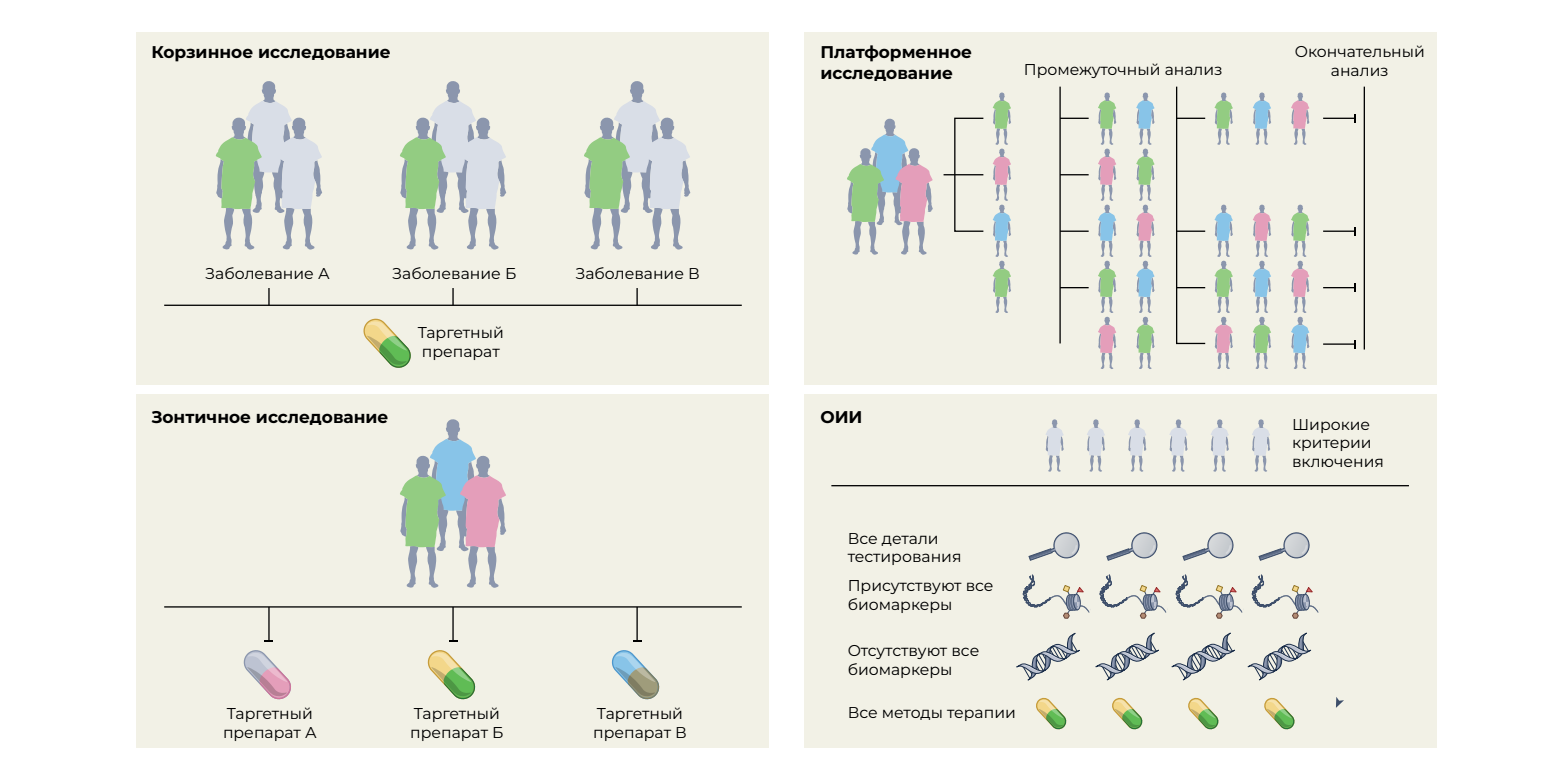
Зонтичное исследование
Зонтичные испытания представляют собой исследования, в которых оценивают несколько таргетных методов лечения одного и того же заболевания, стратифицированных по молекулярным изменениям. В качестве примеров можно привести исследование рака молочной железы I-SPY (Investigation of Serial Studies to Predict Your Therapeutic Response With Imaging And Molecular Analysis) и Lung-MAP (Lung Cancer Master Protocol) [15, 16].
Корзинное испытание
Корзинные испытания — это независимые от гистологии исследования, в которых таргетная терапия оценивается при нескольких типах заболеваний, которые все имеют одну и ту же основную молекулярную аберрацию. Например, исследование VE-Basket (где VE обозначает вемурафениб) [17], исследование Rare Oncology Agnostic Research (ROAR) [18], исследование ARROW [19] и испытания LIBRETTO-001 [20, 21] привели к одобрению нескольких препаратов в гистологических исследованиях в определенных группах населения, определяемых биомаркерами, как с применением гистологических исследований, так и без них.
Платформенное исследование
Это проекты многоэтапных исследований, в которых несколько групп воздействия сравниваются с общей контрольной группой в контексте одного и того же основного протокола. Кроме того, они могут быть бессрочными/«бессмертными» (без определенной даты окончания) и более эффективными, чем традиционные испытания, благодаря общей контрольной группе, которая гарантирует, что в интервенционные/экспериментальные группы будет включена большая доля пациентов, чем в контрольные группы. Ярким примером служит платформенное исследование RECOVERY (The Randomised Evaluation of COVID-19 Therapy): это испытание, изменившее клиническую практику, установило, что дексаметазон является эффективным средством лечения COVID-19 [22], а гидроксихлорохин неэффективен. Платформенные исследования имеют гибкий дизайн и не требуют общей контрольной группы; основная идея состоит в том, что группы воздействия могут быть добавлены к текущим испытаниям, например, как в британском платформенном исследовании plasmaMATCH (The UK Plasma Based Molecular Profiling of Advanced Breast Cancer to Inform Therapeutic CHoices) [23]. Хотя вышеупомянутые испытания были разработаны в контексте создания лекарственных средств для лечения онкологических и инфекционных заболеваний, масштабы платформенных испытаний можно было бы использовать в других областях, таких как клиническая психология и неврология [24]. Такие испытания также могут применяться для цифровых подходов в области психического здоровья и быть легко реализованы в условиях ограниченных ресурсов [24].
ООИ
ООИ — это проспективное обсервационное исследование, которое включает широкий набор пациентов независимо от сигнатуры биомаркеров и собирает исчерпывающие данные о каждом участнике [14, 25]. ООИ представляет собой комбинацию дизайна основного интервенционного исследования и проспективного обсервационного исследования, а также попытки гибридизации мощности основных интервенционных протоколов, основанных на биомаркерах, с широтой реальных данных (РД) [14, 25]. Эта стратегия может хорошо подходить для сбора потенциальных РД по многим специальностям; одним из примеров является ООИ ROOT (Registry of Oncology Outcomes Associated with Testing and Treatment) [14].
Разработка биомаркеров и определение конечных точек
Разработка биомаркеров способствовала прогрессу в дизайне клинических испытаний, и за последнее десятилетие беспрецедентные достижения в области геномики и иммунологии привели к одобрению нескольких методов таргетной терапии и иммунотерапии на основе биомаркеров. В 2021 году фактически более двух третей одобрений лекарственных препаратов подтвердились данными генетики человека [26]. Онкология и генетика получили огромную пользу от этих достижений, но одобрение лекарств на основе биомаркеров в таких областях, как кардиология, нефрология и пульмонология, все еще отстают.
Чтобы ускорить разработку лекарств и клинические испытания при каждом серьезном заболевании, потребуется определить биомаркеры (будь то клинические, патологические или физиологические) и контекст их применения для каждого патологического процесса, а также четко обозначить конечные точки исследований [27]. Биомаркеры могут быть диагностическими или прогностическими и давать информацию для ранней разработки лекарств, выбора дозы и дизайна испытаний. Кроме того, биомаркеры могут помочь ускорить фундаментальную науку и открытие лекарственных препаратов — все это с конечной целью улучшения здоровья пациентов [28]. Однако уровень доказательности биомаркера во многом зависит от контекста его использования.
В дополнение к биомаркерам в каждой дисциплине необходимо определить области высшего приоритета для исследований и выявить наиболее важные конечные точки для ответа на приоритетные вопросы исследования. Конечные точки — это показатели здоровья и/или заболевания, которые служат разным целям в зависимости от фазы исследования [28, 29]. Помимо клинических и нормативных конечных точек, также быстро появляются оценки результатов пациентами и цифровые конечные точки.
Цифровые конечные точки
Цифровые конечные точки — это данные, сгенерированные датчиками и собранные за пределами клинической среды в контексте повседневной жизни пациентов, например, с помощью микрофонов смартфонов для мониторинга снижения когнитивных функций у людей с болезнью Альцгеймера или мониторов умных часов для оценки эффективности лекарств у людей с серповидноклеточной анемией [29]. Это очень интересная область медицины, поскольку она может позволить отслеживание опыта пациента в реальном мире. Более того, с возрастанием количества децентрализованных исследований по многим специальностям удаленный мониторинг будет расширяться. Например, в недавнем исследовании была разработана модель ИИ для выявления и отслеживания прогрессирования болезни Паркинсона (для которой нет биомаркеров) на основе ночных дыхательных сигналов с помощью неинвазивных измерений в домашних условиях. Это говорит о том, что ИИ может быть полезен для оценки рисков перед клинической диагностикой заболевания [29, 30]. Кроме того, цифровой скрининг мерцательной аритмии с помощью интеллектуальных устройств широко оценивался в крупномасштабных исследованиях, включая кардиологические исследования Apple [31], Huawei [32] и Fitbit [33]. В общей сложности в этих обсервационных исследованиях без привязки к конкретному медицинскому учреждению приняли участие более миллиона человек, что является поразительным достижением, а рандомизированное исследование показало превосходство цифрового выявления мерцательной аритмии по сравнению с традиционным способом [34].
Цифровая характеристика и оценка клинического состояния должны быть стандартизированы и согласованы в ходе междисциплинарного сотрудничества и при участии регулирующих органов. Необходим также консенсус для определения характеристики промежуточных и суррогатных конечных точек для основных хронических заболеваний. Это требует специализированного включения нескольких уровней данных, таких как геномные, протеомные и основанные на генотипе и фенотипе клинические данные и измерения, специфичные для заболевания, в дополнение к слою функциональных данных [26]. Национальные институты здравоохранения (NIH) и Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) разработали ресурсы BEST (Biomarkers, EndpointS and other Tools — «Биомаркеры, конечные точки и другие инструменты») для прояснения неоднозначности биомаркеров и конечных точек. Это «живой документ», который постоянно обновляется по мере изменения стандартов и фактических данных [35], разъясняет важные определения и описывает некоторые иерархические отношения, связи и зависимости между терминами.
Проведение клинических испытаний
Компонентами проведения клинического исследования являются выполнение протокола; отбор пациентов, набор, мониторинг и удержание; обеспечение соблюдения отчетности по безопасности и постоянный обзор и анализ данных. Фармацевтическая промышленность и сектор здравоохранения вкладывают значительные ресурсы в проведение клинических испытаний, но необходимы срочные изменения, чтобы усовершенствовать этот процесс. Кроме того, темпы, с которыми проводятся клинические испытания, слишком невелики, чтобы соответствовать достижениям исследований в каждой области; таким образом, необходима поэтапная высокотехнологичная трансформация каждого компонента.
Одной из положительных сторон пандемии стало то, что она вынудила систему перенаправить клинические испытания, сделав их более ориентированными на пациента, чем раньше, тем самым придав большее значение основному субъекту клинических исследований [36] (рис. 3). Это привело к распространению децентрализованных, цифровых, дистанционных и «виртуальных» испытаний (которые позволяют пациентам получать доступ к испытаниям независимо от их географического положения), а также к концепциям «больницы на дому» и мониторинга на дому [37]. Такому быстрому прогрессу способствовало руководство со стороны регулирующих органов [38]. Принятие подхода на основе ИИ для улучшения качества обслуживания пациентов может еще больше повысить точность оценок и обеспечить соблюдение протоколов [39]. Хотя цифровизация, виртуализация и децентрализация не являются панацеей от кризиса клинических исследований, они могут повысить их эффективность, которая может оказать значительное и долгосрочное влияние на последующие этапы.
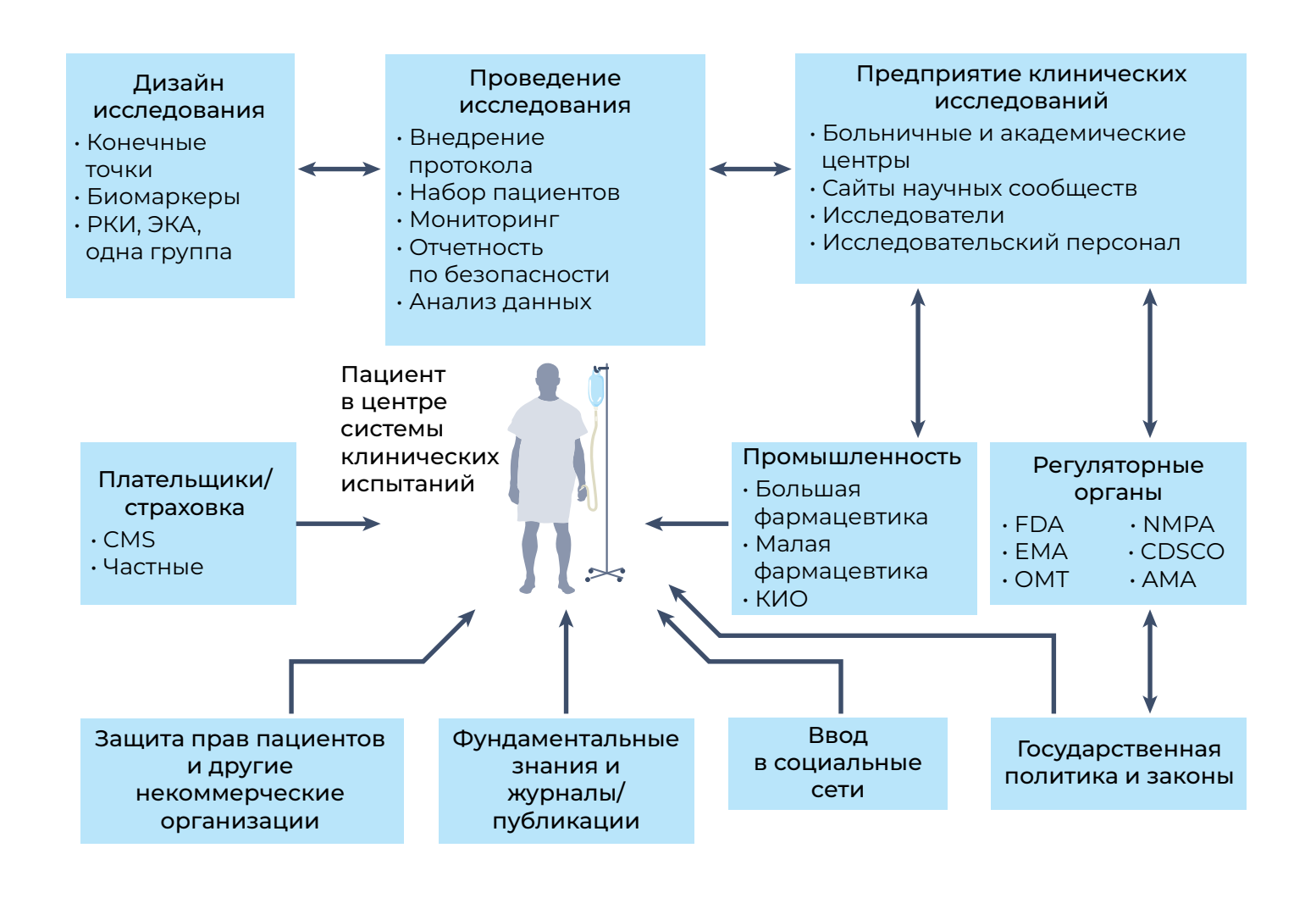
AMA — Африканское агентство по лекарственным средствам; CDSCO — Центральная организация по контролю за стандартами лекарственных средств (Индия); CMS — Центры по оказанию медицинской помощи Medicare и Medicaid; ВКГ — внешняя контрольная группа; EMA — Европейское агентство по лекарственным средствам; ОМТ — оценка медицинских технологий; NMPA — Национальное управление медицинской продукции (Китай).
В набор пациентов вносят огромный вклад врачи, члены медицинских бригад и клинические исследователи в академических центрах и других центрах регистрации исследований. Кроме того, высокоэффективные и высокофункциональные центры (например, крупные академические центры передового опыта) часто имеют портфолио исследований и эффективно проводят скрининг пациентов, поступающих в систему. Однако таких центров меньшинство, и большая часть центров клинических испытаний сталкивается с нехваткой персонала и другими сложностями.
Клинические испытания новых лекарственных средств
Эффективность и сотрудничество в исследовательской организации клинических испытаний являются важными составляющими их успеха. Основными составляющими клинических испытаний новых лекарственных средств являются пациенты, академические центры, отраслевые спонсоры (крупные и малые фармацевтики), спонсоры правительственных/кооперативных групп, регулирующие органы, организации по защите интересов пациентов и контрактные исследовательские организации (КИO), и все они должны работать, помещая пациента в центр вселенной клинических испытаний (рис. 3). Более того, вся эта система нуждается в цифровой перестройке, поскольку многие сайты все еще используют папки для протоколов, дневники с ручкой и бумагой, факсы между сайтами, неструктурированные данные и системы программного обеспечения, которым уже несколько десятков лет. Регистрационные клинические испытания должны хорошо управляться изо дня в день с тщательным сбором и мониторингом электронных данных. Интеграция технологии блокчейна в систему управления клиническими испытаниями могла бы укрепить доверие к процессу клинических испытаний и облегчить регулирующий надзор [40].
Участие пациентов в клинических испытаниях имеет ключевое значение, поскольку испытания без пациентов невозможны. Организаторы клинических испытаний должны облегчить участие в них пациентов. Кроме того, решения врача и пациента о лечении основных заболеваний должны включать варианты клинических испытаний в качестве стандарта. Эти клинические испытания должны быть легкодоступны и должны гарантировать, что ни один пациент не будет исключен без необходимости; этого можно достичь с помощью служб сопоставления клинических испытаний и систем навигации. Кроме того, обучение клиническим испытаниям должно быть частью медицинского образования, чтобы их мог проводить разнообразный пул обученных исследователей и сотрудников всего предприятия здравоохранения.
Самое время
Сроки клинической разработки лекарств-кандидатов — это гонка со временем от подачи патентных заявок до окончательного одобрения FDA [41]. Сроки разработки лекарств в среднем составляют около 10 лет (рис. 1). Быстрота создания мРНК-вакцины против COVID-19 и таблеток нирматрелвира/ритонавира для перорального лечения COVID-19, которые были разработаны в течение года в режиме «скорости света», не должна быть исключением [42]. Полученный опыт следует положить в основу модели для удовлетворения нужд во множестве различных областей терапии. Две небольшие молекулы, вне периода пандемии ставшие рекордсменами по кратчайшему сроку разработки лекарственных препаратов, осимертиниб для терапии немелкоклеточного рака легкого (НМКРЛ) с мутацией EGFR (984 дня при ускоренном одобрении) и элексакафтор для лечения кистозного фиброза (1043 дня обычным путем) [41], показали, что это возможно.
Задержки на уровне регуляторных органов, замедляющие разработку лекарственных препаратов, потребовали создания таких программ, как ускоренный путь одобрения FDA, который был введен в 1992 году для борьбы с кризисом ВИЧ и СПИДа и с тех пор оказался полезен в узкоспециализированных областях, в частности — в прецизионной онкологии [43]. Для сокращения сроков предпродажного процесса было создано множество программ, включая приоритетную проверку, ускоренное рассмотрение и присвоение лекарствам статуса орфанных препаратов [44]. Тем не менее, вне этих программ сроки все еще остаются весьма длительными, и существует настоятельная необходимость решить эту проблему для всех заболеваний, поскольку скорость разработки лекарств имеет ключевое значение как для пациентов и врачей, так и для самих разработчиков лекарств.
Глобализация разработки лекарственных препаратов, согласование и мобильность
Хотя мандат FDA распространяется на население США, его влияние является глобальным, и функционально FDA является де-факто регулятором для всего мира. Другие регулирующие органы, такие как Европейское агентство по лекарственным средствам, Национальное управление медицинской продукции в Китае и Центральная организация по контролю за стандартами лекарственных средств в Индии, которые в общей сложности обслуживают более трех миллиардов населения мира, также становятся ключевыми игроками на глобальном фармацевтическом рынке. Кроме того, для ускорения сроков утверждения вакцин и лекарств и улучшения доступа к лекарствам, особенно для лечения новых инфекционных заболеваний, эндемичных для африканского континента, недавно (в 2019 году) было создано Африканское агентство по лекарственным средствам [45]. Все эти агентства должны иметь возможность работать автономно. Кроме того, существует острая необходимость в глобальном согласовании регулирующих органов для устранения существенного неравенства в доступе к лекарствам. В идеале для обеспечения доступности и универсальности клинические испытания новых методов лечения должны проводиться во всем мире [46]. Тем не менее, реальность такова, что клинические испытания, в том числе РКИ, невозможно проводить в каждой стране для получения конкретных данных для населения этой страны. В настоящее время набирает обороты получение данных с применением анализа мобильности, подразумевающего возможность обобщать выводы из выборки исследования в одной стране на целевую группу населения в другой стране, где исследование не проводилось [47, 48]. Анализы транспортабельности могут предоставить некоторые доказательства внешней валидности, которые можно использовать для оценки местных нормативных требований и технологий здравоохранения [48].
Получение данных в клинических исследованиях
Клинические исследования редких заболеваний
Поскольку научные достижения стимулируют клинические испытания, исследования онкологических и многих редких заболеваний разрабатываются и проводятся в небольших или определяемых генетически или биомаркерами подмножествах. Кроме того, новые методы получения доказательств клинической пользы могут ускорить проведение клинических испытаний и предоставить людям с редкими заболеваниями доступ к новым терапевтическим соединениям. В отдельно взятый момент времени редкие заболевания поражают, по оценкам, 263–446 миллионов человек во всем мире, все чаще становясь огромным бременем для системы здравоохранения [49]. Клинические испытания в этом контексте сопряжены со своими проблемами, связанными с редкостью состояний и неполными анамнестическими данными [50]. Однако замечательные достижения в области молекулярной биологии в сочетании с законодательством, стимулирующим развитие терапии орфанных заболеваний, способствовали прогрессу. Нормативная гибкость в применении таких программ, как программа ускоренного утверждения, возрастает, и существуют сценарии, при которых в испытаниях использовались внешние контрольные группы на основе РД.
Например, FDA в ускоренном порядке одобрило алпелисиб (Vijoice, Novartis) для взрослых и детей старше двух лет, которым требуется системная терапия заболеваний спектра избыточного роста, связанных с мутациями в гене PIK3CA [51]. Интересно, что эффективность оценивали с использованием ретроспективного обзора РД из EPIK-P1 (NCT04285723) — клинического исследования с одной группой, в котором люди с заболеваниями спектра избыточного роста, связанными с PIK3CA, получали алпелисиб в рамках программы расширенного доступа для благотворительно-испытательного использования. Заявка на это одобрение была создана с использованием пилотной программы Oncology Review в режиме реального времени [52], которая упростила представление данных перед подачей всей клинической заявки, а также Assessment Aid [53] — добровольное предоставление заявителем для облегчения оценки со стороны FDA. В результате заявку рассмотрели в приоритетном порядке, лекарственное средство получило статус «прорыв в терапии» и орфанного препарата.
Односубъектные исследования
В эпоху индивидуализированной геномной медицины односубъектные исследования возникают как инструмент для изучения потенциально смертельных редких заболеваний. В таком испытании отдельное лицо используется в качестве единицы исследования для оценки эффективности и/или побочных эффектов различных воздействий с помощью объективных, основанных на данных, критериев [54]. Например, терапия антисмысловыми олигонуклеотидами была разработана и оценена на одном пациенте со смертельным генетическим нейродегенеративным заболеванием, известным как нейрональный цероидный липофусциноз CLN7 (форма болезни Баттена) [55]. Другой пациент (который оказался врачом) с идиопатической болезнью Кастлемана, резистентной к терапии блокаторами IL-6, определил причинно-следственные молекулярные изменения в своем собственном заболевании, чтобы разработать персонализированную терапию [56]. В еще одном примере было оценено быстрое повышение дозы селективного ингибитора RET у одного пациента с высокорезистентной медуллярной карциномой щитовидной железы для преодоления механизма устойчивости, присущей этому пациенту [57].
Эти сенсационные парадигмы открытия новых лекарств и внедрения их в клиническую практику поднимают важные вопросы. Среди них, например, какой уровень доказательств необходим, прежде чем подвергать человека воздействию нового препарата, какие доказательства этот подход может дать для следующего пациента и какие проблемы могут возникнуть с обобщением полученных результатов [58]. Концепция медицинских аналоговых «цифровых близнецов», ориентированных на конкретного пациента, — это новая область исследований, которая потенциально может объединить полиномиальные данные (данные о механизмах заболеваний, историю болезни и возможности ИИ) и, вероятно, может способствовать применению односубъектных испытаний в будущем для дальнейшей персонализации медицины [37, 59, 60].
Данные из «реального мира»
Одним из основных критических замечаний ко всем клиническим исследованиям является то, что они не полностью представляют население «реального мира»; часто их ограничительные критерии и ограниченные анализы, предназначенные для ответа на конкретные вопросы, неприменимы к реальным пациентам. Таким образом, существует большой разрыв между миром испытаний и реальным миром, и были предприняты попытки его сократить [61]. Обычные испытания были разработаны на основе ошибочного представления о том, что регулирующие органы могут не учитывать более современные и разнообразные РД [61, 62].
Важно различать РД, которые относятся к данным, полученным в результате рутинной стандартной медицинской помощи [62], и «доказательства» из реального мира (ДРМ), формирующиеся из РД относительно потенциального использования продукта. ДРМ получаются на основе дизайна или анализа испытаний и не ограничивается рандомизированными испытаниями; вместо этого они исходят из практических испытаний и проспективных и/или ретроспективных обсервационных исследований [62, 63].
В рамках этой сферы РД и ДРМ все заинтересованные стороны обращаются за руководством к регулирующим органам. Как следствие, регулирующие органы приняли непосредственное участие и предоставили рекомендации и всеобъемлющую структуру, запущенную в рамках Закона о средствах лечения XXI века [62, 64]. Более того, FDA использует РД и ДРМ для постмаркетингового мониторинга безопасности, а страховые агентства начали применять такие данные для принятия решений о страховом покрытии [62]. Это было вызвано быстрым ускорением переноса множества потоков и слоев данных в электронные медицинские записи, а также в носимые устройства и биосенсоры, параллельно с новыми аналитическими возможностями (мультимодальный ИИ) для анализа огромного объема данных.
Данные из синтетических и внешних контрольных групп
РКИ считаются золотым стандартом для разработки лекарств и доказательств, поскольку они позволяют оценить эффекты лечения, которые могут быть отнесены к интересующей экспериментальной группе. Рандомизация в этих исследованиях снижает беспокойство по поводу смещающих факторов, устраняя систематический дисбаланс между группами с измеряемыми и неизмеряемыми прогностическими факторами [65]. Тем не менее, достижения в области геномики редких заболеваний и открытие редких видов злокачественных новообразований, вызванных онкогенами, привели к созданию конкретных таргетных методов лечения, оценка которых в РКИ может оказаться неосуществимой или неэтичной и способна задержать доступ пациентов к многообещающим методам лечения или тем, которые могут спасти им жизнь.
В таких случаях появляются варианты создания синтетических контрольных групп, имитирующих группы сравнения в РКИ. Синтетические контрольные группы являются внешними по отношению к рассматриваемому исследованию, и большинство из них создаются на основе РД [65]. Кроме того, РД получают из электронных медицинских карт, данных административных заявлений, регистров истории болезни и данных пациентов из многих источников, включая портативные устройства [65]. Синтетические контрольные группы также могут быть сформированы на основе данных предыдущих клинических испытаний (одиночных или объединенных). Это развивающаяся область, ориентированная на инновации, поскольку в настоящее время множество данных доступно из разнообразных источников.
В НМРЛ все чаще выделяются небольшие обусловленные онкогенами подмножества, что затрудняет проведение рандомизированных испытаний [66], а недавние разработки в области исследований НМРЛ иллюстрируют пользу синтетических контрольных групп. Например, слияния RET служат геномными факторами для 1–2% случаев НМРЛ; пралсетиниб служит селективным терапевтическим средством, направленным на RET, которое показывает многообещающие ответы даже у людей с поздними стадиями заболевания. Исследование ARROW (NCT03037385) представляет собой одногрупповое регистрационное исследование, проводившееся во всем мире для оценки пралсетиниба у пациентов с НМРЛ, позитивными по слитому гену RET [67, 68]. Это испытание показало относительное улучшение выживаемости при приеме препарата по сравнению с внешней контрольной группой стандартного лечения, состоящей из когорт РД, полученных из двух баз данных Flatiron Health [66]. Матрица для будущих исследований такого рода с использованием количественного анализа смещения показала, что сравнения между группой внешнего контроля и группой исследования надежны и способны противостоять таким трудностям, как отсутствие данных, потенциально худшие исходы в РД и остаточное смещение [66]. В целом, исследование представило данные об эффективности применения пралсетиниба в качестве терапии первой линии при НМРЛ с при наличии слитого гена RET.
Использование синтетических контрольных групп может ускорить разработку лекарств, и первоначальный скептицизм в отношении них возник в основном из-за отсутствия приоритета и указаний со стороны регулирующих органов. Эти опасения в настоящее время рассеиваются, поскольку синтетические контрольные группы недавно стали использоваться для одобрения лекарств от ультраредких заболеваний. Например, нейрофиброматоз — редкое заболевание, встречающееся у 1 из 3000 новорожденных. У пациентов развиваются плексиформные нейрофибромы, болезненные и изнуряющие, вызывающие нарушения моторных и нейронных функций. Ингибитор MEK селуметиниб был одобрен для педиатрических пациентов с симптоматическими неоперабельными плексиформными нейрофибромами на основе набора данных о 50 пациентах, участвовавших в педиатрическом исследовании SPRINT — испытании II фазы с одной группой пациентов, показавшем устойчивый объективный ответ и улучшение функциональных симптомов [65, 69, 70]. Группы сравнения из двух ранее проведенных исследований предоставили данные по анамнезу заболевания и выступали в качестве групп внешнего контроля; это помогло подтвердить, что спонтанные регрессии были редкостью, и что наблюдаемые ответы и улучшение симптомов представляли собой истинный терапевтический эффект [69].
Несмотря на этот прогресс, внешние контрольные группы — все еще новая концепция, и они преимущественно использовались для изучения истории болезни и, как правило, не рассматривались в качестве основных данных и не указывались на этикетках продуктов. Однако в будущем можно представить такой сравнительный анализ эффективности и группы сравнения в качестве основного доказательства для одобрения лекарственных препаратов. Проблемы в основном связаны с качеством и нехваткой данных, а также с неопределенностью в отношении того, соответствуют ли данные внешнего контроля цели исследования. Тем не менее, некоторые из этих затруднений можно преодолеть с помощью количественного анализа погрешностей и других методологий [66, 71].
Педиатрические клинические испытания
Хотя педиатрические исследования стоят в авангарде крупных достижений в медицине (ярким примером является экстракорпоральная мембранная оксигенация [72]) и расширили границы современной онкологии (например, в лечении детской лейкемии), внедрение инноваций в разработке новых лекарств в них часто задерживаются. Многие редкие и орфанные заболевания возникают преимущественно среди детей, и разработка лекарств для педиатрической популяции всегда была сложной задачей с оперативной, этической, статистической и методологической точек зрения [73, 74]. Это усугубляется ограниченным пониманием фундаментальной биологии, онтологии проявлений болезни, а также краткосрочной и долгосрочной безопасности продуктов [73, 74]. Кроме того, у маленьких детей, младенцев и новорожденных препараты в значительной мере применяются не по показаниям, поскольку клинические испытания провести практически невозможно, и крайне важно, чтобы доказательные данные высокого уровня были получены с помощью креативных подходов. Такие программы, как Закон о лучших лекарственных препаратах для детей (2002 года) и Закон о справедливости научных исследований в педиатрии (2003 года), ставшие постоянными в 2012 году в соответствии с Законом FDA о безопасности и инновациях, способствовали развитию педиатрической терапии и ускорили его [73]. Инновационные дизайны испытаний, РД и использование данных из других источников могут помочь в оценке соотношения риска и пользы и одобрении лекарств — как в случае препарата для лечения нейрофиброматоза типа 1 (NF1) [73].
Переосмысление будущего клинических испытаний
ИИ
Ландшафт ИИ в медицине за последнее время изменился, и его применение вскоре может стать повсеместным. Несколько РКИ количественно оценили преимущества ИИ в направлениях медицины, которые используют распознавание образов и интерпретацию изображений, таких как радиология (маммография и скрининг рака легких), кардиология (интерпретация электрокардиограмм [ЭКГ], функциональная оценка сердца и скрининг мерцательной аритмии), гастроэнтерология (интерпретация колоноскопии), патология (диагностика злокачественных новообразований), неврология (отслеживание развития бокового амиотрофического склероза и болезни Паркинсона), дерматология (диагностика поражений кожи) и офтальмология (скрининг заболеваний глаз) [75]. Однако большинство исследований ИИ сосредоточено на применении для «оказания клинической помощи», а не на «исследованиях клинических испытаний» [76].
Внедрение ИИ в клинические исследования идет медленнее, чем ожидалось, в основном из-за мнимого конфликта между ИИ и человеческим интеллектом. Тем не менее, следует проводить испытания для получения и интерпретации данных, а ИИ стоит использовать для усиления человеческого интеллекта, а не как нечто, заменяющее его [77]. Клинические испытания следующего поколения с использованием ИИ должны рассматривать сценарии «ИИ + человек», а не «ИИ против человека» [75, 78]. Для достижения стандартизированной и прозрачной отчетности по рандомизированным клиническим испытаниям с использованием ИИ предназначены руководящие принципы для протоколов клинических испытаний (Стандартные пункты протокола: рекомендации для интервенционных испытаний — расширение искусственного интеллекта [SPIRIT-AI]) и публикации (Консолидированные стандарты отчетности испытаний — расширение искусственного интеллекта [CONSORT-AI]) [79, 80] — и это только начало нового этапа модернизации клинических исследований.
Учитывая затраты времени и средств на разработку лекарств, каждый неудачный препарат на рынке представляет собой значительную потерю для системы разработки лекарств. Кроме того, на протяжении десятилетий значительные проблемы создавали некачественный дизайн испытаний, неоптимальный набор пациентов, плохая инфраструктура для проведения испытаний, их неэффективность и неэффективный мониторинг. ИИ может улучшить все этапы разработки лекарств — от создания соединения до полного цикла разработки препарата (рис. 1).
Проведение клинических испытаний во многих отношениях все еще находится в зачаточном состоянии. Например, в онкологических испытаниях измеряют несколько аспектов поражений в двух измерениях и отслеживают их во времени, а эффективность препарата оценивают по уменьшению этих поражений. Автоматизированные количественные оценки и искусственные нейронные сети могут помочь в автоматизированной быстрой обработке множественных поражений [81]. В кардиологических исследованиях основные показатели жизнедеятельности измеряются один раз в неделю в клинике, а в неврологических исследованиях пациенты в клинике заполняют вопросники. Теперь все эти данные можно динамически отслеживать в режиме реального времени с помощью технологии портативных датчиков. Применение ИИ в таких областях может в ближайшем будущем перевести медицину на качественно новый уровень. Кроме того, среди прочего, распознавание образов с использованием глубоких нейронных сетей может помочь в чтении сканов, изображений патологии и ЭКГ [37, 78].
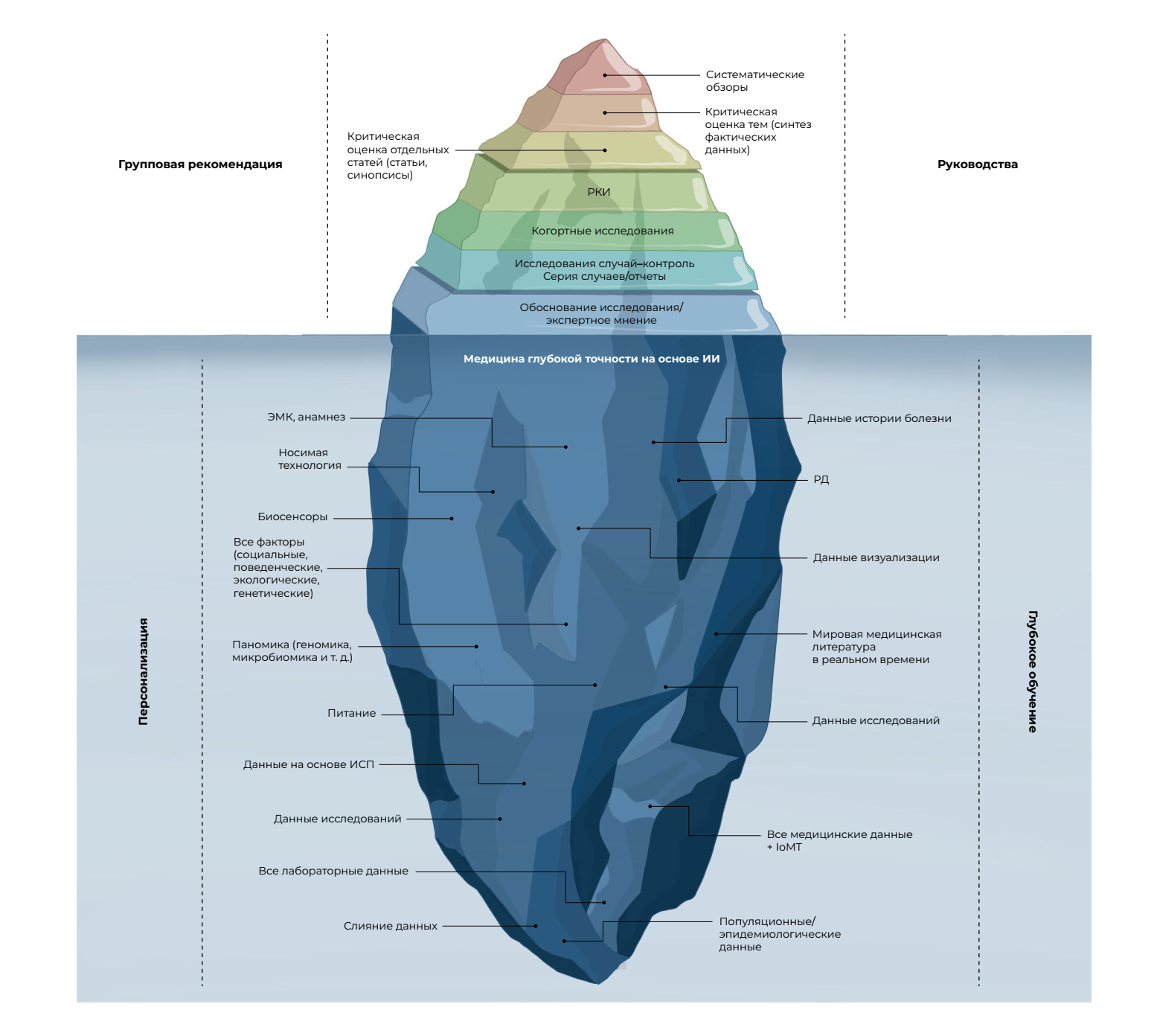
Нынешняя пирамида доказательной медицины представляет верхушку айсберга и дает мало доказательных данных для оказания помощи обычному пациенту (рис. 4). Следовательно, для создания «глубокой» доказательной медицины следующего поколения необходим глубокий синтез и объединение всех доступных данных. Основная задача в следующие два десятилетия будет заключаться в том, чтобы задействовать потенциал сбора многомерных данных [82] путем извлечения, сопоставления и обработки больших наборов данных истории болезни, геномного и других омиксных анализов, всех опубликованных клинических исследований, РД, данных с повсеместных интеллектуальных устройств и IoMT.
Партнерства при разработке лекарственных препаратов
В настоящее время фармацевтическая промышленность является основной движущей силой разработки лекарств, и соответствующие расходы намного превышают инвестиции любого национального агентства, такого как Национальный институт здравоохранения [61]. Существуют две категории клинических испытаний. Первая из них принадлежит «большой фарме», которая для проведения испытаний использует КИО (контрактные исследовательские организации — прим. перев.); такие испытания очень часто одобряются для регистрации FDA. Вторая категория охватывает академические клинические испытания, которые часто проводятся с очень ограниченным бюджетом, редко оценивают новые соединения и, таким образом, редко приводят к регистрации этих соединений FDA. В эпоху сокращения федерального финансирования исследований для разработки лекарств необходимо больше партнерств. Академические центры и общественные сайты имеют решающее значение для набора пациентов; однако изолированный менталитет повлиял на разработку лекарств и задержал доступ к жизненно важным методам лечения. Таким образом, сотрудничество между организациями по конкретным заболеваниям, академическими учреждениями, федеральными агентствами и группами защиты интересов пациентов имеет решающее значение для улучшения здоровья населения (рис. 3). Поскольку фармацевтическая промышленность не решается инвестировать огромные суммы с ограниченной финансовой отдачей, особенно в отношении редких заболеваний, федеральные агентства разработали программы, стимулирующие разработку лекарств от редких болезней [1]. Более того, организации, занимающиеся проблемами заболеваний, сотрудничают с фармацевтической промышленностью, федеральными агентствами и академическими кругами, чтобы сформировать «венчурную благотворительность» с финансовыми моделями распределения рисков для снижения рисков при разработке лекарств [1]. Многие академические учреждения вступают в стратегические альянсы с фармацевтической промышленностью с разделением рисков для сотрудничества на этапах доклинических и клинических исследований. Такие успешные инновационные модели партнерства создали прецедент для таких заболеваний, как муковисцидоз, множественная миелома, сахарный диабет первого типа и других редких патологий [1]. Это сотрудничество эффективно катализировало внедрение инноваций на всех этапах разработки лекарств и послужило веским основанием для поощрения и поддержки большего количества подобных программ.
Исследования в социальных сетях и онлайн-сообществах
Социальные сети (Twitter, Facebook и т. д.) можно задействовать для привлечения пациентов к участию в клинических испытаниях. Они могут сильно повлиять на исторические проблемы клинических испытаний, включая недостаточную осведомленность пациентов и врачей о доступных испытаниях и отсутствие участия сообщества, и решить их. Во всем мире социальными сетями пользуются более 4,48 миллиарда человек, и, по прогнозам, в 2027 году это число увеличится почти до 6 миллиардов [83]. Более 70% американцев зарегистрированы в социальных медиа, в том числе сельские жители, а также подростки и молодые люди, которые всегда были недостаточно представлены в клинических испытаниях. Хотя многие пожилые люди не пользуются социальными сетями, скорее всего, это будут делать их опекуны.
Люди с неизлечимыми заболеваниями часто сами экспериментируют с лекарствами, и онлайн-сообщества пациентов могут предоставить среду для обмена и мониторинга этих процессов. Это может позволить планировать обсервационные исследования на основе количественных данных об исходах заболеваний из Интернета. Например, исследователи разработали алгоритм анализа данных, представленных на веб-сайте PatientsLikeMe людьми с боковым амиотрофическим склерозом, которые экспериментировали с лечением карбонатом лития [84]. Этот анализ привел к таким же результатам, как и последующее РКИ; это дает основания предполагать, что данные из Интернета о поведении пациентов могут помочь ускорить разработку лекарств и оценить эффективность уже используемых препаратов.
Расширение участия пациентов и организаций по защите их прав может способствовать информированию пациентов и работе с ними, исследованиям, проводимым совместно с пациентами, а также позволяет учитывать точки зрения пациентов при разработке клинических исследований, что в конечном итоге приводит к созданию исследований с учетом потребностей людей. Более того, социальные сети разрушают барьеры, разделяющие исследователей и клиницистов, создавая огромный потенциал для влияния на все области медицины [85].
Заключение
Успех будущих клинических испытаний требует фундаментального изменения их разработки, проведения, отслеживания, адаптации, публикации и регулирования для получения наилучших данных. Существующая модель нежизнеспособна. Вместо этого необходима превентивная, персонализированная, прагматичная медицина, основанная на участии пациентов, и для достижения этого через устойчивый рост необходимы сдвиги парадигмы. Изоляцию нужно разрушить. Стандарты лечения и клинические испытания в настоящее время рассматриваются в разных сферах; однако главной целью обоих является улучшение результатов в отношении здоровья. Пандемия COVID-19 позволила наблюдать, как рутинная медицинская помощь и клинические испытания могут совместно работать для получения данных [86]. Платформенные исследования в области реальной клинической практики, такие как испытание RECOVERY, должны быть моделью и образцом для повышения эффективности испытаний и получения результатов в реальном времени.
Нынешним парадигмам должны постоянно бросать вызов новые технологии и все заинтересованные стороны (новые поколения ученых, врачей, фармацевтическая промышленность, регулирующие органы и, что наиболее важно, пациенты). Прорывные инновации должны привести к тому, что каждый клинический центр станет исследовательским центром со всеми необходимыми проверками качества и исследованиями в рамках стандарта лечения. Система здравоохранения должна быть интегрирована в интуитивно понятную систему генерации ДРМ, в которой клинические исследования должны идти рука об руку с медицинской помощью. Помимо вызванного обстоятельствами озарения (в связи с пандемией), потребуется устойчивый импульс для применения знаний, полученных в результате таких программ, как «Операция "Сверхзвуковая скорость"» (инициированная правительством США для ускорения разработки вакцины против COVID-19). Автор настоящего обзора высказывает мнение, что каждое серьезное заболевание нуждается в поиске самых амбициозных и смелых методов лечения, и для каждого редкого заболевания необходима «Операция "Сверхзвуковая скорость"» — обе с четко определенными устойчивыми целями улучшения здоровья населения и обеспечения справедливости, разнообразия и глобального доступа к методам лечения. Методологические достижения и будущий анализ всех данных на основе ИИ предоставляют убедительные данные для достижения цели персонализированной медицины — предоставление нужной терапии нужному пациенту в нужное время.
