Пропофол: молоко забвения

В 2018 году Джеймсу Бэрду Глену была присуждена премия Ласкера за открытие и разработку анестетика пропофола. Преимущества для пациентов заключаются в быстром начале действия и быстром выведении вещества из организма, что устраняет пролонгированные эффекты седации, которые наблюдались при применении более старых препаратов. Всего за 30 лет пропофол стал применяться во всем мире для безопасной и контролируемой индукции анестезии.
На протяжении всей истории человечества врачи и ученые искали соединения, которые бы вызывали у пациентов потерю сознания, чтобы помочь справиться с болью — будь то хирургические операции, посещение стоматолога, восстановление после травм, полученных в течение жизни, или преодоление последствий войны. В библиотеке-музее анестезиологии Вуда в Шаумберге, штат Иллинойс, названной в честь доктора Пола Вуда, старейшины американской анестезиологии XIX и XX веков, задокументированы попытки облегчить боль с с 4000 лет до н. э. Самыми первыми анестетиками были природные соединения, хотя в Китае еще в 2200 году до н. э. применяли механическое воздействие — иглоукалывание. Натуральные средства включали экстракты опиумного мака, найденные в шумерских артефактах (4000 год до н. э.), каннабис, который использовали в Индии в 600 году до н. э., и наконец выделенное в 1805 году Сертюрнером очищенное соединение из опия, которое он назвал морфином (рисунок 1). Даже яд кураре, которым смазывают наконечники стрел, применяли как анестетик, расслабляющий мышцы.
Параллельно изучались низкомолекулярные летучие соединения, способные вызывать потерю сознания. Считается, что алхимик Парацельс использовал диэтиловый эфир на животных в XVI веке, а Хэмфри Дэви, врач, известный применением экстрактов наперстянки при застойной сердечной недостаточности («водянка» на современном жаргоне), в 1800 году призывал к применению оксида азота. В 1850-е годы Джон Сноу использовал хлороформ для облегчения родовых болей у английской королевы Виктории (Caton, 2000). Это был тот самый Джон Сноу, который известен тем, что проследил путь эпидемии холеры до деревенской водокачки и ввел в общественное здравоохранение эпидемиологию как отдельную дисциплину.
Особенно известным в анналах анестезиологии стало применение диэтилового эфира доктором У. Т. Г. Мортоном в Массачусетской больнице общего профиля в 1846 году для хирургической операции. Операционная впоследствии была прозвана «эфирным куполом» (Fenster, 2001). Считается, что термин «анестезия» для описания процедуры доктору Мортону предложил доктор Оливер Венделл Холмс-старший, декан Гарвардской медицинской школы и отец известного судьи Верховного суда Оливера Венделла Холмса-младшего.
Помимо натуральных средств и летучих веществ, с начала 1900-х годов усилия ученых были направлены на синтез новых анестетиков. В результате были получены синтетические препараты местного действия, которые нарушали свойства липидных мембран и функции встроенных в них белков, такие как прокаин, который начал использоваться в 1905 году под торговым названием новокаин; за ним в 1944 году последовал лидокаин. В 1956 году в качестве общего анестетика была разработана бром-содержащая малая молекула — галотан. Однако преобладающим синтетическим анестетиком в середине ХХ века был тиопентал натрия (рисунок 1A), изобретенный медицинскими химиками из лаборатории Abbott, а затем впервые примененный в клинических испытаниях на людях доктором Джоном Ланди в клинике Майо в 1934 году. По сравнению с эфиром он позволял вызывать у пациентов сон более мягким и эффективным способом (Meyer and Wiener-Kronish, 2014).
Тиопентал относится к химическому классу тиобарбитуратов, и представляет собой сернистый аналог пентобарбитала. Он действует как седативное средство, обеспечивая обезболивание путем подавления центральной нервной системы. За пять десятилетий применения тиопентала в качестве внутривенного анестетика с 1930-х по 1980-е годы наблюдался ряд побочных эффектов, включая замедление (угнетение) дыхания, сердечные аритмии, длительную сонливость, головную боль, тошноту и медленное восстановление полного сознания. Такие отложенные эффекты во время восстановления после наркоза отчасти обусловлены накоплением анестетика в тканях и медленной метаболической экскрецией. Угнетение центральной дыхательной функции используется в протоколах эвтаназии в таких странах, как Бельгия и Нидерланды. Тиопентал натрия вызывает кому, а затем в качестве паралитического средства для остановки дыхания вводят бромид панкурония.
Из-за побочных эффектов тиопентала необходимо было продолжать поиск более быстродействующего и безопасного внутривенного анестетика. Эту нишу смог занять профопол, разработанный Джоном Бэрдом Гленом, который в 2018 году был удостоен премии Ласкера-ДеБейки. Одобренный в конце 1980-х, этот внутривенный анестетик используется в течение последних 30 лет в среднем у 30–50 миллионов пациентов в год в США и в 90 других странах мира. Одним из критериев премии Ласкера-ДеБейки служит улучшение жизни многих пациентов: пропофол бесспорно соответствует этим требованиям, так как с момента его внедрения в клиническую практику он использовался во время примерно миллиарда операций на людях.
Джон Бэрд Глен и изобретение профопола
В течение 30 лет, начиная с 1970-х годов, Джеймс Бэрд Глен отстаивал использование пропофола в качестве нового безопасного внутривенного анестетика, работая в британской компании Imperial Chemical Industries (ICI, которая затем стала компанией Zeneca, а позже — AstraZeneca). Глен начал свою карьеру в качестве ветеринара и академика в университете Глазго, где он совершенствовал навыки анестезирования различных видов животных. Чтобы расширить свои возможности для изучения новых анестетиков с желаемыми характеристиками, такими как быстрое начало действия и быстрое восстановление после наркоза, Глен перешел в фармацевтическое отделение ICI. ICI разработала ингаляционный анестетик галотан (рис. 1А) и, таким образом, создала инфраструктуру для этой терапевтической области. Обладая знаниями по фармакологии животных, Глен был идеальным коллегой-биологом для химиков-медиков, анализирующих химические основы для синтеза новых агентов. Работа, начатая в 1973 году и опубликованная в 1980 году (James и Glen, 1980) заложила основу для переворота в уходе за пациентами. Ее авторы обнаружили, что 2,6-диэтилфенол — вещество из ряда алкилзамещенных фенолов, представляющих собой терапевтические средства, — оказывает «гипнотическое» действие на животных, но имеет медленную кинетику начала действия. Глен изучил коллекцию химических веществ ICI и остановился на родственном громоздком 2,6-диизопропоксисоединении с ранее обнаруженной антибактериальной активностью, которое и стало пропофолом (рис. 1А). В серии экспериментов на животных, оптимизированных с учетом его ветеринарного опыта, Глен обнаружил, что эта молекула обладает уникальным балансом анестетического эффекта с минимальным влиянием на дыхание и частоту сердечных сокращений. На мышах удалось показать, что его можно было давать неоднократно, на восстановление не требовалось много времени, а накопленный эффект «похмелья» отсутствовал, что говорит о быстром метаболизме. Последующие фармакокинетические и метаболические исследования на животных, а затем на людях показали быстрое начало анестезии и метаболизм печенью более 99 %. Около 50 % дозы для человека превращается в водорастворимое соединение глюкуронид, которое выводится почками. Остаток насыщается кислородом печеночными ферментами Р450, а затем сульфатируется с образованием водорастворимых метаболитов, которые выводятся из организма (рис. 1А).
Долгие поиски лекарственной формы
Казалось, что пропофол ждет большое будущее, но возникли масштабные проблемы с лекарственной формой, связанные с тем фактом, что 2,6-диизопропилфенол при комнатной температуре представляет собой масло и почти не растворяется в воде. pKa фенола составляет около 11, что означает, что при физиологическом pH в ионной форме содержится менее 0,1%. Распределение октанол : вода составляет 6761:1 (с logP = 4,0; Lemaitre et al., 2015), поэтому молекула практически нерастворима и не смешивается с водными растворами. Доступная технология приготовления нерастворимых в воде масел в 1970-х годах основывалась на кремофоре — компоненте полиэтоксилированного касторового масла. Хотя в качестве анестезирующего агента в смеси с кремофором пропофол сохранил свою фармакокинетику быстрого начала и восстановления после наркоза, Глен и его коллеги наблюдали случайные анафилактические реакции на свиньях, а затем — и в ранних испытаниях на людях. Из-за такой ответственности руководство ICI хотело закрыть проект. Глен, однако, полагая, что анафилаксия вызвана только кремофором, продолжал искать более безопасные и эффективные растворители.
В обзорной статье Baker и Naguib 2005 года отмечено, что с пропофолом возникли сложности, которых не было у предыдущих синтетических анестетиков. В отличие от тиопентала натрия (рис. 1), который он со временем заменил в анестезиологической практике, пропофол не имеет функциональных групп, которые могли бы позволить превратить его в водорастворимую соль. Таким образом, барьер создания нужной лекарственной формы Глену позволила преодолеть разработка передовых технологий для приготовления эмульсий в начале 1980-х годов.
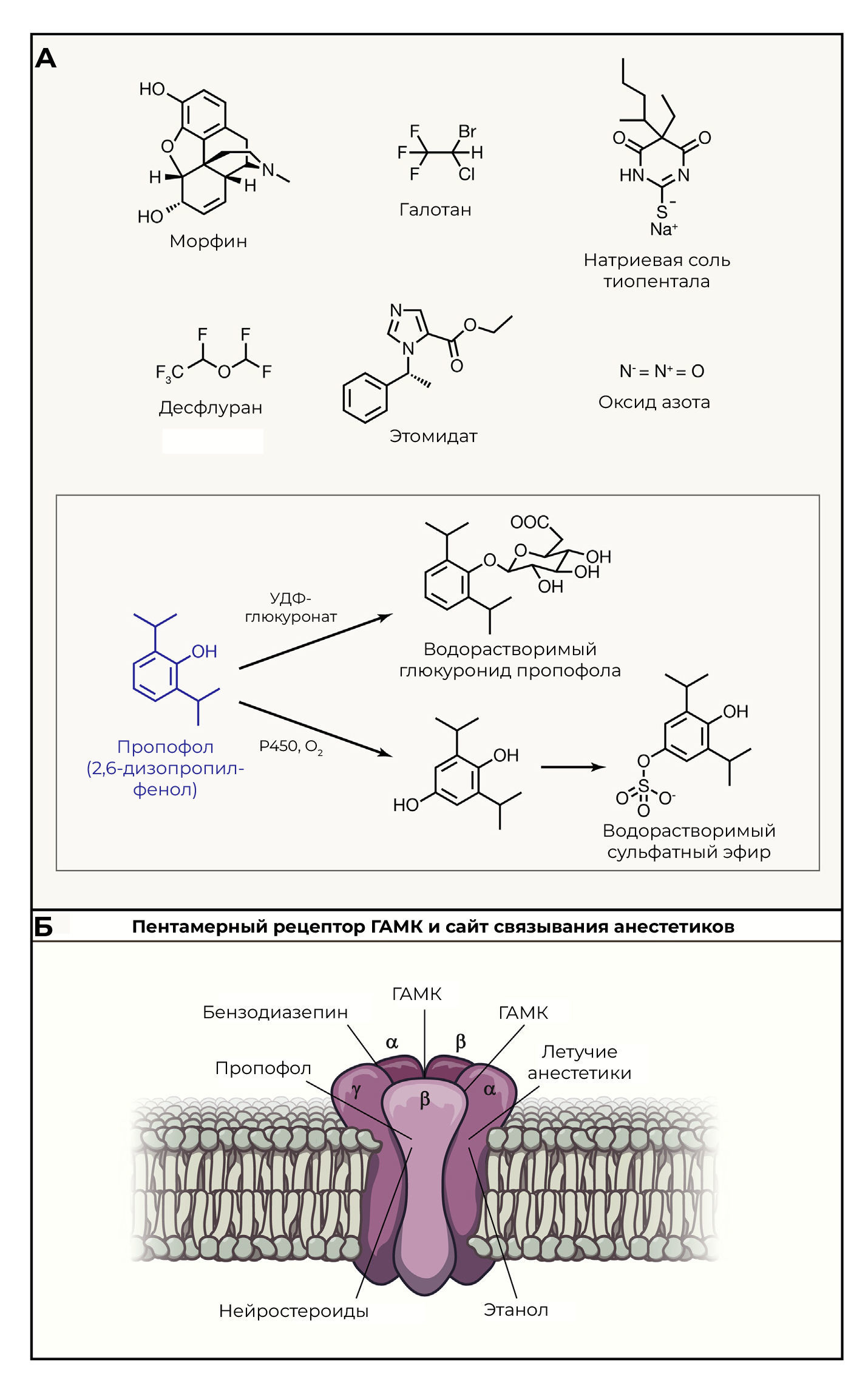
(B) Схема пентамерного ГАМК-зависимого ионного канала и сайтов для связывания малых молекул, включая анестетики пропофол, этомидат и десфлуран. Адаптировано из Lovinger (2008).
Стабильные эмульсии с достаточно малыми размерами капель, чтобы проходить через фильтры для удаления микробов и попадать в капиллярное русло без образования эмболов (0,15–0,3 микрона — размером примерно с хиломикрон), можно создавать с использованием микроэмульгаторов с большим усилием сдвига. В 1981 году Глен протестировал растворитель, содержащий в качестве солюбилизаторов яичный лецитин и соевое масло. Этот препарат работал на свиньях без каких-либо анафилактических побочных эффектов, что привело к клиническим испытаниям пропофола под торговым названием Диприван — эмульсии с 1 % пропофола, 0,005 % ЭДТА, соевым маслом (100 мг/мл), яичным лецитином (12,5 мг/мл) и глицерином (22,5 мг/мл), pH был доведен до 7–8,5 (руководство фармакопеи США).
Baker и Naguib (2005) отмечают, что соевое масло растворяет пропофол, глицерин нужен для поддержания изотоничности с кровью, а яичный лецитин образует эмульсию, в которой стабильны капли пропофола и соевого масла. In vivo пропофол диффундирует из капель масла в кровоток, а затем в клеточные мембраны с быстрым установлением равновесия в нейронах головного мозга — менее чем за минуту. Маленькие капли обеспечивают большую площадь поверхности для быстрой диффузии анестетика из капель соевого масла. Диапазон размеров стабильных капель во флаконах с Диприваном преломляет свет и создает молочный оттенок. Отсюда и прозвище milk of amnesia — «молоко забвения» (Euliano и Gravenstein, 2004). Это игра слов с отсылкой на древнее антацидное и слабительное средство — milk of magnesia, которое представляет собой суспензию простого неорганического соединения гидроксида магния Mg(OH)2.
Если бы Глен не был убежден, что пропофол будет средством, которое и пациенты, и анестезиологи оценят за быстрое действие, за которым следует легкое восстановление после операции и минимальная послеоперационная тошнота, молекула не появилась бы в группе разработчиков компании ICI. Пропофол, одобренный в Великобритании в 1987 году, а также в США и примерно в 90 других странах в 1989 году, стал доминирующим и стандартным препаратом для вводной анестезии. Он в корне изменил практику амбулаторной хирургии во всем мире. Глен продолжал в 1990-х годах разрабатывать алгоритмы и устройства для контроля непрерывной инфузии пропофола для седации у пациентов в критическом состоянии, что привело к существенной замене ингаляционной анестезии во всем мире.
Из-за строгих требований к химическому составу, производству и контролю, а также из-за низкой прибыли производителей пропофола немного, несмотря на огромный объем применения во всем мире. В 2017 году сообщалось о нехватке лекарств в некоторых из 15 000 больниц и клиник США, когда было выпущено 30–50 миллионов доз.
Несмотря на неоспоримую пользу, применение пропофола не лишено противоречий. Ни одно эссе о пропофоле не будет полным без упоминания о том, что это вещество принимал Майкл Джексон в своих фатальных попытках вылечить бессонницу в 2009 году — это подчеркивает, что такое соединение должно использоваться с оглядкой на безопасность. Отдельно европейские производители отказались продавать пропофол штатам США, которые хотели использовать его как часть коктейля для исполнения смертных приговоров.
Как работает пропофол и другие низкомолекулярные анестетики: тайна сознания
Ранние взгляды на механизм действия пропофола в связи с его простой химической структурой были сосредоточены на общем нарушении функции мембраны, а не на конкретных молекулярных мишенях. Однако в более поздних работах внимание сосредоточено на роли пропофола и родственных молекулах в качестве лигандов для пентамерных лиганд-зависимых ионных каналов, таких как рецепторы глицина и ГАМК, а также никотиновые рецепторы ацетилхолина (Nury et al., 2011). Рентгеноструктурный анализ комплексов бактериального гомолога пентамерного ГАМКА-канала с пропофолом или с более мелкой молекулой десфлуранового анестетика выявил внутренний мембранный карман в каждом белковом мономере канала, который мог связывать пропофол или более мелкий десфлуран на внеклеточном конце трансмембранного домена α-спирали (Tang and Eckenhoff, 2018). В самом деле, ГАМК-рецептор/ионный канал служит сайтом связывания множества молекулярных классов анестетиков и релаксантов (рис. 1В; Lovinger, 2008). При многих операциях пропофол используется в качестве индукционного анестетика, а затем в качестве последующих ингаляционных препаратов для мгновенного титрования применяют изофлуран или десфлуран. Связывание с анестетиком оказывает агонистическое действие на ГАМК- и глицин-зависимые ионные каналы и усиливает их ингибиторную активность. Кроме того, результаты современных транскриптомных и протеомных анализов предполагают множественные дополнительные мишени для пропофола и других общих анестетиков, а также пока еще не определенную функциональную разнородность, что не станет неожиданностью для этих малых гидрофобных молекул с простой структурой (Tang и Eckenhoff, 2018).
С самого начала применения анестетиков способность этих молекул — особенно простых синтетических, представленных на рис. 1, — вызывать у людей бессознательное состояние была одновременно замечательной и таинственной. Главный нерешенный вопрос заключается в том, как связывание анестетиков с такими лиганд-зависимыми ионными каналами в головном мозге приводит к потере сознания. Действительно, эти молекулы могут быть лучшими инструментами для экспериментального решения загадки сознания. Говорят, что если мы не понимаем сознание, возможно ли понять механизмы, с помощью которых оно уходит, а затем возвращается? Да, цель этой области интенсивных исследований с использованием датчиков региональной электроэнцефалограммы (ЭЭГ) и фМРТ — оценить, отражает ли анестезия потерю синхронности в передаче сигналов между различными областями коры — самого внешнего слоя мозга, важного для внимания, сознания, мышления и памяти (Liu et al., 2012, Liu et al., 2013, Wollstadt et al., 2017). Анестезия пропофолом, по-видимому, предотвращает распространение электрических сигналов в коре, наблюдаемое в периоды бодрствования/сознания, поэтому вполне вероятно, что низкомолекулярные анестетики могут быть зондами, которые в конечном итоге позволят распутать сознательные и бессознательные состояния мозга.
Среди способов, которыми можно оценить влияние решительных усилий Джеймса Глена на протяжении большей части его профессиональной карьеры на открытие, доклиническую и клиническую разработку и одобрение пропофола, можно выбрать два в качестве заключения. Во-первых, любой, кто проходил периодическую профилактическую колоноскопию в последнее десятилетие и через несколько минут полностью проснулся и был в сознании, должен быть благодарен пропофолу. Во-вторых, можно привести цитату Линды Геддес из номера «New Scientist» от 23 ноября 2011 года (Geddes, 2011):
«Мой опыт оставляет меня с новым чувством благоговения перед тем, что анестезиологи делают в рутинном режиме. Не совсем понимая как, они направляют сотни миллионов людей в год настолько близко к краю небытия, насколько это возможно без их гибели. Затем они благополучно возвращают их домой».
