Педиатрическая фармакокинетика: ключевые аспекты

Фармакокинетический профиль лекарственного средства определяет ряд анатомических и физиологических факторов. Различия в физиологии у детей и взрослых могут влиять на концентрацию лекарственного препарата в плазме или тканях. Медицинские работники должны быть осведомлены об анатомических и физиологических изменениях, влияющих на фармакокинетические профили лекарств, чтобы понимать последствия корректировки дозы у младенцев и детей. Клинические испытания у детей осложнены ограничениями по объему образцов крови и чувством боли у детей в результате забора крови. Существуют альтернативные методы отбора проб, которые могут свести к минимуму инвазивный характер таких исследований. Популяционные модели также могут ограничивать забор крови, требуемый от каждого человека, за счет увеличения общего размера выборки для получения надежных фармакокинетических данных. В этом обзоре подробно изложены ключевые аспекты дизайна и разработки клинических исследований фармакокинетики у детей.
Введение
Хотя педиатрические пациенты в настоящее время признаны особой популяцией для лекарственной терапии, в детстве происходят многие физиологические изменения, что может оказывать влияние на фармакокинетику и динамику соединения. По этой причине детство можно разделить на различные возрастные классы, где каждую группу следует рассматривать как особую совокупность. Любая классификация детского населения по возрастным категориям в определенной степени условна. Для целей настоящего обзора используются классификации E11 Международной конференции по гармонизации (ICH) [1], в которых педиатрическая популяция подразделяется на:
- недоношенных новорожденных,
- новорожденных (0–28 дней),
- младенцев (> 28 дней –12 месяцев),
- детей преддошкольного возраста (> 12 месяцев–23 месяца),
- детей дошкольного возраста (2–5 лет),
- детей школьного возраста (6–11 лет),
- подростков (12–18 лет).
Хотя в настоящем обзоре освещены многие анатомические и физиологические различия между детской и взрослой популяциями, этой теме посвящено несколько превосходных обзоров, и читатель может обратиться к ним для подробного ознакомления [2–4].
Факторы, влияющие на концентрацию лекарственного средства в тканях с течением времени, включают абсорбцию, распределение, метаболизм и экскрецию (AРMЭ). Процессы АРМЭ различаются в детской и взрослой популяциях и влияют на фармакокинетический профиль лекарственного средства. Понимание таких различий АРМЭ и вероятного результата лечения важно для обеспечения эффективной терапии в педиатрической популяции.
Фармакокинетические исследования измеряют концентрацию лекарственного средства в жидкостях организма, обычно в крови или плазме, с течением времени. Такие исследования особенно полезны, когда существует четкая связь между фармакокинетическим профилем и фармакодинамикой лекарственного средства. Цель фармакокинетического исследования, как правило, состоит в том, чтобы сопоставить воздействие у детей и взрослых. В популяции детей — особенно самых младших — фармакокинетический анализ провести обычно проще, чем фармакодинамические исследования, из-за сложности последних. Например, измерение субъективных симптомов, таких как боль, требует разных инструментов оценки для пациентов разного возраста [1].
Существует множество примеров препаратов, фармакокинетические профили которых различаются у детей и взрослых, что подчеркивает важность понимания детской физиологии и потенциального влияния на концентрацию препарата. Сообщается, что частота интраоперационного сознания под анестезией намного выше у детей по сравнению со взрослыми. Это, вероятно, является следствием плохого понимания фармакокинетических и фармакодинамических характеристик широко используемых препаратов применительно к педиатрической популяции [5].
Этот обзор ограничивается обсуждением ключевых отличий в физиологии и анатомии детей по сравнению со взрослыми и тем, как эти факторы влияют на фармакокинетический профиль лекарств. Второй элемент рассматривает получение фармакокинетических данных в педиатрической популяции и то, как лучше всего их применять и управлять ими в настоящее время.
Физиологические процессы, участвующие в фармакокинетике
Абсорбция
Отсутствие высококачественных фармакокинетических данных клинических исследований, проведенных в педиатрической популяции, ограничивает знания о механизмах абсорбции у детей.
Высвобождение препарата из лекарственной формы у детей может различаться, поскольку на растворение лекарственного средства могут существенно влиять время прохождения по кишечнику и состав кишечной жидкости (включая рН).Сообщалось, что у детей младшего возраста время прохождения по кишечнику короче, что может уменьшить количество всасываемого лекарственного средства, особенно в случае плохо растворимых лекарств или продуктов с замедленным высвобождением (например, теофиллина) [6, 7].
Общепризнано, что pH желудка при рождении является нейтральным, хотя ведутся споры о времени, необходимом для снижения pH после рождения, с данными о том, что через 24–48 часов pH достигает 3 [8] с дальнейшим повышением до нейтрального значения через 72 часа или 10 дней в нейтральной среде с последующим снижением до кислых значений, к двум годам сравнимых со взрослыми [9]. Влияние этих различий в рН желудка может быть значительным: так, бо́льшая пиковая концентрациях пенициллина — кислотолабильного препарата — наблюдается у новорожденных, у которых рН желудка выше по сравнению с младенцами и детьми [10]. pH желудка также влияет на слабоосновные препараты, такие как итраконазол (pKa = 3,7), при этом более высокие концентрации в сыворотке достигаются при более низких уровнях желудочного pH, поэтому у новорожденных могут быть значения ниже ожидаемых [11].
Известно, что секреция желчи в первые 2–3 недели жизни слабая, а концентрации в полости кишечника ниже, чем у взрослых (2–4 мМ и 3–5 мМ, соответственно) [12, 13]. Растворимость же лекарственного средства увеличивается с концентрацией солей желчных кислот, поэтому разница в концентрации может влиять на абсорбцию у более молодых пациентов. Это представляет особый риск для плохо растворимых препаратов (например, гидрокортизона) [14].
Есть данные, что проницаемость кишечника при рождении высокая и последовательно снижается в течение первой недели жизни [15]. Это может быть связано с уменьшением отношения площади поверхности к объему из-за того, что ворсинки более широкие и обеспечивают меньшую общую площадь поверхности. Это явление хорошо описано у крыс [16].
Проницаемость кишечника у недоношенных детей обычно оценивают с помощью тестов на всасывание сахаров. После энтерального введения тестового раствора в моче измеряют дифференциальную экскрецию лактулозы и маннитола. В здоровом кишечнике маннит легко всасывается трансцеллюлярным путем, но более крупные дисахариды (например, лактулоза) всасываются только парацеллюлярным способом. Поэтому соотношение лактулоза/маннит в моче является мерой целостности кишечника. Сообщалось, что проницаемость кишечника, оцениваемая по абсорбции сахаров, у недоношенных детей выше, чем у здоровых новорожденных [17]. Также сообщалось о ее снижении в первую неделю жизни после рождения [18].
Kalach с соавт. получили данные об уменьшении соотношения лактулоза/маннит в возрасте от 0,5 месяцев до 14 лет [19]. Это было связано с увеличением проницаемости кишечника для маннита с возрастом, что позволяет предположить, что трансцеллюлярный путь используется в большей степени.
За всасывание питательных веществ и ионов в кишечнике обычно отвечают процессы активного транспорта. Участвующие в них переносчики обычно экспрессируются в соответствии с потребностями растущего ребенка. Абсорбция свинца, который захватывается такими переносчиками, была выше у младенцев (40–50%) по сравнению со школьниками (10–15%) [20].
Несколько исследований биодоступности, в которых изучалась абсорбция лекарств (например, фенобарбитала, сульфаниламидов и дигоксина) и питательных макромолекул (например, арабинозы и ксилозы), позволяют предположить, что процессы как пассивного, так и активного транспорта полностью созревают у младенцев примерно к четырехмесячному возрасту.
У детей изучали всасывание лекарственных препаратов в кишечнике. Возрастных различий во всасывании D(+)ксилозы, которая активно поступает в клетки в верхних отделах тонкой кишки, обнаружено не было [21]. Однако константа скорости Ka для кишечной абсорбции D(+)-ксилозы нелинейно зависела от возраста — меньше для новорожденных и младенцев по сравнению с детьми дошкольного возраста [21]. Длительное время опорожнения желудка и снижение перистальтики кишечника могут быть в некоторой степени ответственны за сходство, наблюдаемое в общей абсорбированной массе, несмотря на более медленную скорость абсорбции D(+)ксилозы у младших пациентов. Для измерения влияния перистальтики кишечника на абсорбцию D(+)ксилозы было проведено дальнейшее исследование с применением метоклопрамида для сокращения времени опорожнения желудка. Результаты показали увеличение Ka как у новорожденных, так и у младенцев, но соотношение Ka/возраст оставалось постоянным [21]. Это позволяет предположить, что наблюдаемое снижение Ka было обусловлено не только более длительным временем прохождения по кишечнику или снижением подвижности, но и другими факторами. В заключение следует отметить, что в целом скорость всасывания большинства лекарств у новорожденных и младенцев медленнее; хотя причина такого более медленного поглощения неизвестна [22].
Выкачивающий трансмембранный насос P-гликопротеин (P-gp) отвечает за устранение лекарств из клеток, транспортируя вещества из внутриклеточного во внеклеточный компартмент в пределах желудочно-кишечного тракта. P-gp может заметно влиять на биодоступность некоторых лекарств, особенно обладающих низкой растворимостью. Онтогенез экспрессии P-gp в желудочно-кишечном тракте у детей неясен. Johnson & Thomson сообщают, что экспрессия P-gp быстро увеличивается в течение первых 3–6 месяцев жизни, достигая уровня взрослого человека примерно к двум годам [23], тогда как по данным Fakhoury с соавт., на экспрессию P-gp в кишечнике возраст не влияет, и у новорожденных и младенцев уровень экспрессии соответствует таковому у взрослого [24].
Метаболизм в просвете и стенке кишечника может снижать всасывание широкого спектра лекарственных средств, включая циклоспорин, нифедипин, мидазолам и верапамил [25–28]. Основным семейством ферментов, участвующих в метаболизме лекарств в кишечной стенке, являются цитохромы P450 (CYP). Подсемейство CYP3A преобладает: на его долю приходится примерно 70% цитохромов в тонкой кишке взрослого человека, и он участвует в метаболизме более 70% вводимых в настоящее время лекарств [29]. Субстраты CYP3A (особенно CYP3A4 и CYP3A5) в изобилии присутствуют в тонком кишечнике у взрослых, однако данные об их экспрессии у детей ограничены. Fakhoury с соавт. продемонстрировали, что CYP3A экспрессируется в биоптатах двенадцатиперстной кишки у детей европеоидной расы в возрасте шести месяцев и старше и у половины детей в возрасте от 1 до 6 месяцев [24]. Однако от 1 до 17 лет уровень CYP3A снижался с возрастом [24]. Напротив, в исследовании Johnson с соавт. сообщается, что увеличение экспрессии CYP3A наблюдалось с возрастом, что отражалось соответствующим изменением активности фермента CYP3A4 [30].
Распределение
Распределение препаратов влияет на эффективность и продолжительность действия. Ginsberg с соавт. сравнили фармакокинетические параметры 45 препаратов у детей и взрослых и пришли к выводу о наличии тенденции к большим объемам распределения этих соединений у детей всех возрастных групп [31].
Распределение лекарственных препаратов зависит от состава тела. Липофильные препараты имеют относительно больший объем распределения у младенцев по сравнению с детьми более старшего возраста из-за более высокого сравнительного уровня жира (22,4% в 12 месяцев и 13% в 15 лет [32]). Например, для липофильного препарата диазепама отношение объема распределения у взрослых к объему распределения у новорожденных составляет 0,7 [33].
Гидрофильные препараты также имеют большие объемы распределения у детей дошкольного возраста по мере снижения количества внеклеточной воды в процессе развития: от 70% от общей массы тела у новорожденных до 61,2% у детей первого года жизни [32]. Вследствие более высоких объемов распределения водорастворимых препаратов у младенцев, например, гентамицина [34], им необходимо давать более высокие дозы на килограмм массы тела по сравнению со взрослыми для достижения сопоставимых концентраций в плазме и тканях [35].
На объем распределения препаратов также влияет связывание с белками. Физиологические параметры, влияющие на связывание белков в детской популяции, представлены в таблице 1. У новорожденных общая концентрация белка в плазме крови составляет 86% от ее значения у взрослых.
Таблица 1. Сравнительное связывание белков в педиатрической популяции по сравнению с референсными значениями для взрослых [36])
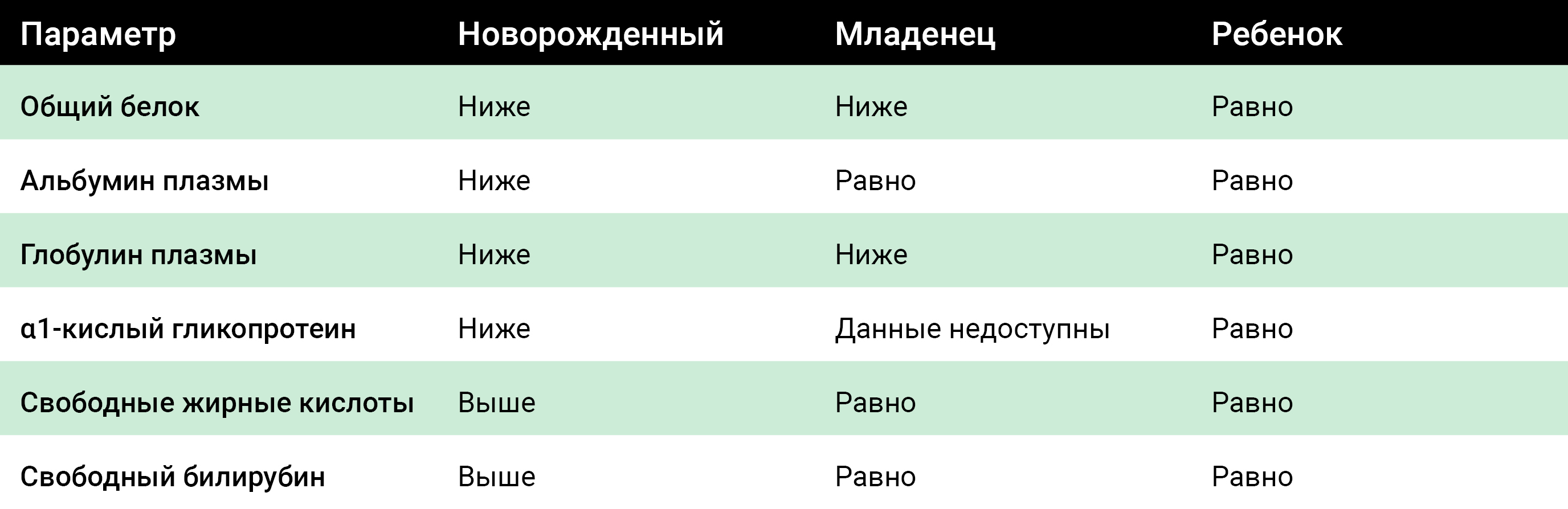
Среди препаратов, для которых было зарегистрировано более низкое связывание с белками у новорожденных, можно назвать фенитоин, салицилаты, ампициллин, нафциллин, сульфизоксазол и сульфаметоксифразин [37–40]. Следовательно, большее количество этих препаратов циркулирует в крови в свободной фракции и, таким образом, способно проникать в различные отделы тканей, обеспечивая более высокие объемы распределения.
В общих чертах можно предположить, что влияние связывания с белками на концентрации свободных лекарств в плазме ограничено препаратами, для которых характерпа высокая степень связывания с белками (> 95%). Поскольку уровень белка достигает взрослых значений в младенчестве, этот эффект, вероятно, будет наиболее выражен у новорожденных и младенцев.
Метаболизм
Недавно было сообщено, что содержание микросомного белка в печени увеличивается с возрастом от примерно 26 мг/г у новорожденных до максимального значения 40 мг/г у 30-летнего взрослого человека [41]. Из-за этих различий в уровнях ферментов, как правило, лекарства, которые быстро метаболизируются, новорожденным вводятся в более низкой дозе (мг/кг) по сравнению с детьми дошкольного возраста. Однако печеночный клиренс лекарств может быть выше у младенцев и детей дошкольного возраста, поскольку кровоток в печени по сравнению со взрослыми повышен из-за большего отношения печени к общей массе тела в первой популяции [42]. Это может усилить эффект первого прохождения, когда лекарство выводится при первом прохождении через печень, хотя на этот параметр будет влиять уровень ферментативной активности. Наблюдаемые возрастные клиренсы для теофиллина, кофеина, карбамазепина и вальпроевой кислоты, по-видимому, отражают разницу в размере печени и массе тела, а не различия в собственном клиренсе на грамм массы печени [43]. Это имеет последствия с точки зрения корректировки дозы, когда расчет на основе мг/кг не подходит.
Недавно сообщалось, что содержание микросомного белка в печени увеличивается с возрастом от 26 мг/г у новорожденных до максимального значения 40 мг/г у 30-летнего взрослого человека [41]. Однако необходимо понимать онтогенез специфических метаболических путей, чтобы можно было экстраполировать данные взрослых на детские популяции. Чтобы подчеркнуть важность понимания онтогенеза метаболических путей, в качестве примера часто используется синдром серого ребенка, возникающий в результате введения хлорамфеникола новорожденным в дозах, экстраполированных из данных взрослых [44]. Различия в экспрессии и активности ферментов могут приводить к изменению метаболизма лекарственных препаратов (например, мидазолама и зидовудина [45, 46]) или выработке у детей метаболитов, которые не наблюдаются у взрослых (например, продукция кофеина у новорожденных, получающих теофиллин, различия в продукции метаболитов у детей при использовании вальпроевой кислоты, парацетамола, хлорамфеникола, циметидина и салициламида [47]). Существует несколько обширных обзоров метаболизма в педиатрической популяции, включая онтогенез ферментов, метаболизирующих лекарства [48, 49], и возрастные изменения метаболизма лекарств [8, 48, 50–53].
Метаболизм лекарственных средств в просвете и стенке кишечника
Изменение бактериальной колонизации кишечника с возрастом влияет на метаболизм лекарств в кишечнике. Известны различия в бактериальном составе в зависимости от возраста и диеты [54]. Метаболизм в просвете и стенке кишечника может снижать биодоступность и фармакологические эффекты широкого спектра препаратов, включая циклоспорин, нифедипин, мидазолам и верапамил [25–28].
Показано, что экскреция дигоксина вследствие инактивации в просвете кишечника увеличивается с возрастом на 1–3% у младенцев, 7% у школьников, 10% у подростков, в то время как у взрослых она составляет 40% [55]. Тем не менее, Linday и его коллеги продемонстрировали, что бактерии, инактивирующие дигоксин (Eubacterium lentum), присутствовали уже на второй неделе жизни, что указывает на то, что решающее значение для понимания конечных эффектов дигоксина в просвете кишечника имеет метаболическая активность, а не присутствие бактерий. Последствия различий в инактивации дигоксина в кишечнике учитываются при терапии со снижением нагрузочных доз от 45 мкг/кг у младенцев до 35 мкг/кг детей дошкольного возраста и 25 мкг/кг у школьников [56].
Andrieux с соавт. сравнили активность бактериальных ферментов (β-галактозидазы, α-галактозидазы, β-глюкозидазы, β-глюкуронидазы, нейраминидазы, N-ацетилгалактозаминидазы, α-фукозидазы, нитратредуктазы и азоредуктазы) фекальной микробиоты детей (3–15 лет), взрослых и пожилых людей. Они не обнаружили существенных различий в активности ферментов между тремя популяциями, хотя данные по детям были более изменчивыми [57].]. Эти результаты согласуются с данными из других источников, в которых сообщается, что кишечная колонизация достигает взрослого состава к 1–4 годам жизни [58–60].
За метаболизм в стенках кишечника отвечают ферменты. Таким образом, на пресистемный метаболизм ряда лекарственных средств могут влиять возрастные изменения экспрессии и активности ферментов. Белки подсемейства CYP3A являются преобладающими ферментами кишечной стенки, которые участвуют в метаболизме более 70% применяемых в настоящее время лекарств [29]. CYP3A4 и CYP3A5 в изобилии присутствуют в тонком кишечнике взрослых, однако данные об их экспрессии у детей ограничены. Экспрессия CYP3A была измерена у детей европеоидной расы. Данные показали экспрессию CYP3A у всех детей в возрасте от 6 месяцев до 18 лет, и только у 50% детей в возрасте до 6 месяцев экспрессия CYP3A была обнаружена в двенадцатиперстной кишке [24].
Выведение
Выведение лекарственных препаратов и их метаболитов происходит преимущественно через почки.
Скорость клубочковой фильтрации (СКФ) составляет от 2 до 4 мл/мин/1,73/м2 у доношенных новорожденных и удваивается к недельному возрасту, достигая взрослых значений к концу первого года жизни. Это было продемонстрировано сходством во времени метаболизма трех препаратов (морфина, парацетамола и дексмедетомина), выводимых путем конъюгации с глюкуронидами в почках и созревания СКФ [61].
Почечная экскреция неизмененного препарата обычно ниже у новорожденных из-за незрелости почечной функции. Однако для некоторых препаратов, включая леветирацетам [62], циметидин [63] и цетиризин [64] у младенцев и детей дошкольного возраста наблюдается такая же или более высокая скорость почечной экскреции по сравнению с соответствующими значениями для взрослых. Вероятно, это связано с тем, что у детей дошкольного возраста относительный размер почек в несколько раз превышает таковой у взрослых [43]. Онтогенез механизмов почечного канальцевого транспорта также может влиять на элиминацию лекарств. Замечательным примером такой элиминации может служить выведение дигоксина. Дигоксин экстенсивно секретируется через P-gp в мембране клетки канальцев. Детям дошкольного возраста по сравнению со взрослыми требуются в три раза более высокие дозы дигоксина на кг массы тела, что может быть связано с онтогенезом P-gp [65].
Клиренс креатинина часто используется для оценки СКФ у детей [66]; при этом, если клиренс креатинина ниже нормальной СКФ, рекомендуется снижение дозы препарата.
Значение pH мочи может влиять на реабсорбцию слабых кислот или оснований, что, в свою очередь, влияет на выведение препаратов. рН мочи у младенцев ниже, чем у взрослых, что может усилить реабсорбцию слабокислотных препаратов [67].
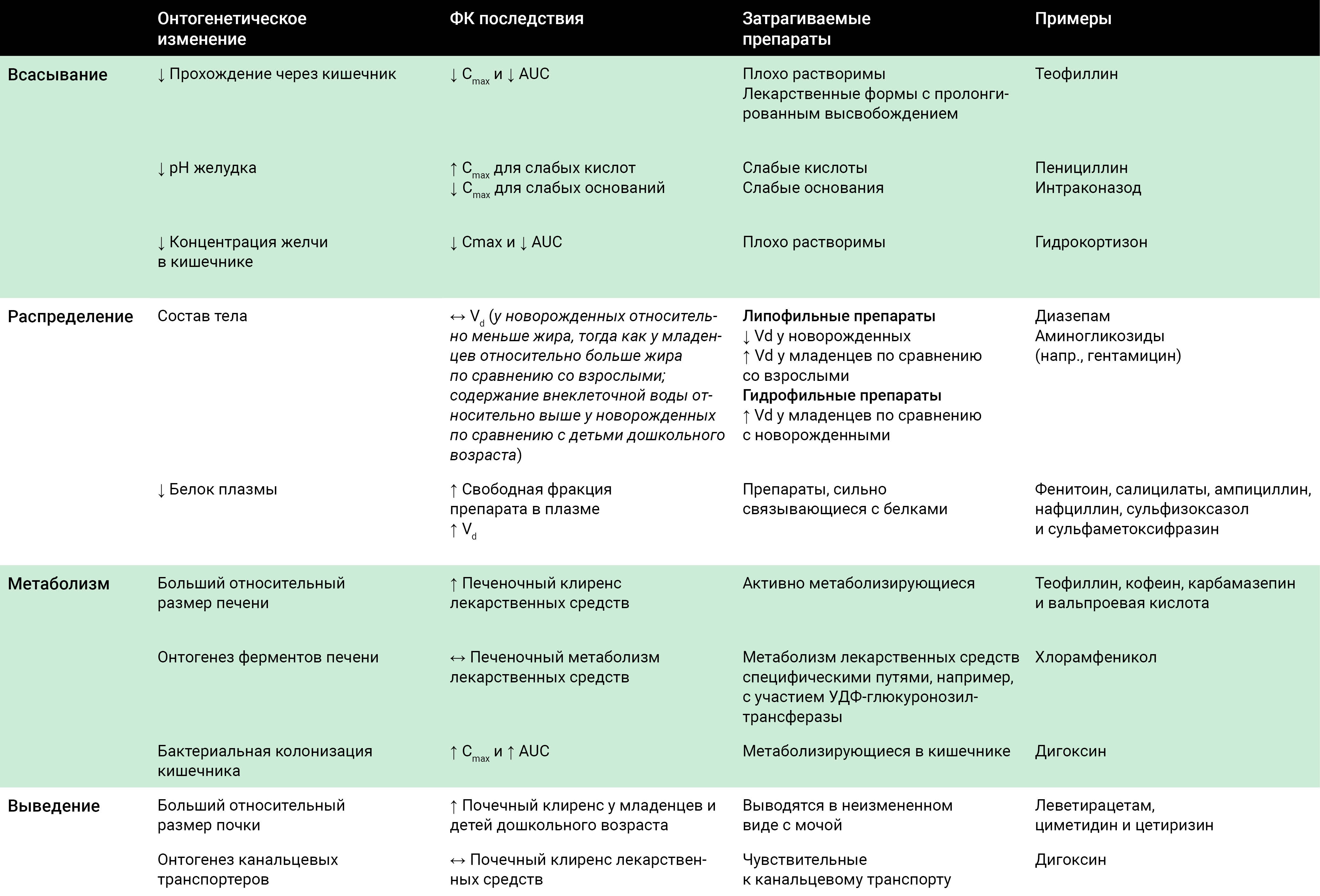
Сводка фармакокинетических различий в педиатрической популяции представлена в таблице 2.
Таблица 2. Сводка фармакокинетических различий в детской популяции по сравнению со взрослыми.
Дизайн и проведение фармакокинетических исследований у детей
Педиатрические фармакокинетические клинические исследования обычно проводятся для поддержки разработки лекарственной формы и определения концентраций в плазме для поддержки рекомендаций по дозированию. Недавние нормативные акты увеличили количество клинических испытаний, проводимых у детей за последние десять лет, хотя все еще существует значимое несоответствие между педиатрическим бременем болезни и количеством исследований клинических испытаний среди детей [68].
Фармакодинамика в педиатрической популяции
В то время как фармакокинетика включает абсорбцию, распределение, метаболизм и выведение лекарств и может быть измерена путем взятия проб крови/плазмы; фармакодинамика включает физиологические и биологические реакции на лекарство и не всегда напрямую связана с фармакокинетикой. Взаимосвязь между фармакокинетикой и фармакодинамикой у детей имеет жизненно важное значение для рационального дозирования, и игнорировать ее нельзя. При фармакокинетическом анализе используются биологические образцы для количественного определения концентрации лекарства с течением времени. Для фармакодинамического анализа требуются показатели конечной точки, которые были подтверждены у детей. Для получения дополнительной информации о фармакодинамике и фармакокинетических-фармакодинамических отношениях в педиатрической популяции читатель может обратиться к превосходным обзорам по этой теме [69–73].
Выбор дозы в педиатрии
Коррекция дозы проводится для обеспечения соответствующего внутреннего воздействия и фармакодинамических эффектов. Однако эти параметры зависят от конкретных свойств препарата и онтогенеза соответствующих физиологических процессов у пациента.
Есть несколько ссылок, указывающих на то, что дети не «маленькие взрослые», однако большинство методов коррекции дозы у детей основаны не на фармакокинетических данных, а на простых алгоритмах, которые экстраполируют дозу для взрослых на основе массы тела, роста или их комбинации, выраженной как площадь поверхности тела. Однако анализ масштабных моделей для прогнозирования поддерживающих доз для детей показал, что метод измерения массы тела был наилучшим с точки зрения точности и погрешности для детей в возрасте от одного месяца до одного года, тогда как оценка площади поверхности тела лучше работала у детей старшего возраста [74]. Общим выводом стало то, что не существует единого алгоритма дозирования, подходящего для всех возрастных диапазонов. Только в 51-м Британском национальном формуляре за март 2006 г. утверждение «Детские дозы могут быть рассчитаны из доз для взрослых с учетом возраста, массы тела или площади поверхности тела или комбинации этих факторов» было заменено на «Проконсультируйтесь с BNFc (Британский национальный педиатрический формуляр — прим. перев.) или обратитесь за помощью в лекарственный информационный центр». До сих пор бывают случаи, когда информация о дозировках для детей недоступна, и единственным имеющимся методом введения лекарств служит масштабирование от доз для взрослых. В таких случаях необходимо тщательно учитывать терапевтический индекс препарата, профиль его токсичности, возраст ребенка и путь выведения препарата. Разработанное FDA дерево решений для детей подчеркивает важность установления того, сходно ли прогрессирование заболевания у детей и взрослых и будет ли аналогичный ответ на препарат с точки зрения экстраполяции фармакокинетики у взрослых на педиатрическую популяцию [75].
Обзор, проведенный Родригесом с соавт., показал, что для более чем 20% из 108 препаратов дозировка была изменена в ответ на результаты необходимого педиатрического фармакокинетического исследования. Это подчеркивает ограничения экстраполяции доз для взрослых на педиатрическую популяцию [76].
Дизайн педиатрических клинических исследований
По возможности предпочтительнее будут дизайны клинических исследований, которые снижают нагрузку на детей, с несколькими инновационными подходами, упомянутыми в соответствующих нормативных руководствах [1, 77]. Эти новые методы включают последовательный дизайн, адаптивный дизайн, байесовский подход, рандомизированный дизайн отмены, рандомизированный дизайн фазы плацебо и трехэтапное клиническое испытание, — в некоторой степени они помогают преодолеть ограничения небольшого количества выборок и этической приемлемости исследования [78]. При выборе подходящих методов для педиатрического фармакокинетического клинического исследования следует учитывать лекарственную форму, дозу, способ введения, интервал взятия образцов и популяцию.
Ранее педиатрические клинические исследования ограничивало отсутствие соответствующей возрасту лекарственной формы. Тем не менее, в настоящее время существует несколько инициатив, направленных на помощь в разработке соответствующих возрасту продуктов для применения в педиатрической популяции. В идеале педиатрические препараты должны быть биоэквивалентны препаратам, используемым для взрослых, однако это не всегда достижимо. Поэтому при смене продуктов требуется осторожность.
Проба на лекарственные препараты, используемая в педиатрических исследованиях, должна быть чувствительной, поскольку объем образцов жидкости организма, взятых у детей, часто намного меньше по сравнению с соответствующими объемами у взрослых (∼ 1–10 мл за раз), которые требуются для большинства анализов на лекарства. Размер образцов крови у новорожденных ограничен нормативными положениями, в которых говорится, что «кровопотеря, связанная с испытанием, не должна превышать 3% от общего объема крови в течение четырех недель и 1% — в любой момент времени» [79]. У новорожденного общий объем крови оценивается в 80–90 мл/кг массы тела. Таким образом, 1% соответствует 3 мл на образец с общим максимальным объемом 9 мл в течение четырех недель. В некоторых педиатрических клинических исследованиях использовались альтернативы забору крови, в том числе забор слюны [80] и анализ мочи [81], которые часто предпочитают пациенты и их родители. Засохшие пятна крови от проколов пальца или пятки чаще используются у новорожденных, а также у детей старшего возраста, чтобы избежать венепункции [82]. Сочетание анализа лекарственного препарата с рутинным клиническим забором крови может быть полезным в педиатрических исследованиях, хотя важно точно фиксировать момент взятия проб по отношению ко времени введения дозы. Собранные таким образом анализы успешно использовались в исследованиях недоношенных детей [83, 84].
Популяционное фармакокинетическое моделирование
Популяционное фармакокинетическое моделирование для поддержки клинических испытаний может уменьшить количество образцов, требуемых от каждого человека в популяции, за счет увеличения общего ее размера. Этот метод был впервые введен в педиатрическую клиническую фармакологию в середине 1980-х годов [85] и остается популярным благодаря возможности анализа исследований с разрозненными и несбалансированными фармакокинетическими данными, типичными для педиатрических исследований с этическими и логистическими ограничениями. В настоящее время нормативное руководство рекомендует этот подход для педиатрических фармакокинетических исследований [86, 87]. Популяционное фармакокинетическое моделирование позволяет сократить количество образцов до 2–3 на человека по сравнению с более чем 12 образцами, которые часто требуются в традиционных фармакокинетических исследованиях [82].
Фармакокинетическое моделирование, основанное на физиологии
Были разработаны физиологически обоснованные фармакокинетические (ФКОФ) модели, которые учитывают физиологию развития для прогнозирования воздействия лекарственного средства на детей на основе существующих клинических данных, полученных для взрослых. Такие модели обеспечивают лучшее понимание процессов АРМЭ лекарственного средства и полезны для экстраполяции между возрастными группами в педиатрической популяции [88, 89]. Физиологическая природа параметров модели означает, что возрастные различия в биологических компонентах могут быть учтены для моделирования педиатрической фармакокинетики во всех возрастных категориях. Доказано, что эти модели превосходят аллометрический расчет многих фармакокинетических параметров, включая клиренс [90, 91]. Ограничения ФКОФ-моделей хорошо известны. Однако их разработка зависит от точных исходных физиологических данных из соответствующих популяций, и эта информация очень ограничена у новорожденных и детей грудного возраста [92]. Как сообщают Cella с соавт., такая нехватка точных данных ограничивает экстраполяцию результатов на педиатрические возрастные группы [93]. Еще одно ограничение ФКОФ-моделирования заключается в трудностях валидации (особенно статистической) таких моделей [89, 91]. Существует несколько отличных обзоров ФКОФ-моделей у детей, и читатель может обратиться к ним за дополнительной информацией [92, 94, 95].
Дополнительные преимущества включают в себя учет информации о лекарственном соединении и физиологии, которая может помочь в прогнозировании эффективности лекарственной формы или биоэквивалентности продуктов, а также дозы или эффектов в зависимости от способа введения [94, 96]. Инструменты ФКОФ-моделирования также полезны при разработке педиатрических клинических исследований, особенно в отношении времени взятия образцов и необходимого количества субъектов. Такие модели пользуются популярностью у регулирующих органов. По мнению FDA, дизайн педиатрических исследований в будущем будет полностью осуществляться с помощью моделирования [97, 98].
Заключение
Из-за физиологических и анатомических изменений, происходящих в детстве, определение подходящих режимов дозировки в педиатрической популяции представляет собой сложную задачу. Фармакокинетические данные предоставляют информацию для улучшения фундаментального понимания этих изменений, чтобы лучше экстраполировать данные, полученные у взрослых, на педиатрическую популяцию, а также для экстраполяции внутри самой педиатрической популяции. В недавнем обзоре зарегистрированных клинических испытаний у детей сообщалось, что фармакокинетические данные собираются только в 24% всех подходящих испытаний, причем большинство из них проводится у детей в возрасте старше двух лет в Северной Америке [99]. Однако сообщается, что наибольшие отличия от фармакокинетических профилей у взрослых наблюдаются именно у детей в возрасте до двух лет. Таким образом, в текущих исследованиях наблюдаются несоответствия и пробелы в знаниях. Также необходимо найти больше связей между фармакокинетикой и фармакодинамикой в педиатрической популяции, преодолеть этические ограничения и включить наиболее уязвимые группы населения в педиатрические клинические испытания.
