Операции при расслаивающей аневризме аорты

Введение
Последние достижения в области сердечно-сосудистой хирургии дают широкие возможности для оперативного лечения аневризм аорты разных локализаций. Дефект, который казался до XX века неизлечимым, теперь поддается медицинской коррекции и весьма эффективному лечению, благодаря открытию различных прогрессивных методов хирургического вмешательства на сердце, сердечных клапанах, аорте и других сосудах.
Показания к хирургическому вмешательству зависят как от локализации пораженного участка аорты, так и от его длины, ширины и диаметра аорты. Врач должен учитывать все особенности состояния здоровья конкретного пациента и его заболевания. Осложнения в виде разрыва аневризмы и острого прогрессирующего расслоения являются главными показаниями к хирургической тактике ведения пациента, вместо проведения медикаментозной терапии [1]
Основная цель операций по поводу расслоения аорты – предотвращение летального исхода. Однако, при коморбидности, наблюдаемой у многих пациентов, и возможной осложненности заболевания такими факторами, как, например, – аортокавальные фистулы, сочетание атеросклероза и синдрома Марфана – возрастает риск неблагоприятных исходов, что на данном этапе исторического развития медицины является одной из проблем сосудистой хирургии.
Анестезия и контроль жизненных показателей
Открытые операции на сердце и аорте производятся под эндотрахеальным (общим) наркозом. Для защиты головного мозга от недостаточности кровоснабжения вследствие операции на магистральных сосудах используется ретро- или антеградная церебральная перфузия. Объем перфузии, продолжительность остановки сердца (циркуляторного ареста) и температура охлаждения зависят от особенностей конкретного пациента и стандартов медицинского учреждения, в котором проводится операция. Для интраоперационного мониторинга, который заключается в оценке адекватности перфузии и тканевого обмена, применяется церебральная оксиметрия, электроэнцефалография, а также чреспищеводная эхокардиография (ЧПЭхоКГ).
Оперативные доступы
Существуют разные варианты оперативного доступа к органам грудной клетки. В начале открытого хирургического вмешательства проводятся следующие процедуры: срединная стернотомия, срединная лапаротомия или торакофренолюмботомия. В ряде операций возможно использование мини-доступов, а в случае эндоваскулярного вмешательства – доступ осуществляется через крупные (бедренные) артерии.
Расслаивающая аневризма тип А
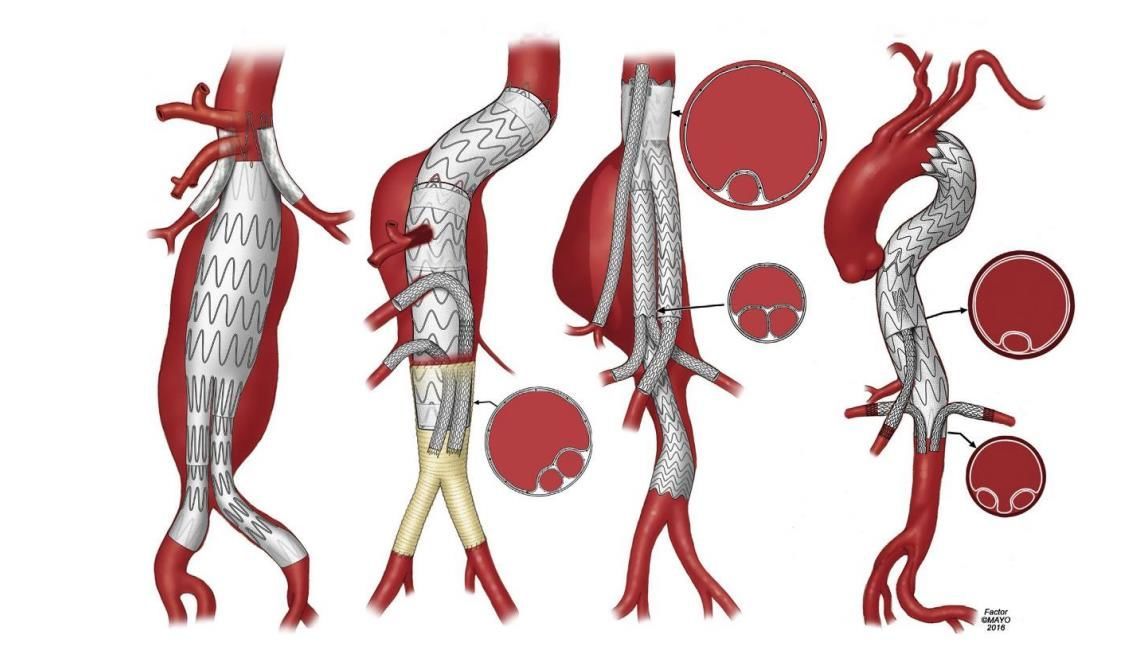
На данный момент кардиохирурги еще не пришли к единому мнению по поводу лучшего метода лечения расслаивающей аневризмы аорты типа А, который также затрагивает дугу аорты. Многие специалисты считают, что оптимальным способом лечения является удаление фенестрированного сегмента аорты, то есть проведение протезирования «полудуги». Другие врачи в данном случае рассматривают полную замену дуги аорты с применением техники «хобот слона» и ее модификаций как наиболее эффективный метод терапии.
Стандартный подход в терапии расслаивающей аневризмы аорты представляет собой операцию на проксимальном участке аорты для предотвращения её разрыва, кровотечения и тампонады сердца. Согласно российским клиническим рекомендациям, касающимся расслоения аорты, пациентам с РА типа А «рекомендовано в короткий срок решение вопроса о хирургическом вмешательстве» (документ находится на рассмотрении) [2].
Основная стратегия заключается в восстановлении исходного (истинного) просвета аорты и нормализации кровотока. К наиболее обоснованным тактикам относится хирургическое вмешательство с резекцией участка первичной фенестрации, коррекцией дефекта корня аорты и аортального клапана при необходимости. В таком случае ложный просвет аорты тромбируется полностью, так как частичное тромбирование может привести к образованию слепого мешка, являющегося фактором риска ремоделирования аорты с последующим ее разрывом.
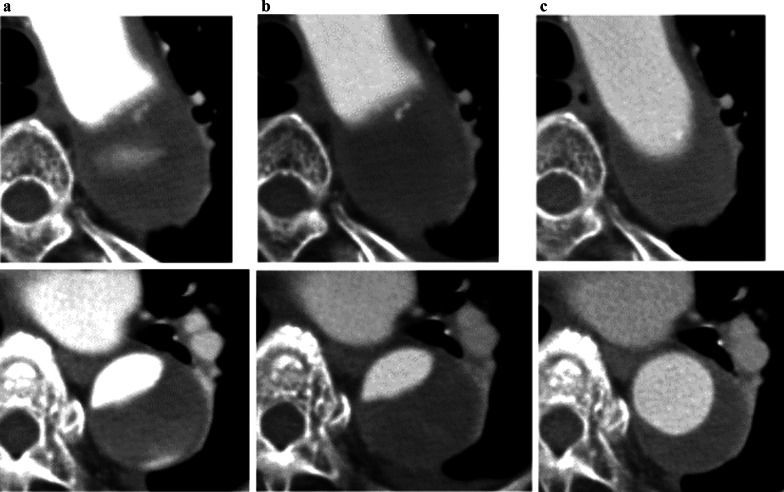
(B) На ранней послеоперационной КТ кровоток из ложного просвета исчез.
(C) На компьютерной томографии через 1 год после операции диаметр сосуда уменьшился, а истинный просвет аорты увеличился в размерах, что указывает на положительный эффект проведенного лечения.
Частичное протезирование
Полудуга
Показанием к операции этого типа является патологическое расширение аорты до уровня левой общей сонной артерии. Поражение корня аорты или участка дуги требует минимального вмешательства, необходимого для восстановления и поддержания истинного кровотока в просвете, восстановления клапанной дееспособности и сохранения жизни пациента.
Однако существуют и более радикальные виды хирургического вмешательства, такие как полное протезирование дуги (TAR) с использованием методики замороженного хобота слона (FET), протезирование без него или при помощи классической техники «хобот слона». В американских сердечно-сосудистых центрах прибегают к полному протезированию дуги при наличии в ней фенестрационного дефекта или в том случае, если ее диаметр увеличивается до 4,5-5 см [4]
После проведения доступа, начала искусственной гипотермии и церебральной перфузии, производится пережатие брахиоцефального ствола. Затем косым разрезом от устья брахиоцефального ствола до устья левой подключичной артерии отсекается пораженный сегмент дуги аорты и накладывается анастомоз с протезом. Проксимальный анастомоз накладывают с восходящей аортой у основания сердца, при необходимости проводят реконструкцию корня аорты.
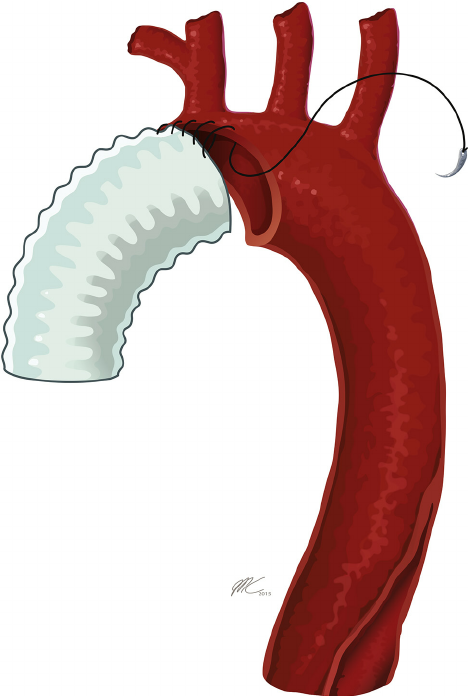
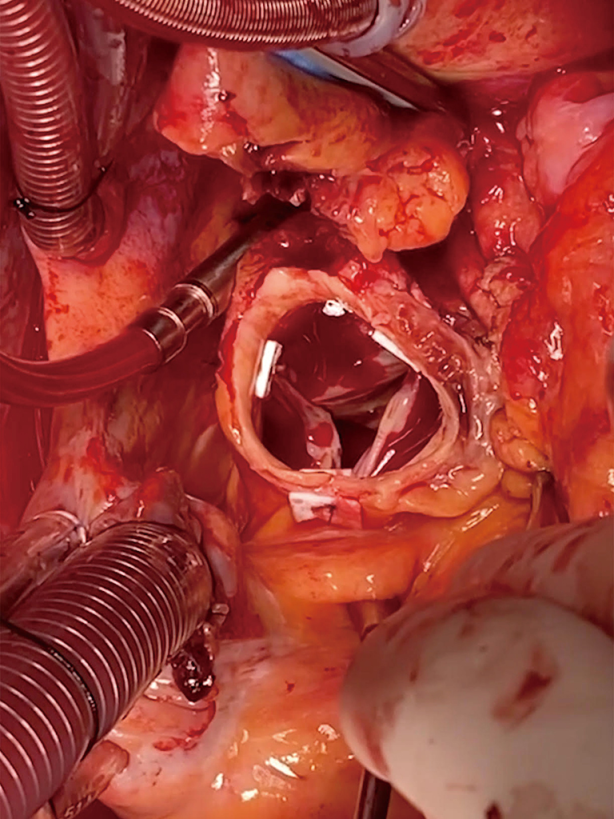
Возможность внутрибольничной летальности данной процедуры составляет приблизительно 12%, и ее возникновение связано с различными осложнениями послеоперационного периода: полиорганной недостаточностью, сердечными катастрофами, неврологическими осложнениями. Десятилетняя выживаемость у прооперированных пациентов составляет около 51% по данным исследования Bartosz Rylski с соавт., опубликованном в 2014 году [7].
Полудуга с TEVAR
При протезировании по методике полудуги вместе с техникой TEVAR (Thoracic Endovascular Aortic Repair – эндоваскулярная пластика грудной аорты) производится сохранение ветвей дуги аорты: брахиоцефального ствола, левой и правой подключичной артерий, левой подмышечной артерии; так же, как и при стандартной технике полудуги.
В дополнение к операции применяется стент-графт, который после выполнения косого разреза аорты антеградно вводится в дугу. Для снижения риска дислокации стент-графта его фиксируют шовным материалом на нативной части дуги аорты. Данная модификация предназначена для пациентов с суженным диаметром истинного просвета аорты при нарушении перфузии ее дистальных отделов.
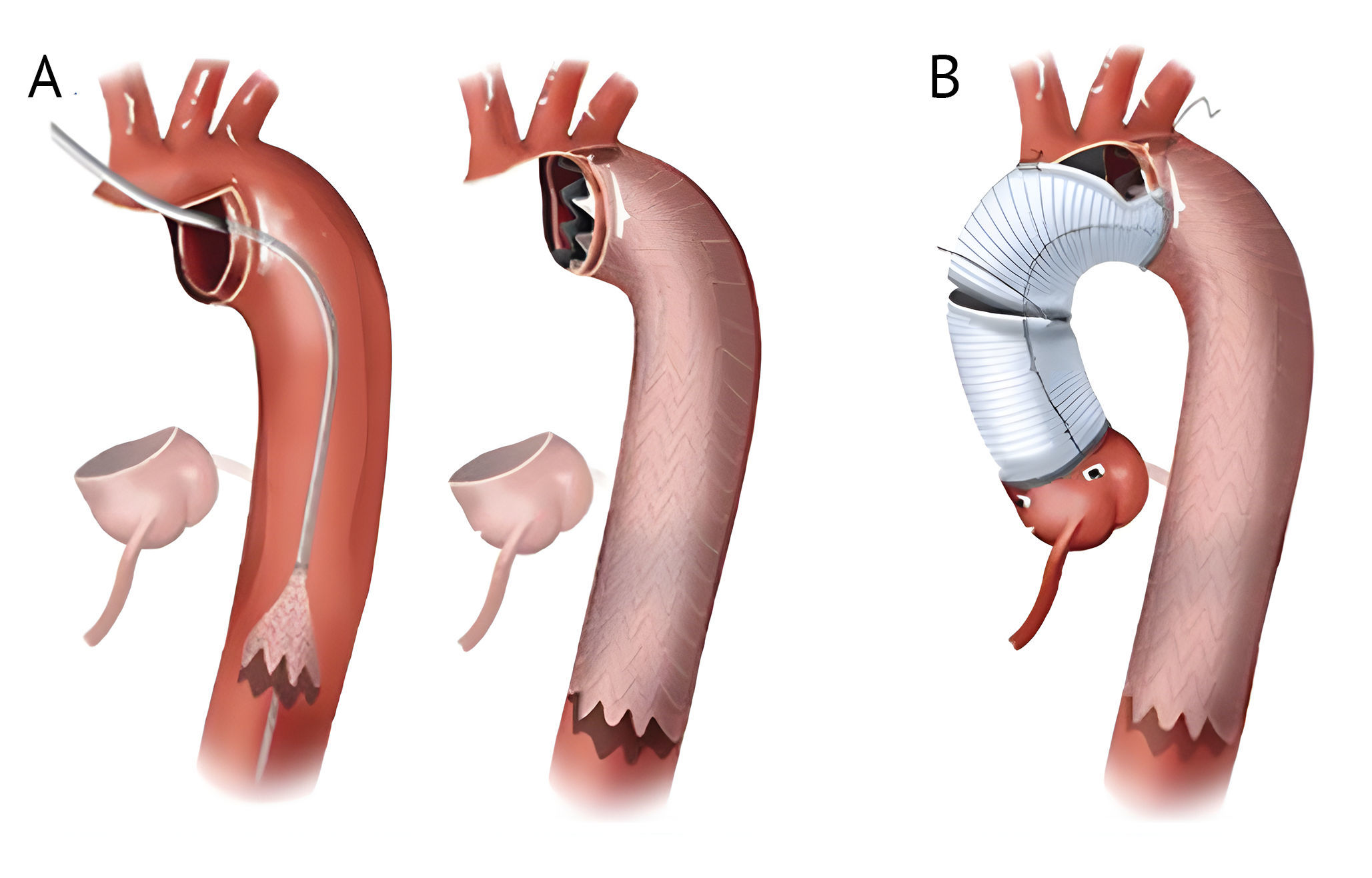
(B) Реконструкция восходящего отдела и полудуги производится с использованием двух лавсановых лоскутов с включением стент-графта в линию шва на малой кривизне [8].
Операция Bentall-de-Bono
В 1968 году H. Bentall и E. De Bono впервые описали использование композитного кондуита с механическим аортальным клапаном. Корень аорты в таком случае заменяется биосовместимым протезом, формируются устья коронарных артерий. Восходящий отдел аорты подшивается к этому кондуиту анастомозом «конец в конец». В настоящее время данная операция остается «золотым стандартом» хирургического лечения аневризм корня и восходящей аорты с измененным аортальным клапаном [9].
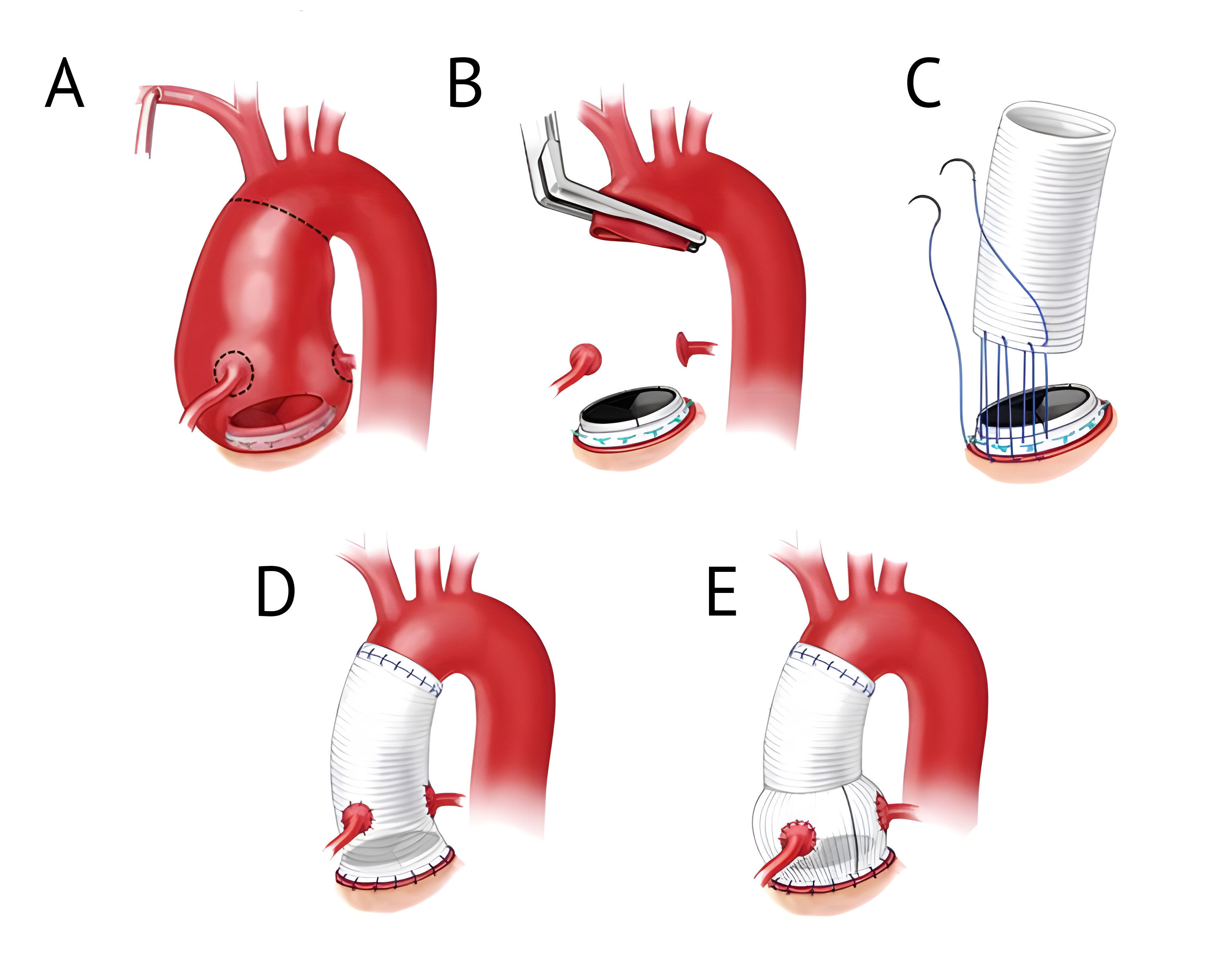
(B) После резекции аневризмы оценивается функциональное состояние клапана, мобилизуется корень аорты и формируются «пуговицы», содержащие устья коронарных артерий и небольшую часть исходной аорты.
(C) Дакроновый графт подшивается к манжете клапана тремя полипропиленовыми швами 2-0. В оригинальной технике использовался тефлоновый графт [10]
(D) После проксимального закрепления трансплантата формируются отверстия для коронарных сосудов. Оформленные ранее «пуговицы» пришиваются к установленному графту. Затем накладывается дистальный анастомоз с восходящей аортой. Проверяется герметичность установки.
(E) Итоговый вид установленного и закрепленного графта.
Использование оригинальной техники H. Bentall с прямой реимплантацией коронарных артерий в корень аорты обусловлено возможными осложнениями в виде формирования ложных аневризм корня аорты по причине натяжения анастомозов в зонах швов.
Главными недостатками данной процедуры являются необходимость пожизненной антикоагулянтной терапии, связанной с заменой клапана аорты, возможное рецидивирование заболеваний аорты у пожилых пациентов, а также возникновение ложных аневризм. Подобные результаты подвигли экспертов на разработку других модификаций замены корня аорты и рассмотрение варианта использования альтернативных кондуитов - биологических протезов аорты из ксеноперикарда, биоинженерных протезов аорты совмещенных с биопротезом клапана сердца.
Операция David
В 1992 году T. David и C. Feindel предложили и реализовали при аневризме аорты с недостаточностью аортального клапана и патологии синусов Вальсальвы у лиц среднего и молодого возраста протезирование аорты с сохранением аортального клапана (в случае его удовлетворительного состояния). При данной манипуляции стенки расширенной аорты иссекаются вместе с синусами Вальсальвы, а створки клапана на комиссурах подвешиваются внутри установленного протеза. Внутри протеза дополнительно воссоздаются устья коронарных артерий. Такая техника операции позволяет стабилизировать фиброзное кольцо аортального клапана за счет фиксации протеза к выходному тракту левого желудочка.
Модифицированная методика David II, опубликованная T. David в 1995 году, применяется для пациентов с преимущественным поражением синусов Вальсальвы, но без расширения фиброзного кольца аортального клапана. Суть протезирования заключается в замене восходящей аорты и всех синусов единым сосудистым трехлоскутным протезом. Устья коронарных артерий также реимплантируются в протез, но укрепление фиброзного аортального кольца при этом не производится. Позже были предложены и другие модификации пластики дефектов аорты. Одна из них представлена ниже.
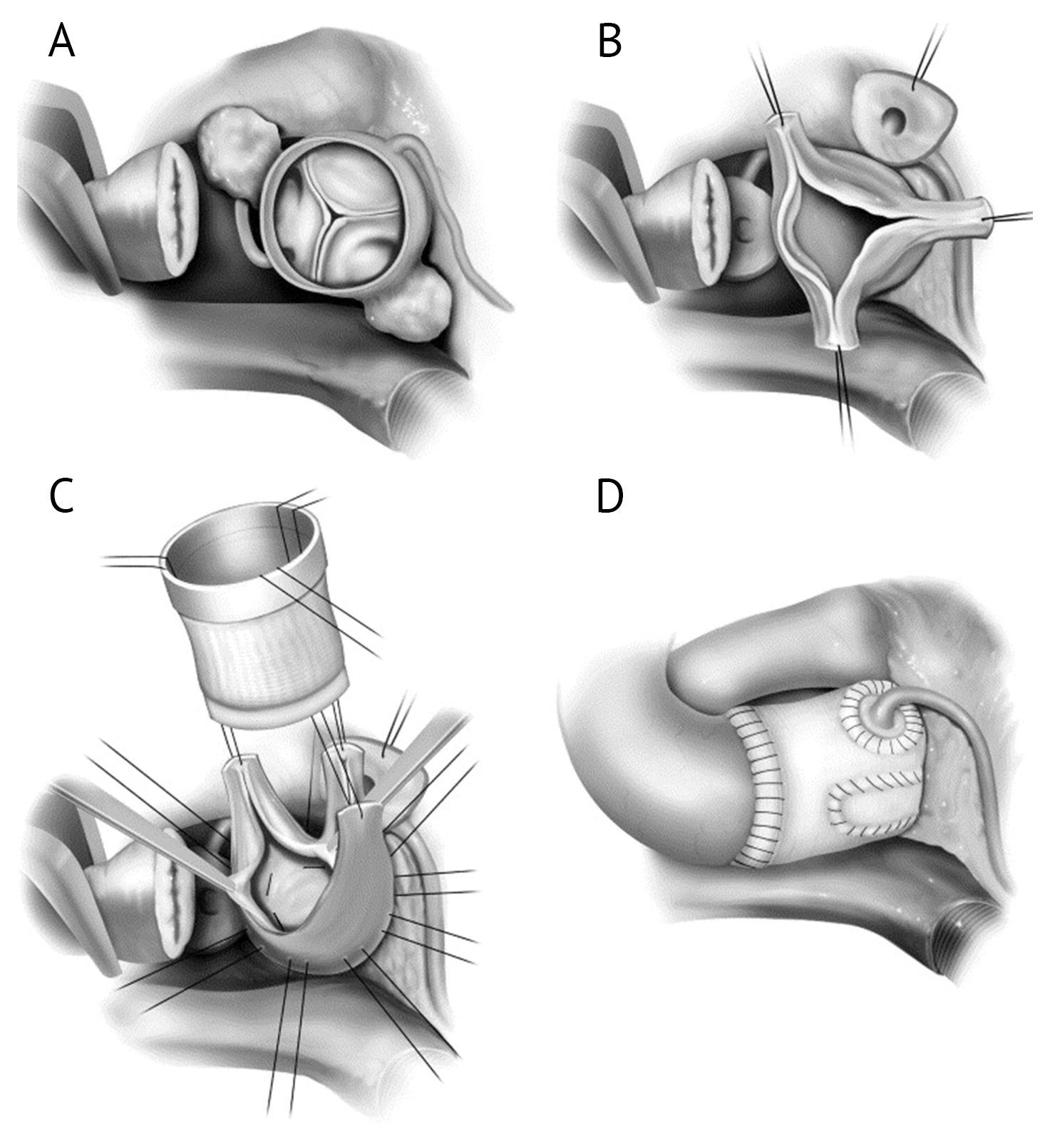
(А) Восходящая аорта разрезана чуть выше синотубулярного соединения. Показано расположение аневризм коронарных артерий.
(B) Иссекается ткань синуса, включая аневризмы, и остается ободок ткани аорты толщиной 3-4 мм. В это время формируются левое и правое коронарное отверстие.
(C) Накладываются горизонтальные матрацные швы из этибонда 2-0 по окружности под створками аортального клапана. Эти швы будут использоваться для закрепления трансплантата синуса Вальсальвы после его мобилизации.
(D) Затем левая и правая коронарные артерии подшиваются к трансплантату. Проводится анастомоз с нативной восходящей аортой для завершения пластики дефектов.
Операция Florida Sleeve
В 2005 году Philip Hess описал метод ремоделирования корня аорты с сохранением аортального клапана – технику Florida Sleeve. Она является методом ремоделирования корня аорты с сохранением не только створок аортального клапана, но также синусов и комиссур. Такой результат достигается путем использования трансплантата с «замочными скважинами» для венечных артерий. Одновременное сужение кольца аорты и синотубулярного соединения после пластики корня аорты компенсирует дисфункцию расширенного аортального отверстия при недостаточности аортального клапана.
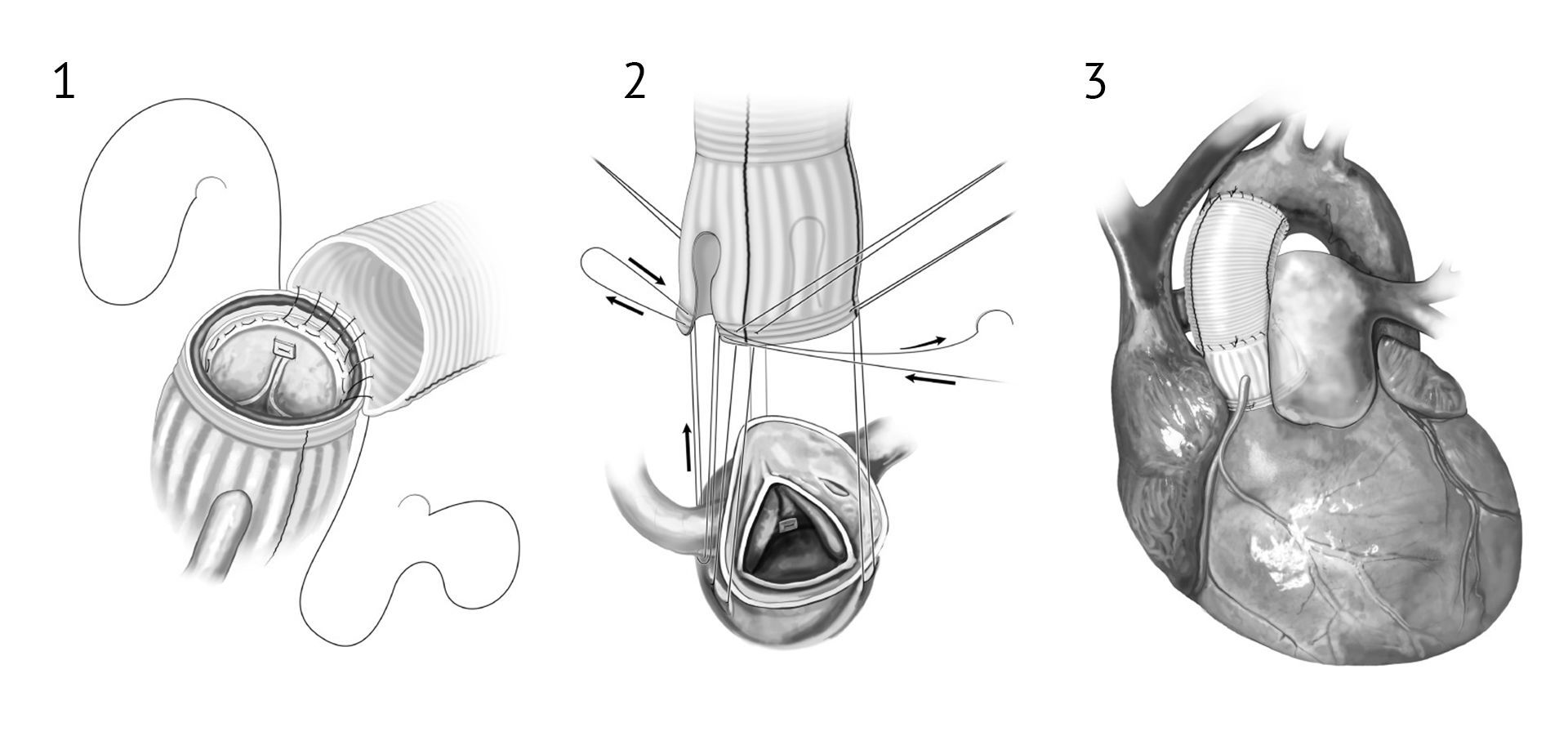
2. Затем на уровне синотубулярного соединения происходит соединение протеза, который приблизительно на 2 мм меньше по диаметру, с восходящей частью аорты. В данном случае возможно наложение биоразлагаемой полигликолевой прокладки на область шва в качестве армирующего материала. Для предотвращения кровотечения очень важно, чтобы проходящий шов соединял трансплантат восходящей аорты со всеми слоями корня аорты, включая биологическую прокладку и графт.
3. После снятия поперечного зажима необходимо тщательно оценить эффективность операции на бьющемся сердце. Проверяется ток крови по коронарным артериям. Регионарные гипокинезии стенки левого или правого желудочка периодически могут быть вызваны стенозом «замочных скважин», что необходимо ликвидировать. Функция клапана оценивается с помощью ЧПЭхоКГ.
После оценки состояния жизненно важных систем, согласно стандартным протоколам, искусственное кровообращение прекращается, пациент деканюлируется и оперативное поле закрывается.
Преимуществом этой операции является техническая простота, заключающаяся в отсутствии необходимости реимплантации устьев коронарных артерий, что уменьшает количество хирургических манипуляций и швов на корне аорты и снижает риск кровотечения. Упрощение техники реконструкции корня аорты ведет к уменьшению времени пережатия аорты и нахождения на АИК в целом. Данная операция является наиболее подходящей для пациентов с аномальным расположением коронарных артерий, двустворчатым клапаном аорты.
Полное протезирование (TAR)
«Хобот слона»
В 1983 году H. Borst предложил использовать методику «хобот слона» для формирования дистального анастомоза при протезировании дуги аорты. Восходящая часть и дуга аорты протезируются после стернотомического доступа таким образом, что свободный конец протеза длиной 10 сантиметров остается без фиксации в нисходящем отделе аорты. Сегмент протеза прошивается по окружности у края культи нисходящего отдела аорты. Название данной процедуры обусловлено тем, длинный участок ксенотрансплантата, не используемый в протезировании, находится в свободном положении.
На втором этапе через левосторонний торакотомический доступ производятся дальнейшие манипуляции на аорте – замена ее аневризматически пораженных участков.
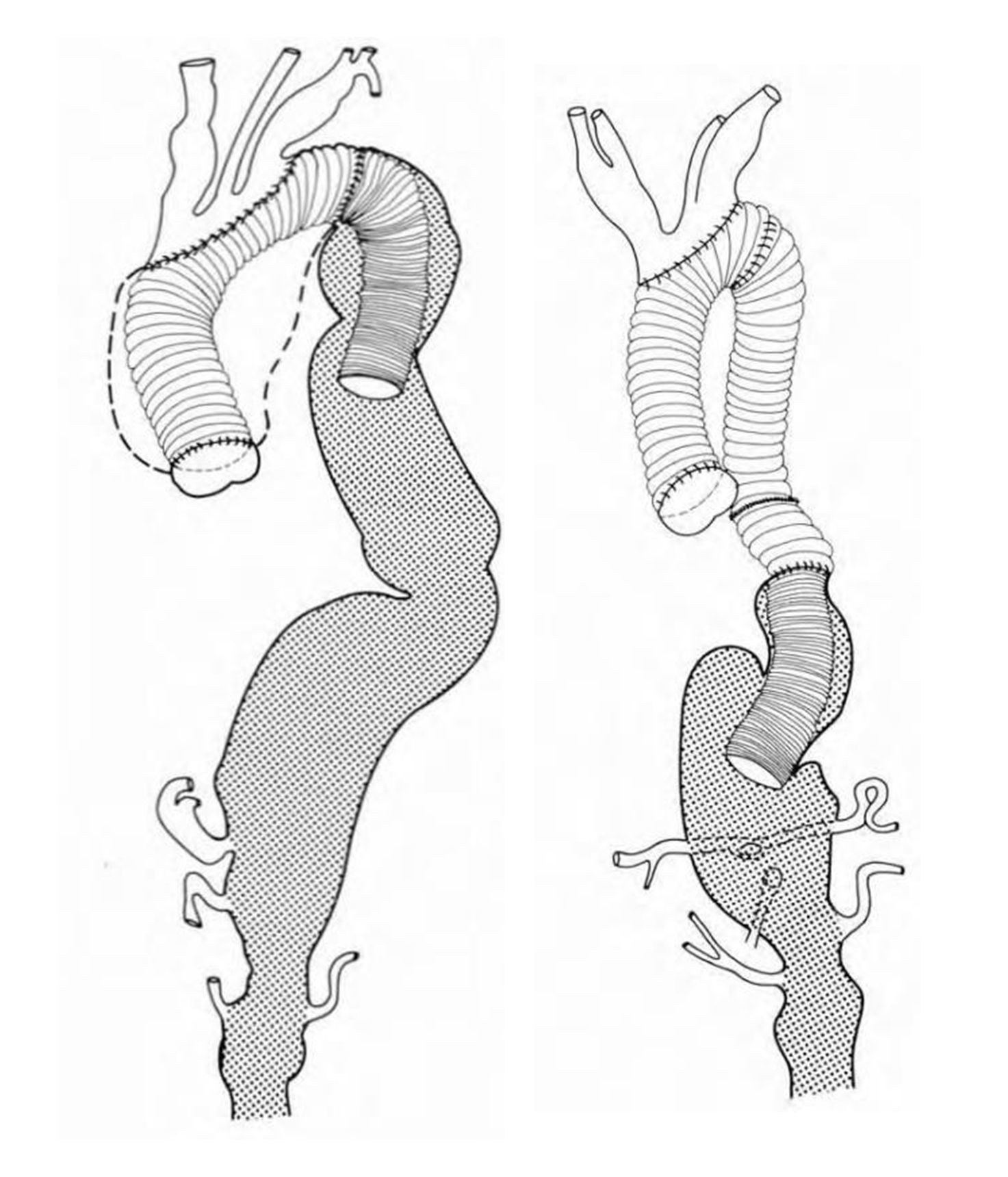
Новизна этого метода заключалась в том, что свободный и флотирующий в просвете конец трансплантата позволял на втором этапе операции производить лишь один анастомоз – с «хоботом» и с другим нисходящим протезом, что сокращало время пребывания пациента на АИК и снижало число необходимых манипуляций за этап. Также снижалась вероятность повреждения легочной артерии или аорты при выделении спаек во время второго этапа операции, что было обычным явлением на ранних этапах пластики аневризмы торакоабдоминальной аорты.
30-дневная летальность после операции «хобот слона», по результатам метаанализа проведенного Р. М. Исаевым с соавт., составила 10 % [14]. После второго этапа операции частота повторных открытых вмешательств составляет 18,6 %.
«Замороженный хобот слона» (FET)
Операция «замороженный хобот слона» (frozen elephant trunk – FET) является модифицированной версией операции, рассмотренной выше. Новый метод был впервые описан Kato с соавт. в 90-х годах 20-го века. Модифицированная одноэтапная операция позволяет проводить одновременную замену дуги аорты с антеградной установкой нисходящего аортального стент-графта, что делает процесс будущего эндоваскулярного вмешательства в дистальном отделе аорты намного проще. Данная процедура совмещает преимущества комбинированного традиционного и эндоваскулярного подхода.
Методика «замороженный хобот слона» широко применяется при остром расслоении аорты типа А и B для восстановления проходимости истинного просвета, закупорки разрывов интимы нисходящей аорты и предотвращения развития тромбоза ложного просвета, а также при хронических дегенеративных аневризмах дуги аорты. Антеградная установка стент-графта является наиболее подходящей для пациентов с затрудненным периферическим доступом.
Расслаивающая аневризма тип B
Открытая операция по Кроуфорду
Показанием к такой процедуре является разрыв аневризмы брюшной аорты. Для этой операции доступ выполняется через торакофренолапаротомию. Шунтирование и обхождение аневризматического участка производятся при помощи синтетического сосудистого протеза из политетрафторэтилена или дакрона различного диаметра. Уровень анастомоза временного шунта зависит от локализации патологического процесса. В частности, может выполняться дополнительная срединная стернотомия, и проксимальный анастомоз временного шунта накладывается на восходящую аорту, а дистальный – на неизмененную часть брюшной аорты, правую общую подвздошную артерию или общую бедренную артерию. В дальнейшем пораженный сегмент аорты, выключенный из кровотока, заменяется трансплантатом с наложением проксимального и дистального анастомоза по типу «конец в конец» непрерывным швом.
Применение торакофренолапаротомного доступа по Кроуфорду имеет ряд недостатков:
- Пересечение левого купола диафрагмы и вскрытие плевральной полости, что приводит к развитию тяжелых кардиореспираторных нарушений у лиц пожилого и старческого возраста;
- Высокая травматичность;
- Большой объем кровопотери;
- Трудоемкость доступа и его последующего закрытия, что увеличивает продолжительность операции [15].
Открытые операции на грудном и торакоабдоминальном отделе аорты сложны в исполнении и сопряжены с высокой летальностью. В работе Joseph S. C. с соавт., выпущенной в 2016 году, показано, что госпитальная летальность при открытых операциях на аорте при данной патологии составляет от 10,2 до 19 % [16].
Эндоваскулярная пластика аорты (EVAR)
Наиболее эффективным методом прекращения распространения ложного просвета аневризмы аорты является окклюзия поврежденной интимы аорты. Самым эффективным в такой ситуации оказалось применение эндопротезирования с целью укрепления сосудистой стенки.
В 1999 году Dake M. D. с соавт. представил технологию TEVAR. В отличие от открытого хирургического вмешательства на аорте, эндоваскулярное вмешательство малоинвазивно и малотравматично. Суть процедуры – перекрытие ложного просвета аорты.
Эндопротезирование аневризмы – современная, часто используемая практика в ангиохирургии, где основным элементом операции служит стент-графт. Стент-графтом является комбинация стента (металлического каркаса) и графта (сосудистого протеза, выполненного из дакрона или политетрафторэтилена и напоминающего аналогичную ткань аорты пациента), которые вместе с рентген аппаратурой создают условия для проведения малоинвазивного вмешательства. Для подбора нужного модуля и размера стент-графта используются данные компьютерной томографии с контрастом.
Начало процедуры эндопротезирования с использованием стент-графта связано с выделением бедренных артерий в верхних 1/3 правого и левого бедра. В дальнейшем через полученный доступ в сосудистую систему вводится катетер-проводник, производится позиционирование стент-графта с применением рентген аппаратуры на патологическом участке аорты. Следующими шагами являются раскрытие металлического каркаса стента до необходимого диаметра и удаление катетера-проводника. На заключительном этапе операции также проводится контрольная ангиография для контроля за правильностью установки стент-графта.
По данным метаанализа 89 исследований Callum H. c соавт., среднее время пребывания в стационаре после перенесенной операции составило 12,01 +/- 4,96 дней [17]. Во время послеоперационного периода частота почечной недостаточности у пациентов с неосложненной РА тип B составила 7,23 %, частота инсульта – 3,92 %.
PETTICOAT и STABILISE
Для повышения эффективности лечения пациентов с РА типа B путем проведения операции EVAR были предложены две техники: PETTICOAT (Provisional Extension To Induce Complete Attachment – временное расширение для полного прикрепления) и STABILISE (Stent-assisted balloon-induced intimal disruption and relamination – стент-ассоциированное повреждение интимы баллоном с ее последующим восстановлением).
Метод PETTICOAT был впервые описан в 2005 году Mossop P. G. с соавт. Из 100 пациентов, которым была проведена реконструкция аорты стент-графтом по причине расслоения аорты типа В, у 12 наблюдалось сужение дистального истинного просвета и перфузия ложного просвета аорты, несмотря на успешную герметизацию проксимальных разрывов [18].
Для решения этой проблемы в качестве дополнительной процедуры был установлен каркасный металлический стент, чтобы произвести дистальное расширение ранее имплантированного стент-графта. В каждом случае аортальный стент расширялся так, чтобы увеличить предыдущий размер стент-графта на 2 мм. При наблюдении в течение 1 года после такого вмешательства не было обнаружено признаков расширения или прогрессирования расслоения аорты в дистальном направлении.
Статья, в которой описывался метод STABILISE, была опубликована группой авторов во главе с C. Raymond в 2013 году. В основе операции лежит их собственный метод STABLE (Staged Total Aortic and Branch Vessel Endovascular – поэтапная тотальная эндоваскулярная реконструкция аорты и ее ветвей). Метод STABLE сочетает эндопротезирование проксимального отдела нисходящей аорты с применением металлического стента на дистальный сегмент замещенного участка. Среднесрочные результаты работы показали снижение роста диаметра поврежденной аорты и улучшение ее ремоделирования в сочетании с низкими периоперационными осложнениями. Выживаемость пациентов в течение 49 месяцев наблюдения, по данным исследования Hofferberth S. с соавт., составила 80 % [19]. Однако, несмотря на вмешательство, у 75 % пациентов при среднесрочном наблюдении наблюдается перфузия ложного просвета аорты [20].
Для случаев, когда расслоение затрагивает висцеральные ветви аорты, потребовалась обновленная методика STABILISE – сочетание эндопротезирования проксимального отдела нисходящей аорты, разрушения расслаивающегося интимального лоскута баллоном и одновременного сопоставления интимального слоя с наружной торакоабдоминальной стенкой аорты с применением расслаивающего стента. В этой процедуре используется расслаивающая эндоваскулярная система, состоящая из эндоваскулярного графта и отдельного стента.
После точного позиционирования в аорте эндоскопический баллон надувается под контролем рентгеноскопии в пределах истинного просвета дистального эндопротеза. Баллонное расширение проводится до разрыва интимального лоскута. Это создает возможность фиксации интимы к стенке аорты. Распространяющийся разрыв интимы способствует одновременному восстановлению прилегания отслоенной интимы к стенке аорты на всем ее протяжении.
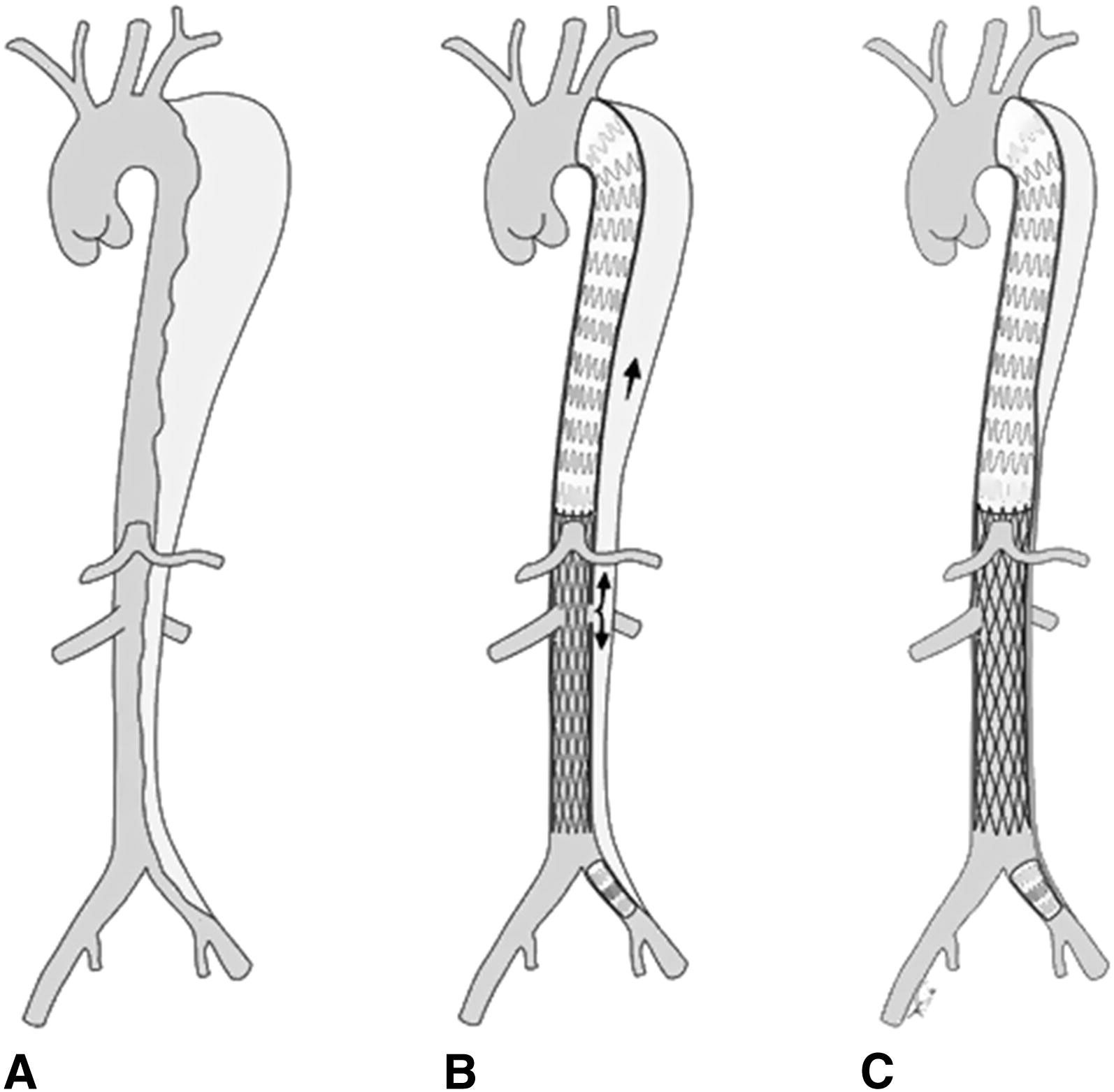
B) После проксимального эндопротезирования с имплантацией металлического стента выше брыжеечного сегмента наблюдается остаточный ток в ложного просвете расслаивающей аневризмы.
С) После баллонного расширения дистального эндотрансплантата и использования расслаивающего стента для облитерации ложного просвета.
После завершения баллонной ангиопластики выполняется контрольная ангиография. Согласно полученным результатам и информации, предоставленной авторами техники, выживаемость после операции составляет 73 % в течение 54-х послеоперационных месяцев, а поздние осложнения в виде смещения стента, эрозии интим-лоскута, повторной диссекции и окклюзии сосудистых ветвей отсутствуют.
Расслаивающая аневризма не тип А и не тип B
Расслоение аорты может не попадать под классическую стэнфордскую классификацию A или B, когда, например, фенестрация находится в дуге аорты. Для нестандартных ситуаций такого вида необходимо внедрение мультидисциплинарных подходов. Объем лечения и тактика должна определяться командой специалистов. Основываясь на опыте лечения пациентов и учитывая значительную сложность лечения расслаивающих аневризм аорты, Мелиссано Дж. с соавт. предлагает отдавать предпочтение раннему интервенционному вмешательству вместо консервативного лечения. Предпочтительными могут также быть классические открытые операции и вмешательства с использованием «замороженного хобота слона». Впоследствии может потребоваться методика TEVAR. Конечный объем вмешательств определяется особенностями конкретного клинического случая.
Таким образом, появление различных техник и методов лечения расслаивающей аневризмы аорты предоставляет широкое поле для научных дискуссий, целью которых является создание оптимальных стратегий лечения пациентов с расслоениями аневризм различного типа. С каждым годом число техник и доработок уже существующих оперативных процедур возрастает. Развитие эндоскопических, малоинвазивных вмешательств приобретает широкое применение в сердечно-сосудистой хирургии, что увеличивает показания к оперативному лечению и позволяет проводить терапию в случаях наличия у пациентов осложненных заболеваниям.
Список литературы:
- Российское общество ангиологов и сосудистых хирургов. Клинические рекомендации «Аневризмы брюшной аорты». URL: https://www.angiolsurgery.org/... (дата обращения 11.02.2024)
- Ассоциация сердечно-сосудистых хирургов России. Клинические рекомендации «Расслоение аорты». URL: https://portalcr.minzdrav.gov.... (дата обращения 11.02.2024)
- Shimizu R., Sumi M., Murakami Y., Ohki T. (2022). False lumen thrombus following aortic dissection diagnosed as the source of repeat lower extremity emboli with angioscopy: a case report. Surgical case reports, 8(1), 65. https://doi.org/10.1186/s40792-022-01416-7
- Мелиссано Дж. Расслоение аорты: личные истории пациентов и достижения, спасшие им жизнь / Дж. Мелиссано, Р. Киеза; пер. с англ. П. А. Каравайкина; под ред. Ю.В. Белова. - М.: Логосфера, 2020. - 464 с.: ил.: ISBN 978-5-98657-069-3
- El-Hamamsy I., Ouzounian M., Demers P., McClure S., Hassan A., Dagenais F., Chu M. W., Pozeg, Z., Bozinovski J., Peterson M. D., Boodhwani, M., McArthur R. G., Appoo J. J., Canadian Thoracic Aortic Collaborative (CTAC) (2016). State-of-the-Art Surgical Management of Acute Type A Aortic Dissection. The Canadian journal of cardiology, 32(1), 100–109. https://doi.org/10.1016/j.cjca... B., Milewski R. K., Bavaria J. E., Vallabhajosyula P., Moser W., Szeto W. Y., Desai N. D. (2014). Long-term results of aggressive hemiarch replacement in 534 patients with type A aortic dissection. The Journal of thoracic and cardiovascular surgery, 148(6), 2981–2985. doi:10.1016/j.jtcvs.2014.05.093
- Habertheuer A., Gleason T., Aranda-Michel E., Kilic A. Bianco, V., Hyzny E., Kassir Z., Navid F., Sultan, I. (2020). Hemiarch replacement with aortic root preservation for acute type A aortic dissection. Journal Of Visualized Surgery, 7. doi:10.21037/jovs-2020-26
- Assi R., Vallabhajosyula P., Szeto W.Y. Hybrid Techniques for Surgical Repair of Acute Type A Aortic Dissection. Endovascular today November 2018 vol. 17, no. 11
- Kadyraliev B., Arutyunyan, V., Kucherenko S., Pavlova V., Spekhova E., Enginoev Soslan. (2021). Successful case of Benthal de Bono surgery in Cabrol modification with one-step aortic arch prosthesis and repeat coronary artery bypass surgery in a patient with de Bakey type 1 acute aortic dissection. Perm Medical Journal. 38. 153-158. doi:10.17816/pmj383153-158.
- Bentall H. De Bono A. A technique for complete replacement of the ascending aorta. Thorax. 1968; 23(4):338-339. doi:10.1136/thx.23.4.338
- Hughes G. C., Swaminathan M., Wolfe W. G. (2006). Reimplantation technique (David operation) for multiple sinus of valsalva aneurysms. The Annals of thoracic surgery, 82(2), e14–e16. https://doi.org/10.1016/j.atho... A., George J., Eric I., Tomas D., Thomas M. Florida Sleeve Operative Technique. Congenital vol. 26, iss. 2, P306-321, 2021. doi: doi.org/10.1053/j.optechstcvs.2020.11.001
- Borst H., Walterbusch G., Schaps D. (1983). Extensive Aortic Replacement using «Elephant Trunk» Prosthesis. The Thoracic and Cardiovascular Surgeon, 31(01), 37–40. doi:10.1055/s-2007-1020290
- Исаев Р. М., Комаров Р. Н., Исмаилбаев А. М., Торчинский Н. В., Полибин Р.В., Вязовиченко Ю. Е., Ткачев М. И., Башмаков Н. С., Танделова П. О. Сравнение операций «хобота слона» и «замороженного хобота слона» в реконструктивной хирургии дуги аорты. Метаанализ ближайших и отдаленных результатов. Кардиологический вестник. 2023;18(3):49‑59.
- Комаров Р. Н., Белов Ю. В., Фролов К. Б., Салех А. З., Чернявский С. В. Протезирование торакоабдоминальной аорты при ее разрыве из лапаротомного доступа по методике Крауфорда. Кардиология и сердечно-сосудистая хирургия. 2016; 9(1):87‑90. doi.org/10.17116/kardio20169187-90
- Coselli J. S., LeMaire S. A., Preventza O., de la Cruz K. I., Cooley D. A., Price, M. D., Stolz A. P., Green S. Y., Arredondo C. N., Rosengart, T. K. (2016). Outcomes of 3309 thoracoabdominal aortic aneurysm repairs. The Journal of thoracic and cardiovascular surgery, 151(5), 1323–1337. doi.org/10.1016/j.jtcvs.2015.12.050
- Howard C., Sheridan J., Picca L., Reza S., Smith T., Ponnapalli A., Calow R., Cross O., Iddawela S., George M., Livra Dias, D., Srinivasan A., Munir W., Bashir M., Idhrees M. (2021). TEVAR for complicated and uncomplicated type B aortic dissection-Systematic review and meta-analysis. Journal of cardiac surgery, 36(10), 3820–3830. doi.org/10.1111/jocs.15827
- Nienaber C. A., Kische S., Zeller T., Rehders T. C., Schneider H., Lorenzen B., Bünger C., Ince H. (2006). Provisional extension to induce complete attachment after stent-graft placement in type B aortic dissection: the PETTICOAT concept. Journal of endovascular therapy: an official journal of the International Society of Endovascular Specialists, 13(6), 738–746. doi.org/10.1583/06-1923.1
- Hofferberth S. C., Newcomb A. E., Yii M. Y., Yap K. K., Boston R. C., Nixon I. K., Mossop P. J. (2012). Combined proximal stent grafting plus distal bare metal stenting for management of aortic dissection: Superior to standard endovascular repair? The Journal of thoracic and cardiovascular surgery, 144(4), 956–962. doi.org/10.1016/j.jtcvs.2012.07.007
- Hofferberth S. C., Nixon I. K., Boston R. C., McLachlan C. S., Mossop P. J. (2014). Stent-assisted balloon-induced intimal disruption and relamination in aortic dissection repair: the STABILISE concept. The Journal of thoracic and cardiovascular surgery, 147(4), 1240–1245. doi.org/10.1016/j.jtcvs.2013.03.036
