Вакцины против ВИЧ-1

ВИЧ-1 был обнаружен в 1983 году и впоследствии было показано, что он является причиной синдрома приобретенного иммунодефицита (СПИД). В 1986 был открыт ВИЧ-2. Он менее распространен, обладает более низкой вирулентностью и не опасен для жизни. Эффективная антиретровирусная лекарственная терапия превратила СПИД из смертельного заболевания в хроническое с почти нормальной продолжительностью жизни. Тем не менее около 1,5 миллиона человек ежегодно заражаются ВИЧ-1. Эффективное лечение и профилактика ВИЧ-1 требуют строгих режимов дозирования и пожизненного приема лекарств. Кроме того, у некоторых ВИЧ-1-инфицированных лиц неизбежно происходит рецидив вируса с развитием лекарственной устойчивости [2]. Таким образом, даже при использовании антиретровирусной лекарственной терапии в качестве профилактики или лечения существует настоятельная потребность в безопасной и эффективной вакцине против ВИЧ-1.
Разработка эффективной вакцины против ВИЧ-1 является особенно сложной задачей из-за исключительного и растущего генетического разнообразия лентивируса ВИЧ-1 [3,4], его механизмов уклонения от иммунитета [5–8] и способности вируса интегрироваться в иммунные клетки хозяина, становясь устойчивым к иммунитету и схемам лечения [9–10]. После почти четырех десятилетий исследований безопасная и эффективная вакцина против ВИЧ-1 остается недостижимой.
Классические вакцины
В первом поколении вакцин, протестированных в клинических испытаниях, в качестве антигена для выработки нейтрализующих антител использовался gp120, тогда как в более поздних работах были протестированы вакцины, предназначенные для выработки ответов CD8+ Т-клеток и нейтрализующих антител[11–13]. Из восьми завершенных к настоящему времени испытаний эффективности вакцины против ВИЧ-1 все, кроме одного, завершились неудачей.
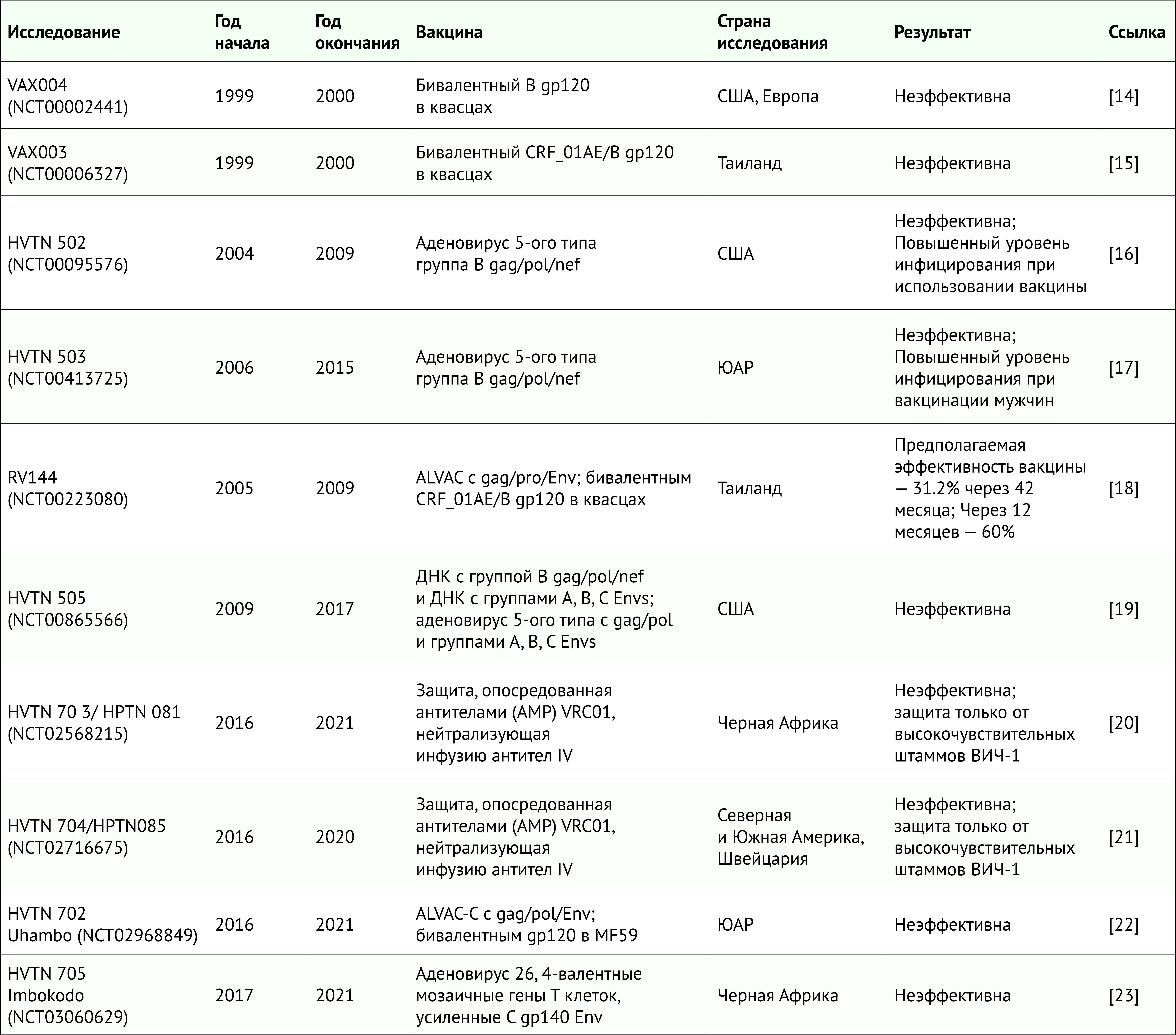
*HVTN — HIV Vaccine Trials Network, RV - ретровирус
В настоящее время наиболее успешные вакцины в клинической практике используют нейтрализующие антитела как основной способ защиты. Для разработки вакцины против ВИЧ-1 повышение индукции широко нейтрализующих антител (bNAbs) является основной целью [24]. При этом не все пациенты, инфицированные ВИЧ-1, вырабатывают необходимые для индуцированного вакциной ответа антитела bNAbs.
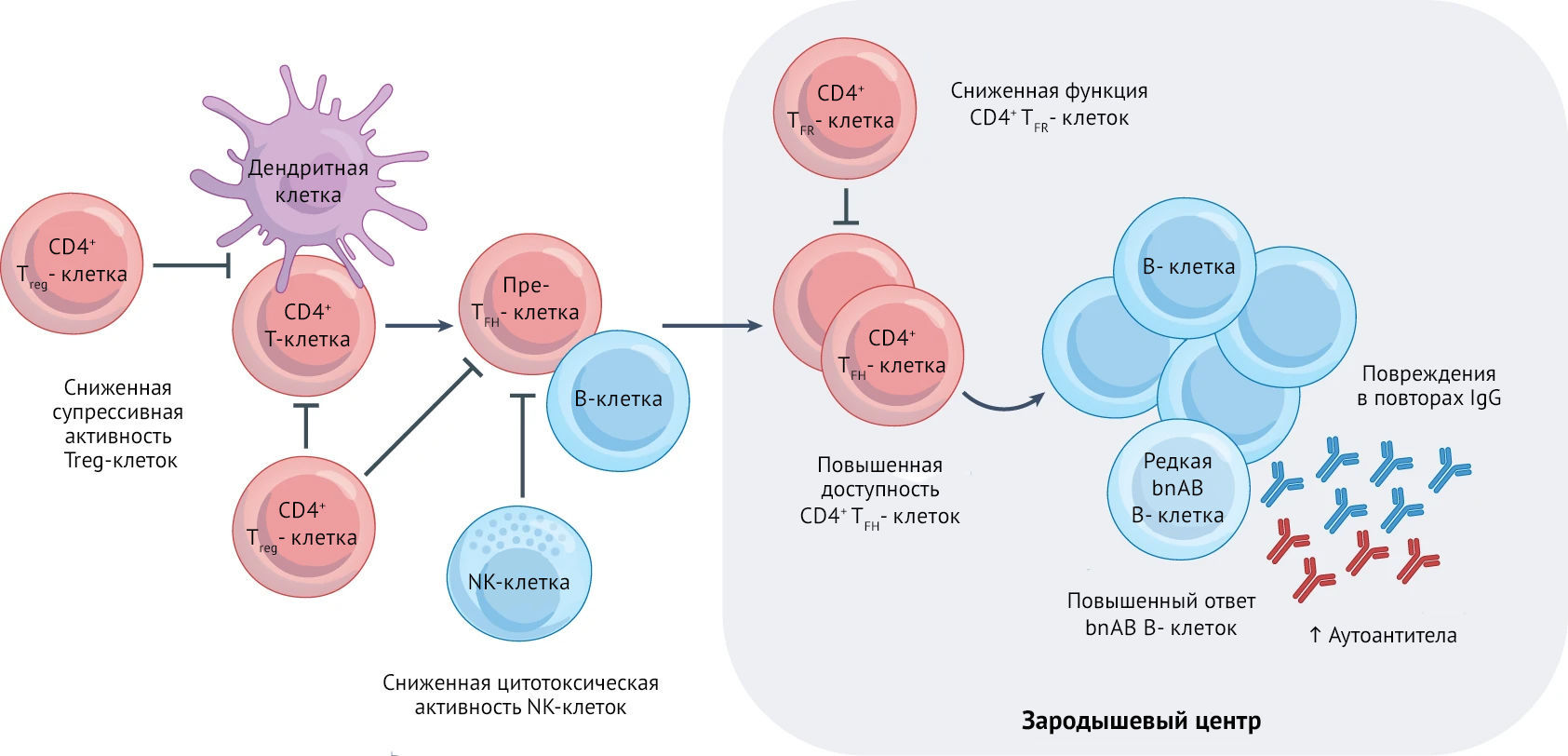
Рисунок 1. Нарушения иммунорегуляторного контроля у лиц, инфицированных ВИЧ-1, которые вырабатывают широко нейтрализующие антитела.
В исследованиях среди пациентов с ВИЧ-1 было показано, что при активной выработке bNAb пациенты имеют вирусную нагрузку от умеренной до высокой [25], а также высокий уровень циркулирующих CD4+ Т-фолликулярных хелперных клеток (TFH), низкий уровень CD4+ регуляторных Т-клеток (Treg) и циркулирующих Т-фолликулярных регуляторных клеток (TFR), высокий уровень аутоантител в плазме и низкий уровень функциональных естественных клеток-киллеров [26].Основной мишенью для bNAb является белок оболочки ВИЧ-1 (Env), который сильно гликозилирован, при этом эпитопы bNAb скрыты как высоким содержанием маннозы, так и сложными гликанами, которые слабо иммуногенны. Преодолеть эти сложности на сегодняшний день не удалось.
Испытание RV144 было единственным клиническим испытанием, продемонстрировавшим значительную защиту у людей [27]. Но получить действующую вакцину против ВИЧ-1 так и не удалось.
Нановакцины
Нановакцины могут повысить эффективность доставки антигена ВИЧ-1 и увеличить индукцию врожденных и адаптивных иммунных реакций [28].
Невирусные нановакцины
Неорганические наночастицы (железо, диоксид кремния, кальций, золото и серебро) используются в качестве носителей для нановакцины. Они подходят для доставки генов в качестве вакцин против вирусной инфекции. Большинство неорганических наночастиц обладают малым гидродинамическим размером, контролируемым образом действия, высокой антигенной нагрузкой, улучшенной стабильностью, минимальной иммунотоксичностью и гибким профилем высвобождения. Эти неорганические нановакцины могут облегчить доставку иммуногена для модуляции эффективной иммунной активации [29].
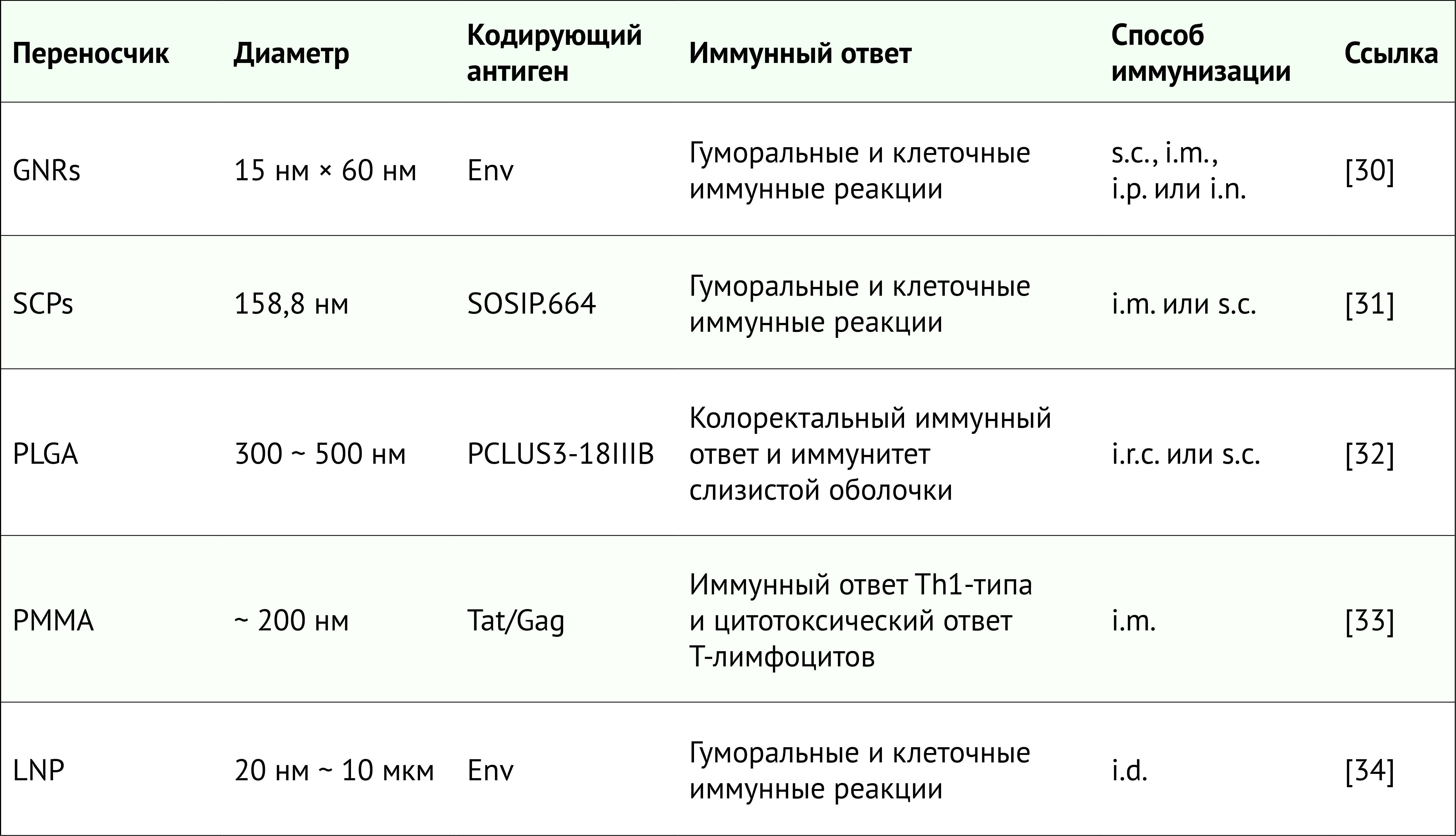
GNRs — золотые наностержни; SCP — покрытые кремнеземом наночастицы фосфата кальция; PLGA — полилактидгликолид; PMMA — полиметилметакрилат; LNP — липидные наночастицы; s.c. — подкожный; i.m. — внутримышечный; i.p. — внутрибрюшинный; i.n. — интраназальный; i.r.c. — интраколоректальный; i.d. — внутрикожно.
Нановакцины с вирусным переносом
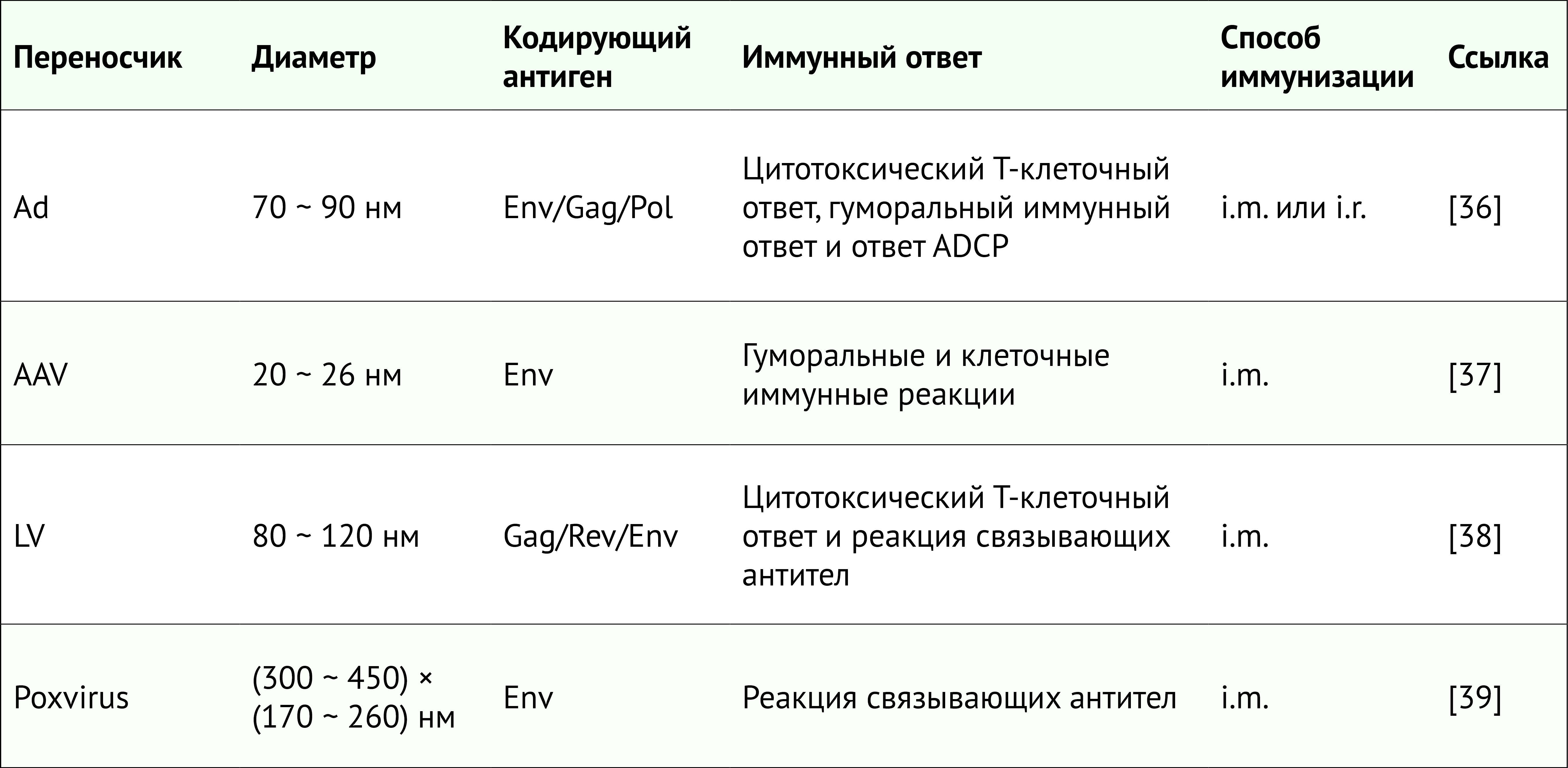
Новые вакцины на основе вирусных переносчиков доставляют мультиплексный геном ВИЧ-1 пациенту либо самостоятельно, либо в рамках стратегии первичной стимуляции. Потенциальные преимущества нановакцин на основе вирусных переносчиков ВИЧ-1 следующие:значительная эффективность, долгосрочный иммунитет, эффективная трансдукция, высокая стабильность вакцины, крупномасштабное производство и выработка иммуногена [35]. Вирусная векторная конструкция состоит из промотора, трансгена и регуляторных элементов, которые обеспечивают упаковку в вектор. Рекомбинантный вирусный вектор используется для доставки трансгена к клеткам-мишеням. Считается, что вирусные векторы запускают интернализацию путем эндоцитоза. Вирусные частицы переносятся в ядро через ядерно-поровый комплекс. В ядре вирусная ДНК высвобождается путем снятия покрытия с последующей транскрипцией и экспортом информационной РНК для трансляции. Продукт экспрессии генов вызывает иммунные реакции, специфичные для ВИЧ-1, после высвобождения.
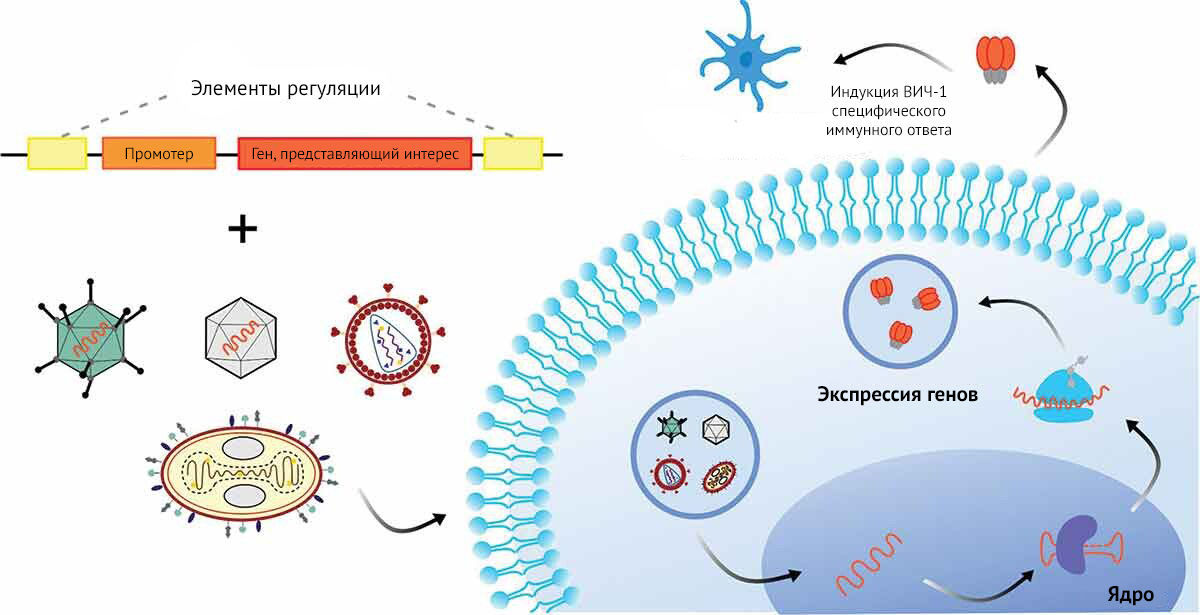
Рисунок 2. Путь трансдукции нановакцин с вирусным переносом для доставки генов против ВИЧ-1. Детали пути распространения не совсем ясны.
В настоящее время разрабатывается ряд вирусных нановакцин с использованием аденовируса, аденоассоциированного вируса, лентивируса. Сообщалось о проведении доклинических испытаний.
Список литературы
- Li S. et al. Nano-vaccines for gene delivery against HIV-1 infection Expert Review of Vaccines. 2023. 22. 1. 315-326.
- Fischer, W. et al. HIV-1 and SARS-CoV-2: patterns in the evolution of two pandemic pathogens. Cell Host Microbe.2021.29.1093–1110.
- Korber, B., Hraber, P., Wagh, K. & Hahn, B. H. Polyvalent vaccine approaches to combat HIV-1 diversity.Immunol. Rev. 201. 275.230–244.
- Haynes, B. F. & Verkoczy, L. Host controls of HIV neutralizing antibodies. Science .2014 .344 .588–589.
- Kelsoe, G. & Haynes, B. F. Host controls of HIV broadly neutralizing antibody development.Immunol. Rev.2017. 275.79–88.
- Kirchhoff, F. Immune evasion and counteraction of restriction factors by HIV-1 and other primate lentiviruses.Cell Host Microbe .2010.8.55–67.
- Watanabe, Y., Bowden, T. A., Wilson, I. A. & Crispin, M. Exploitation of glycosylation in enveloped virus pathobiology.Biochim. Biophys. Acta Gen. Subj.2019.1863.1480–1497.
- Whitney, J. B. et al. Prevention of SIVmac251 reservoir seeding in rhesus monkeys by early antiretroviral therapy. Nat. Commun. 2018.9.5429.
- McMichael, A. J., Borrow, P., Tomaras, G. D., Goonetilleke, N. & Haynes, B. F. The immune response during acute HIV-1 infection: clues for vaccine development. Nat. Rev. Immunol. 2010.10, 11–23.
- Huang, Y. et al. Effect of rAd5-vector HIV-1 preventive vaccines on HIV-1 acquisition: a participant-level meta-analysis of randomized trials. PLoS ONE. 2015.10. e0136626.
- Gray, G. E. et al. Vaccine efficacy of ALVAC-HIV and bivalent subtype C gp120-MF59 in adults. N. Engl. J. Med. 2021. 384. 1089–1100.
- Johnson & Johnson and Global Partners. Johnson & Johnson and Global Partners announce results from phase 2b Imbokodo HIV vaccine clinical trial in young women in sub-Saharan Africa. 2021.
- Gilbert, P. et al. Magnitude and breadth of a nonprotective neutralizing antibody response in an efficacy trial of a candidate HIV-1 gp120 vaccine. J. Infect. Dis. 2010. 202. 595–605.
- Sterrett, S. et al. Low multiplicity of HIV-1 infection and no vaccine enhancement in VAX003 injection drug users. Open Forum Infect. Dis. 1, ofu056 (2014).
- Curlin, M. E. et al. Long-term mucosal T cell activation and homing phenotypes in recipients of an Ad5-vectored HIV vaccine. Vaccine 2020. 38. 5814–5821.
- Hertz, T. et al. A study of vaccine-induced immune pressure on breakthrough infections in the Phambili phase 2b HIV-1 vaccine efficacy trial. Vaccine 2016. 34. 5792–5801.
- Zhao, L. P. et al. Landscapes of binding antibody and T-cell responses to pox-protein HIV vaccines in Thais and South Africans. PLoS ONE 2020. 15. e0226803.
- Neidich, S. D. et al. Antibody Fc effector functions and IgG3 associate with decreased HIV-1 risk. J. Clin. Invest. 2019. 129. 4838–4849.
- Mgodi, N. M. et al. A phase 2b study to evaluate the safety and efficacy of VRC01 broadly neutralizing monoclonal antibody in reducing acquisition of HIV-1 infection in women in sub-Saharan Africa: baseline findings. J. Acquir. Immune Defic. Syndr. 2021. 87. 680–687.
- Edupuganti, S. et al. Feasibility and successful enrollment in a proof-of-concept HIV prevention trial of VRC01, a broadly neutralizing HIV-1 monoclonal antibody. J. Acquir. Immune Defic. Syndr. 2021. 87. 671–679.
- Laher, F. et al. Willingness to use HIV prevention methods among vaccine efficacy trial participants in Soweto, South Africa: discretion is important. BMC Public. Health 2020. 20. 1669.
- Barouch, D. H. et al. Evaluation of a mosaic HIV-1 vaccine in a multicentre, randomised, double-blind, placebo-controlled, phase 1/2a clinical trial (APPROACH) and in rhesus monkeys (NHP 13-19). Lancet 2018.392.232–243.
- Burton, D. R. Advancing an HIV vaccine; advancing vaccinology. Nat. Rev. Immunol. 2019. 19. 77–78 .
- Moore, P. L., Williamson, C. & Morris, L. Virological features associated with the development of broadly neutralizing antibodies to HIV-1. Trends Microbiol. 2015. 23. 204–211.
- Bradley, T. et al. RAB11FIP5 expression and altered natural killer cell function are associated with induction of HIV broadly neutralizing antibody responses. Cell 2018. 175. 387–399.e17.
- Rerks-Ngarm S, Pitisuttithum P, Nitayaphan S, et al. Vaccination with ALVAC and AIDSVAX to prevent HIV-1 infection in Thailand. N Engl J Med. 2009 Dec 3;361(23):2209–2220.
- Zaheer T, Pal K, Zaheer I. Topical review on nano-vaccinology: biochemical promises and key challenges. Process Biochem. 2021 Jan;100:237–244.
- Duan Y, Wang S, Zhang Q, et al. Nanoparticle approaches against SARS-CoV-2 infection. Current Opinion in Solid State & Mater Sci. 2021 Dec;25(6).
- Xu L, Liu Y, Chen Z, et al. Surface-engineered gold nanorods: promising DNA vaccine adjuvant for HIV-1 treatment. Nano Lett. 2012 Apr;12(4):2003–2012.
- Li S, Wang B, Jiang S, et al. Surface-functionalized silica-coated calcium phosphate nanoparticles efficiently deliver DNA-based HIV-1 trimeric envelope vaccines against HIV-1. ACS Appl Mater Interfaces. 2021 Nov 17;13(45):53630–53645.
- Zhu Q, Talton J, Zhang G, et al. Large intestine-targeted, nanoparticle-releasing oral vaccine to control genitorectal viral infection. Nat Med. 2012 Aug;18(8):1291–+.
- Castaldello A, Brocca-Cofano E, Voltan R, et al. DNA prime and protein boost immunization with innovative polymeric cationic core-shell nanoparticles elicits broad immune responses and strongly enhance cellular responses of HIV-1 tat DNA vaccination. Vaccine. 2006 Jul 17;24(29–30):5655–5669.
- Pardi N, LaBranche CC, Ferrari G, et al. Characterization of HIV-1 nucleoside-modified mRNA vaccines in rabbits and rhesus macaques. Mol Ther Nucleic Acids. 2019 Apr 15;15:36–47.
- McCann N, O’Connor D, Lambe T, et al. Viral vector vaccines. Curr Opin Immunol. 2022 Aug;77
- Travieso T, Li J, Mahesh S, et al. The use of viral vectors in vaccine development. Npj Vaccines. 2022 Jul 4;7(1).
- Baden LR, Walsh SR, Seaman MS, et al. First-in-human evaluation of the safety and immunogenicity of a recombinant adenovirus serotype 26 HIV-1 Env vaccine (IPCAVD 001). J Infect Dis. 2013 Jan 15;207(2):240–247.
- Li S, Qiao Y, Jiang S, et al. Broad and potent bispecific neutralizing antibody gene delivery using adeno-associated viral vectors for passive immunization against HIV-1. J Control Release. 2021 Oct 10;338:633–643.
- Buffa V, Negri DRM, Leone P, et al. A single administration of lentiviral vectors expressing either full-length human immunodeficiency virus 1 (HIV-1)(HXB2) Rev/Env or codon-optimized HIV-1(JR-FL) gp120 generates durable immune responses in mice. J Gen Virol. 2006 Jun;87(6):1625–1634.
- Ratto-Kim S, Currier JR, Cox JH, et al. Heterologous prime-boost regimens using rAd35 and rMVA vectors elicit stronger cellular immune responses to HIV proteins than homologous regimens. PLoS One. 2012 Sep 26;7(9):e45840.
