Бутирилхолинэстераза против кокаина

Японские биотехнологи предложили бороться с кокаиновой зависимостью с помощью генетически отредактированных кожных трансплантов, экспрессирующих псевдохолинэстеразу.
Псевдохолинэстераза (ПХЭ, она же бутирилхолинэстераза) в норме секретируется в гепатоцитах и является «родственником» синаптической ацетилхолинэстеразы. ПХЭ занимается катализом реакций гидролиза циркулирующих в крови прокаина, кокаина, суксаметония йодида, фосфоорганических пестицидов и других токсических соединений. Она также гидролизует нейромедиатор ацетилхолин, но гораздо медленнее, чем кокаин.
Учитывая большую проблему здравоохранения, связанную с кокаиновой зависимостью, становится заманчивой идея использовать этот фермент для эндогенной инактивации кокаина. Ситуация обостряется тем, что в отличие от других классов аддиктивов, таких как опиоиды или никотин, от кокаиновой зависимости не существует специальных и одобренных FDA способов терапии.
В частности, это связано с трудностью создания молекул-антагонистов кокаина (который повышает уровень дофамина, стимулирющего центры внутреннего подкрепления), не оказывающих подкрепляющее действие подобно кокаину, что, собственно, может потом также вызывать пристрастие. И поэтому в лечении кокаиновой зависимости напрашивается поиск иных подходов.
Одним из решений является использование биологических макромолекул, а именно антител к кокаину, которые его бы связывали или разрушали, препятствуя таким образом проникновению в мозг. Такие антикокаиновые вакцины были опробованы на людях, однако безрезультатно — по большей части в связи с тем, что достаточно сложно нейтрализовать кокаин до настолько низких концентраций в крови, чтобы предотвратить достижение его ЦНС и эффектов на систему внутреннего подкрепления.
И недавно Xiaoyang Xu с коллегами в своей публикации предложили другой способ решения проблемы — кожный трансплантат с CRISPR-модифицированными клетками, экспрессирующими ПХЭ.
У людей с врожденным дефектом этого фермента наблюдаются острые жизнеугрожающие реакции на кокаин ввиду его медленной элиминации (и как следствие — большой кумуляции). С другой стороны, внутривенное введение рекомбинантной ПХЭ крысам в дозах, создающих ее концентрации в 800 раз превышающие нормальные, снижает частоту судорог, гипертензии и аритмии, вызываемых кокаином. Препарат рекомбинантной ПХЭ также ослабляет психостимулирующие эффекты кокаина у грызунов. Однако такая терапия не оказывала влияние на действие кокаина при его внутривенном введении, то есть даже высоких уровней ПХЭ недостаточно для ослабления центрального действия кокаина и вызывания пристрастия.
Напротив, внутривенное введение генноинженерного варианта ПХЭ с высокой гидролитической активностью в отношении кокаина уменьшало пристрастие к наркотику у грызунов и обезьян саймири (т.н. беличьи обезьяны).
Хотя все еще неясно, каким образом генно-инженерная ПХЭ, имеющая короткий период полуэлиминации, может экспрессироваться в достаточно высоких количествах на протяжении долгих периодов (месяцев или даже лет), чтобы использоваться для лечения кокаиновой зависимости у людей.
Используя достижения недавней технологии по созданию кожных трансплантатов, экспрессирующих глюкагоноподобный пептид-1, Xu с коллегами опробовали возможность редактировать геном эпидермальных стволовых клеток при помощи CRISPR, чтобы заставить их экспрессировать генетически модифицированную человеческую ПХЭ. Они предполагали, что после дифференцировки в ткани кожи эти клетки могут быть трансплантированы с целью создания больших концентраций ПХЭ в организме хозяина. Чтобы проверить возможность такой технологии (Рис. 1) они при помощи CRISPR добавили в геном эпидермальных стволовых клеток ген человеческой ПХЭ и показали что эти клетки действительно могут дифференцироваться в органоиды кожи, стабильно экспрессирующие ПХЭ.
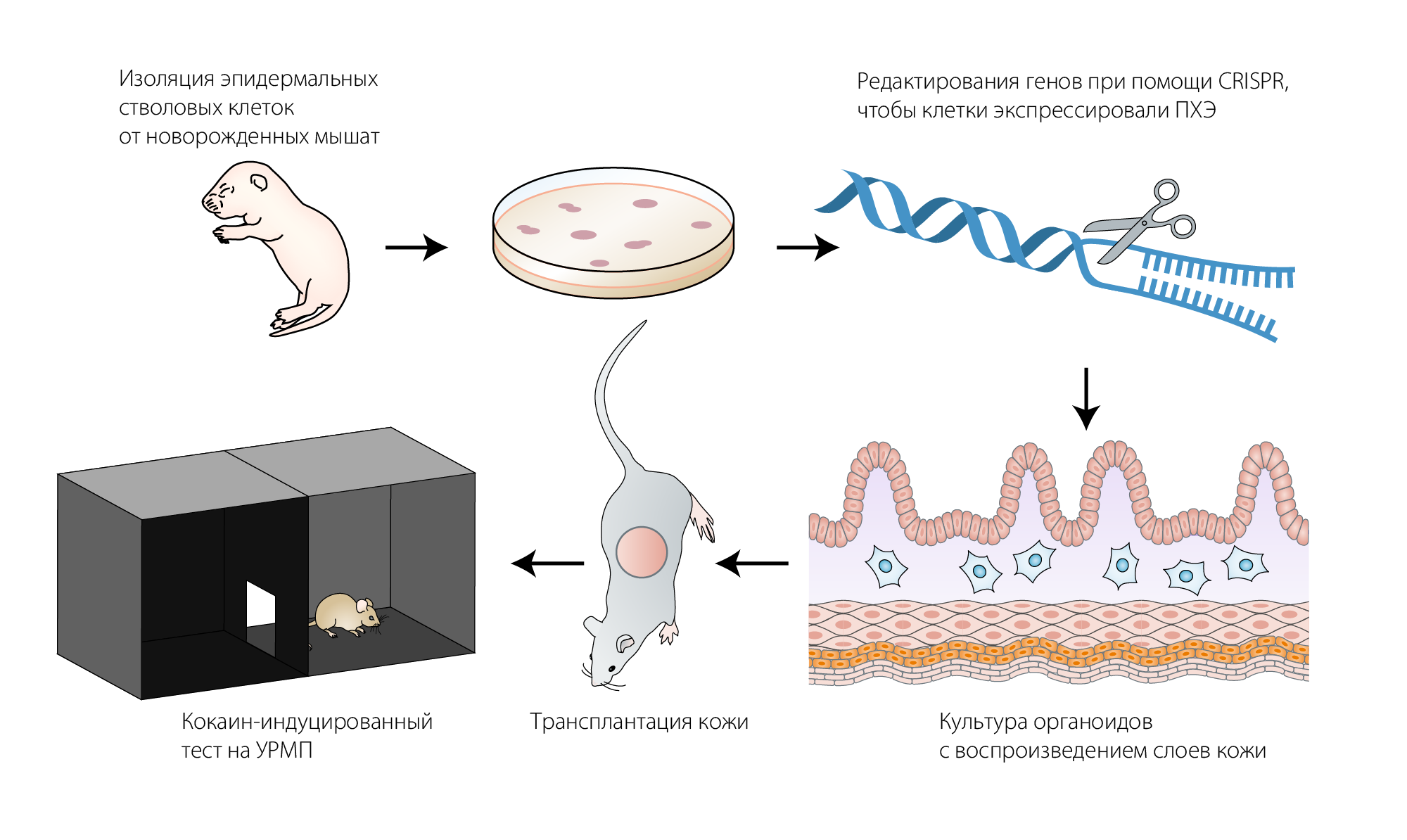
Рисунок 1. Кожные трансплантаты, секретирующие кокаин-метаболизирующий фермент.
Стволовые клетки кожи, полученные от новорожденных мышей, отредактированы при помощи CRISPR для экспрессирования ПХЭ и выращены в культуре для формирования органоидов кожи. Затем эти органоиды трансплантировали мышам и провели эксперименты на устойчивость против кокаиновой зависимости, такие как тест на условную реакцию предпочтения места (УРПМ, форма условного рефлекса для оценки влияния воздействий на мотивацию).
Затем эти органоиды трансплантировали изогенным мышам. Трансплантаты прижились без признаков отторжения (РТПХ) или других нежелательных явлений. Поле десяти недель эксперимента у таких мышей наблюдались высокие уровни ПХЭ в крови (по сравнению с контрольной группой, которой пересадили неотредактированные трансплантаты), что подтверждало состоятельность модели: генетически-модифицированные кожные трансплантаты действительно секретировали большие количества ПХЭ на протяжении долгого времени, что подходило для использования этой методики в лечении кокаиновой зависимости у людей в будущем.
Xu и соавторы также изучили нейрохимические и поведенческие эффекты кокаина у мышей с ПХЭ-экспрессирующими кожными трансплантатами: после внутрибрюшинной инъекции кокаина его метаболизм происходил значительно быстрее, чем у мышей из контрольной группы (с генетически интактными трансплантатами). Кроме того, у этих мышей также ослаблялось повышение уровня дофамина в прилежащем ядре (участке мозга, отвечающем за развитие зависимости) после введения кокаина. Соответственно ослаблялись и психостимулирующие эффекты кокаина. И самое главное, у мышей с ПХЭ-экспрессирующими трансплантами значительно слабее запускалось поведение, направленное на поиск следующей дозы кокаина.
Эти мыши демонстрировали большую толерантность к токсическому действию высоких доз кокаина, что проявлялось меньшей летальностью по сравнению с контрольной группой, а значит, пересадка ПХЭ-экспрессирующих кожных трансплантатов может быть эффективна не только для лечения кокаиновой зависимости, но и для предотвращения передозировки.
Привлекательной особенностью этого способа является то, что кожа поддается генетическому редактированию даже у взрослых и что такие генетически модифицированные трансплантаты можно впоследствии удалить. Ожидается, что эта технология сможет обеспечить достаточные уровни циркулирующей ПХЭ в плазме крови на протяжении периодов, достаточных для излечения от кокаиновой зависимости у людей. Авторы уточняют, что этот способ может быть использован совместно с фармакологическими вмешательствами и психотерапией (так называемым управлением кризисными состояниями, провоцирующих срыв, contingency management).
Тем не менее, до начала клинических испытаний еще предстоит решить ряд проблем. Во-первых, остается неясным, смогут ли высокие уровни ПХЭ, достигаемые с помощью кожных трансплантатов, заблокировать большие пики концентрации кокаина в крови после его приема распространенными способами — интраназально и внутривенно. Дело в том, что в данном исследовании использовалось внутрибрюшинное введение, которое дает постепенное повышение уровня кокаина в крови.
Это очень важно, так как смысл борьбы с зависимостью здесь не только в том, чтобы просто уменьшить суммарное количество кокаина, попавшего в мозг, а еще и в том, насколько быстро он достигает ЦНС после введения.
А поэтому для начала стоит протестировать, насколько такие трансплантаты эффективны для борьбы с пристрастием у грызунов и приматов в условиях самоконтролируемого внутривенного введения кокаина (когда уровни кокаина в крови и мозге резко повышаются после инъекции).
Во-вторых, хорошо известно, что у животных, получавших блокаторы дофаминовых рецепторов. которые ослабляют подкрепляющее действие кокаина, часто увеличивалось потребление наркотика. Следовательно, есть риск, что лабораторные животные или люди с такими трансплантами также будут повышать дозировку кокаина, а не прекращать его употребление.
В-третьих, долговременное повышение ПХЭ в крови может привести к гидролизу других субстратов, вызывая острые или же постепенно развивающиеся побочные эффекты. Например, что, если умеренный гидролиз ацетилхолина в периферических тканях вызовет нарушения работы органов и спровоцирует заболевания? Большой потенциал этой технологии требует дополнительных исследований, направленных на решение данных вопросов.
Публикация: Genome-edited skin epidermal stem cells protect mice from cocaine-seeking behaviour and cocaine overdose
