Ключевые признаки COVID-19

Аннотация
Коронавирус-2 тяжелого острого респираторного синдрома (SARS-CoV-2) – это новый коронавирус, который вызвал всемирную пандемию респираторного заболевания человека COVID-19, что привело к серьезной угрозе общественному здоровью и безопасности. Анализ генетического древа позволяет предположить, что SARS-CoV-2 относится к той же группе β-коронавирусов, что и коронавирусы тяжелого острого респираторного синдрома (SARS-CoV) и ближневосточного респираторного синдрома (MERS-CoV). Хотя путь передачи вируса по-прежнему остается загадкой, по поводу происхождения SARS-CoV-2 можно предположительно сказать, что он возник в резервуаре животных, вероятно, летучих мышей. Клинические особенности COVID-19, такие как лихорадка, кашель, одышка и усталость, аналогичны таковым при многих острых респираторных инфекциях. В настоящее время специфического лечения COVID-19 не существует, но основной стратегией остается противовирусная терапия в сочетании с поддерживающим лечением. В данной работе авторы подводят итог недавнему прогрессу в понимании эпидемиологических, вирусологических и клинических характеристик COVID-19, а также обсуждают потенциальные мишени уже существующих препаратов для лечения этого набирающего обороты зоонозного заболевания.
Вступление
Испокон веку люди страдают от смертельных инфекционных заболеваний, включая вирусные. Коронавирус-2 тяжелого острого респираторного синдрома (SARS-CoV-2) — это недавно идентифицированный вирус, который отличается от коронавирусов тяжелого острого респираторного синдрома (SARS-CoV) и ближневосточного респираторного синдрома (MERS-CoV), но может вызывать сходную симптоматику, прежде всего пневмонию (таблица 1) [1,2]. Всемирная организация здравоохранения (ВОЗ) назвала это вирусное заболевание «COVID-19»; впервые оно было выявлено в городе Ухань (провинция Хубэй, Китай) в декабре 2019 года. Истоки его могут быть связаны с употреблением в пищу диких животных — установившейся традицией в древнейшей из человеческих культур. После своего появления в Таиланде вирус распространился более чем на 200 стран и территорий. ВОЗ объявила это заболевание чрезвычайной ситуацией в сфере общественного здравоохранения, имеющей международное значение, — пандемией.
Таблица 1 | Основные различия между COVID-19, SARS, и MERS
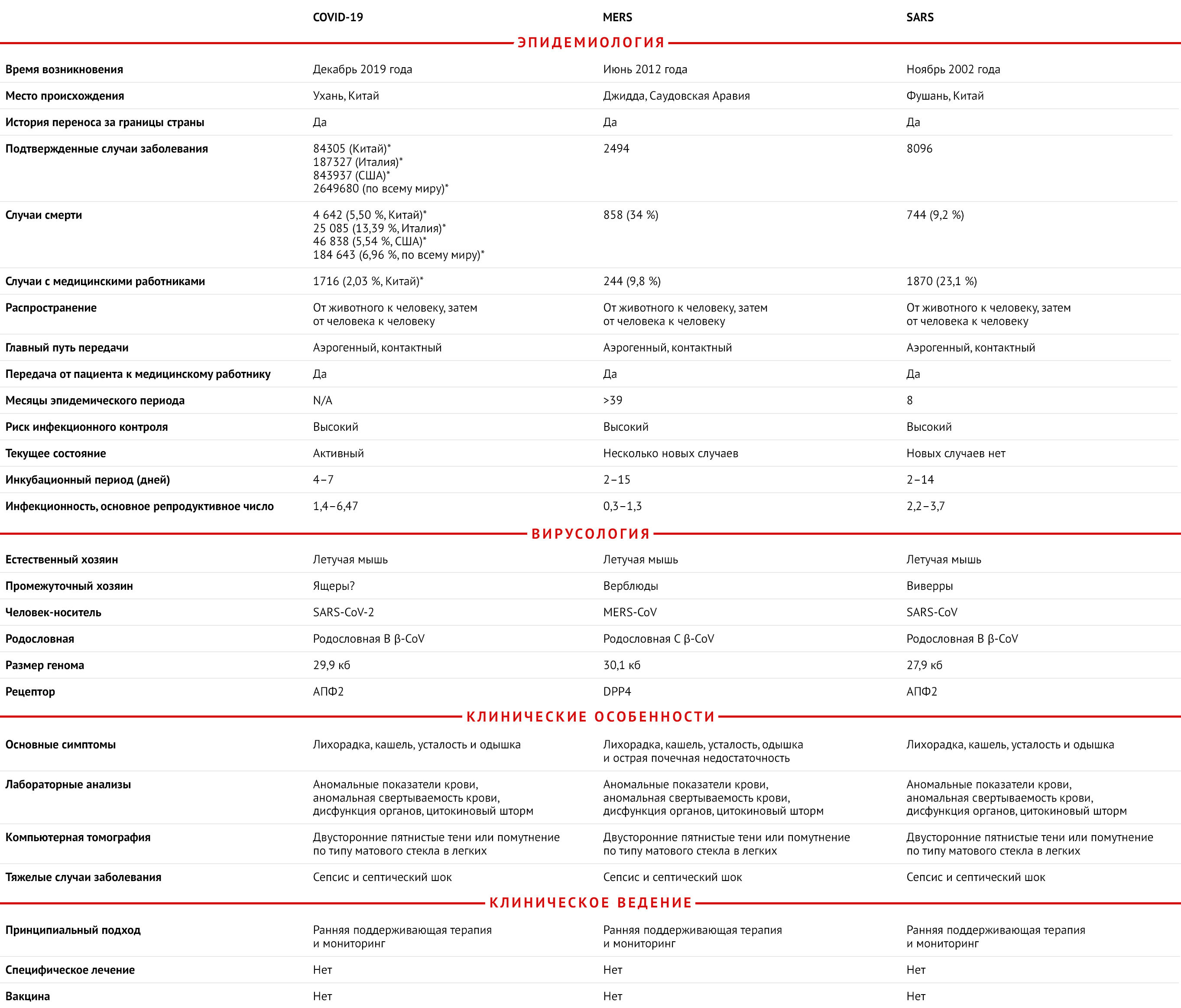
* Данные об инфицированных и умерших по состоянию на 23 апреля 2020 года
Чрезвычайная ситуация в области общественного здравоохранения, имеющая международное значение
Чрезвычайная ситуация в области общественного здравоохранения, имеющая международное значение (в рамках данного перевода обозначается как ЧСМЗ — прим. пер.) — это официальное заявление чрезвычайного комитета ВОЗ относительно экстраординарного события, представляющего риск для здоровья населения в других государствах, которое может потребовать скоординированных международных ответных мер. ЧСМЗ впервые получила определение в пересмотренных международных медико-санитарных правилах (ММСП) в 2005 году, они обеспечивают правовую основу для проведения мероприятий в области общественного здравоохранения. Согласно ММСП (2005 г.), все государства, являющиеся членами ВОЗ, обязаны выявлять, сообщать и реагировать на чрезвычайные ситуации в области общественного здравоохранения, которые отвечают любым двум из следующих четырех критериев: 1) является ли серьезным влияние данного события на здоровье населения; 2) является ли событие необычным или неожиданным; 3) имеется ли существенный риск распространения в международных масштабах; 4) имеется ли существенный риск ограничений на международные поездки или торговлю [110]. С тех пор как ММСП (2005 г.) вступили в силу 15 июня 2007 г., ВОЗ объявляла ЧСМЗ шесть раз. Это было связано с пандемией гриппа H1N1 в 2009 году, эрадикацией полиомиелита в Южной Азии и Африке в 2014 году, вспышкой вируса Эбола в Западной Африке в 2014 году, вспышкой вируса Зика в Бразилии и других странах в 2016 году, вспышкой вируса Эбола в Демократической Республике Конго в 2018 году и эпидемией SARS-CoV-2 в настоящее время в Китае. Цель объявления ЧСМЗ состоит в том, чтобы предотвратить международное распространение болезни или сократить его темпы, а также избежать ненужных вмешательств в международные сделки и торговлю и ограничения прав человека.
Искусство войны («Суньцзы бинфа») — популярный древнекитайский военный трактат, написанный Сунь Цзы, в котором описывается ряд победоносных военных стратегий. В нём говорится: «Познай себя и своего врага, и ты никогда не будешь побежден». Этот принцип также важен и в нынешней войне с невидимым врагом SARS-CoV-2. В данной работе авторы приводят ключевые признаки COVID-19 в его эпидемиологии, вирусологии, клинических особенностях и ведении и обсуждают потенциальные цели лечения этого нового респираторного заболевания человека.
Эпидемиология
31 декабря 2019 года Уханьский муниципальный комитет здравоохранения впервые сообщил о кластере из 27 случаев заболевания неизвестной этиологии, по клиническим проявлениям напоминающим пневмонию, в том числе о семи тяжелых случаях, все из которых были связаны с оптовым рынком морепродуктов Хуанань в городе Ухань (рис. 1) [2]. Позже из биоматериалов этих пациентов был выделен новый штамм коронавируса, отличающийся от SARS-CoV и MERS-CoV, хотя и с некоторым сходством геномной последовательности [2]. ВОЗ временно присвоила этому вирусу название «2019-nCoV», а затем он был официально назван «SARS-CoV-2» Международным комитетом по таксономии вирусов (International Committee on Taxonomy of Viruses, ICTV) [3].
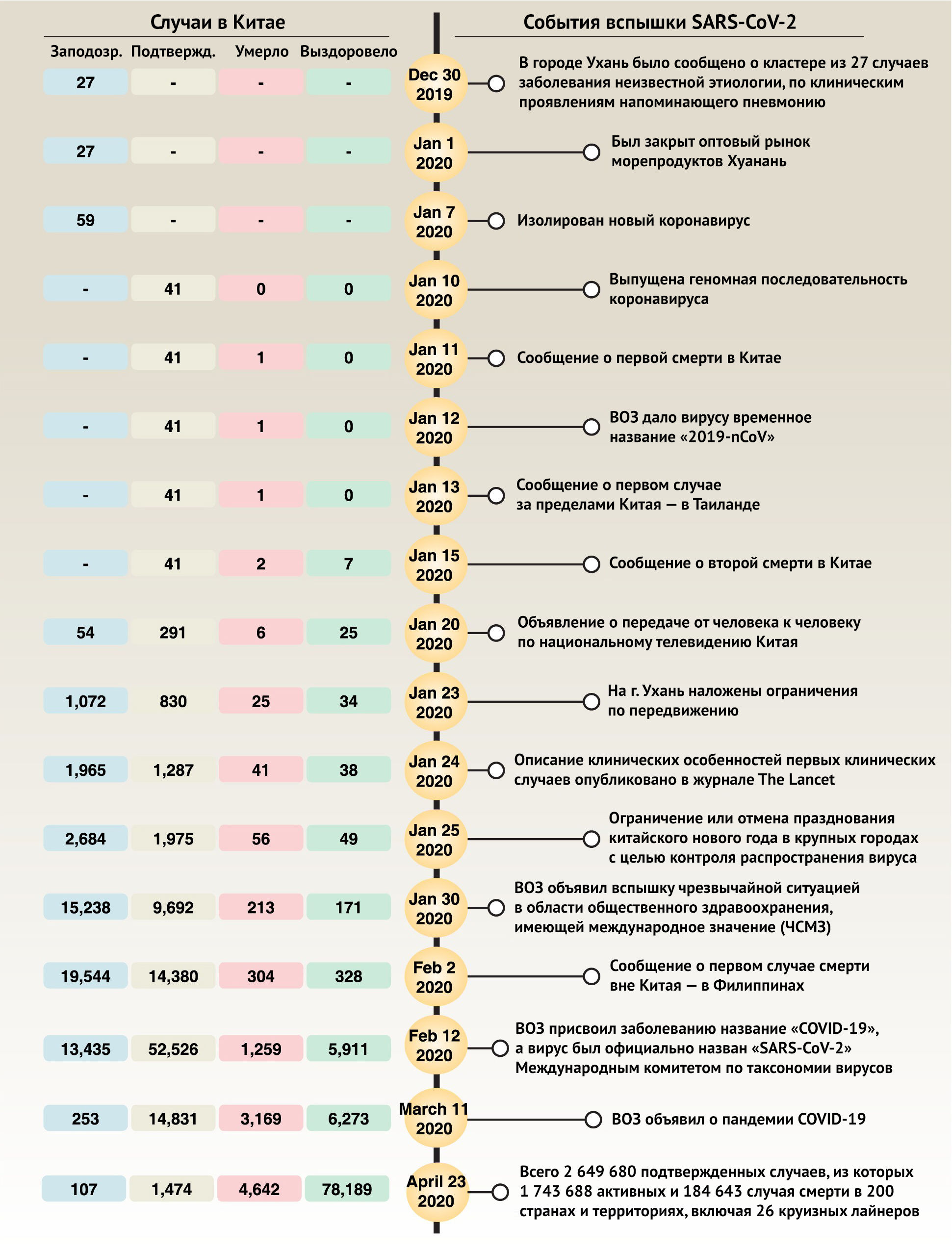
Рисунок 1 | Основные события вспышки коронавирусной инфекции
Хотя важные эпидемиологические риски включают в себя историю поездок из города Ухань или тесный контакт с заболевшим COVID-19 в течение 14 дней до появления симптомов, недавние исследования утверждают, что оптовый рынок морепродуктов Хуанань в городе Ухань может быть не единственным источником инфекции SARS-CoV-2, хотя 33 из 585 образцов, взятых с рынка, указывали на присутствие там SARS-CoV-2. На самом деле некоторые ранние случаи заболевания (8,6–51 %) не имеют эпидемиологической связи с этим рынком [4–8]. Основные пути передачи SARS-CoV-2 от человека к человеку — воздушно-капельный и контактный. Другие возможные пути включают аэрозольную или орально-фекальную передачу инфекции [9,10]. Некоторые группы населения, особенно пожилые мужчины и лица с сопутствующими заболеваниями, более восприимчивы к инфицированию SARS-CoV-2 [6,11–13]. Сообщается также о случаях заражения SARS-CoV-2 детей, младенцев и беременных женщин [14–16]. Новые данные из Европы и Соединенных Штатов показывают, что молодые люди (в возрасте от 20 до 54 лет) также уязвимы к SARS-CoV-2 [17], что обуславливает необходимость повсеместного соблюдения мер социального дистанцирования. Исходя из первых 425 подтвержденных случаев, средний инкубационный период вируса составляет 5,2 дня, при 95-м процентильном распределении — 12,5 дня, а его базовое репродуктивное число — 2,2, что ниже данного показателя для SARS-CoV (3,0) [6]. Совсем недавно в двух исследованиях было показано, что средний инкубационный период вируса составляет три дня (диапазон 0–24 дня) или 4,75 дня (диапазон 3–7,2 дня) соответственно [11,18]. Это исследование раскрыло сложную эпидемиологию этой вспышки, показав, что только 1,18 % пациентов имели непосредственный контакт с представителями дикой природы, в то время как 31,3 % были в городе Ухань, а 71,8 % контактировали с людьми оттуда [18]. Примечательно, что 4,5 % пациентов с COVID-19 не имеют симптомов пневмонии [11], что подчеркивает огромное значение раннего выявления факта инфицирования SARS-CoV-2 лабораторными методами. Базовое репродуктивное число (R0) — среднее число вторичных случаев, порожденных первичным случаем — для SARS-CoV-2 составляет 1,4–6,47 [6,19]. Однако R0 для SARS-CoV и MERS-CoV составляет 0,3–1,3 и 2,2–3,7 соответственно, что указывает на то, что SARS-CoV-2 может иметь более высокий потенциал к распространению, чем SARS-CoV и MERS-CoV [20]. По состоянию на 23 апреля 2020 года было подтверждено в общей сложности 2 649 680 случаев заболевания, в том числе 1 743 688 активных случаев и 184 643 смертельных случая в 200 странах и территориях, включая 26 круизных судов, что привело глобальные учреждения общественного здравоохранения в состояние повышенной готовности. Изоляция инфицированных лиц и их помещение на карантин являются основной стратегией прекращения или ограничения распространения болезни.
Вирусология
Коронавирусы — это оболочечные одноцепочечные РНК-вирусы положительной направленности. Они подразделяются на четыре подгруппы: α-, β-, γ- и δ-коронавирусы. Некоторые коронавирусы являются зоонозными; обычно они поражают дыхательные пути и/или пищеварительный тракт млекопитающих, включая человека [21]. С тех пор, как первый коронавирус человека (HCoV) был обнаружен в 1960-х годах в ноздрях пациента с ОРВИ, было открыто семь видов коронавирусов, включая HCoV-229E, HCoV-OC43, HCoV-NL63, HCoV-HKU1, SARS-CoV, MERS-CoV и SARS-CoV-2, которые в зависимости от штамма и состояния организма-хозяина вызывают заболевания дыхательных путей различной степени тяжести — от легких до летальных (рис. 2) [21]. В таблице 1 обобщены основные различия между SARS-CoV-2, SARS-CoV и MERS-CoV, а также вызываемыми ими заболеваниями. Размер генома SARS-CoV-2 составляет 29,9 кб, в то время как геномы SARS-CoV и MERS-CoV занимают 27,9 кб и 30,1 кб соответственно. В историческом аспекте SARS-CoV и MERS-CoV вызвали 8096 и 2494 случая заболевания, а летальность составила 9,2 и 34 % соответственно [2]. В настоящее время уровень летальности от SARS-CoV-2 в Китае, Италии, США и мире составляет 4,01, 12,63, 2,98 и 5,68 % соответственно. Как и у других представителей коронавирусов, у SARS-CoV-2, выделенного из клинических образцов, на поверхности имеются короноподобные шипы, видимые посредством электронной микроскопии; их диаметры варьируют от 60 до 140 нм [22]. Вызываемые SARS-CoV-2 цитопатические эффекты, по всей видимости, отличаются от вызываемых SARS-CoV и MERS-CoV. После инвазии SARS-CoV-2 структурные изменения в клетках хозяина наблюдаются в эпителиальных клетках дыхательных путей человека раньше (уже через 96 часов), чем в других клеточных линиях, включая Vero E6 (через 144 часа) и Huh-7 (через 144 часа) [22].
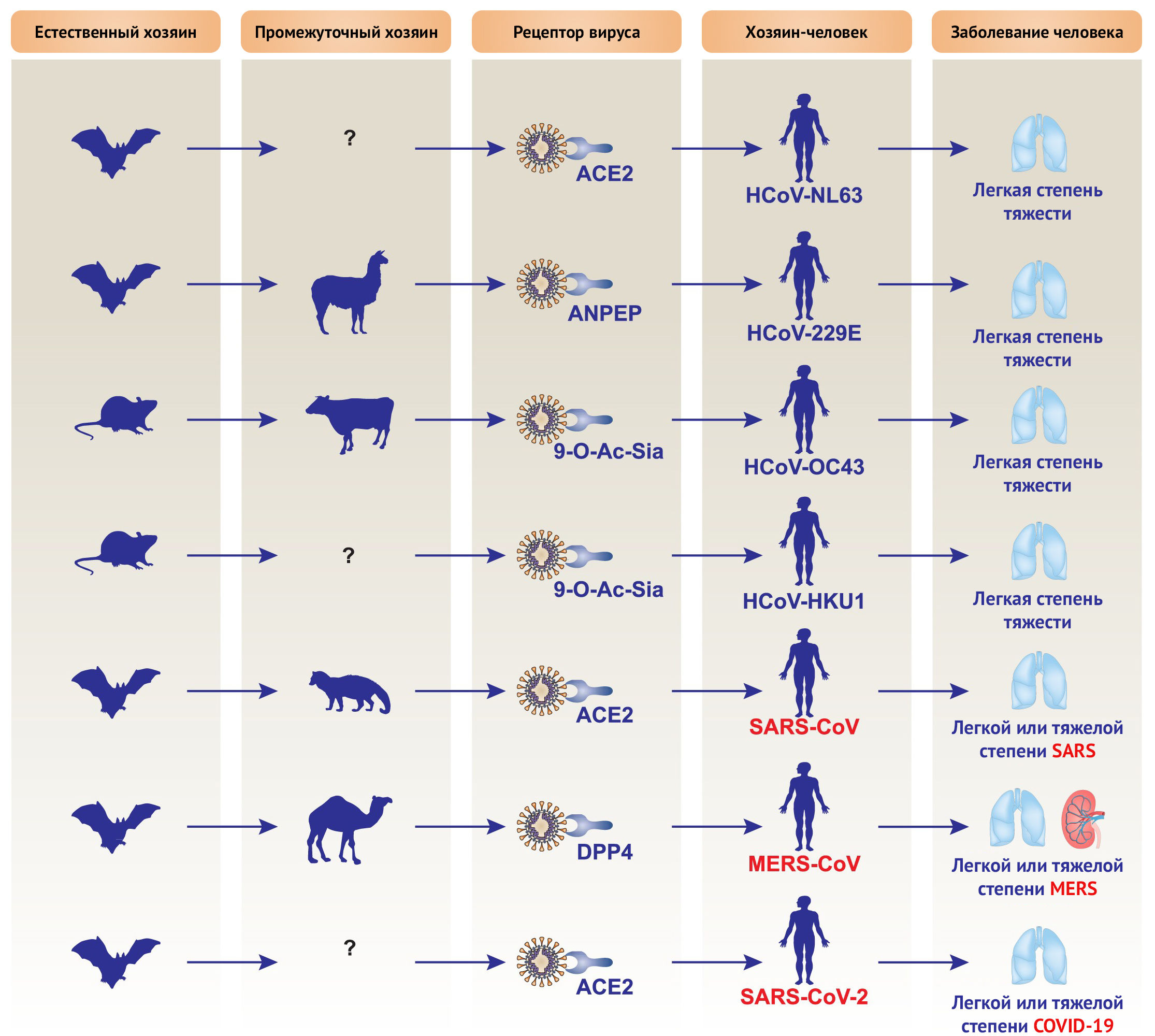

Рисунок 3 | Схематическое представление таксономии семейства Coronaviridae
Геном SARS-CoV-2 имеет от 10 до 12 возможных открытых рамок считывания (open reading frames, ORF) [25,33]. ORF1ab кодирует неструктурные белки, которые представляют собой многофункциональные молекулы, участвующие в обработке и репликации вируса, в то время как остальные ORF кодируют вирусные структурные белки (например, шип [S], оболочку [E], мембрану [M] и нуклеокапсид [N]) и другие вспомогательные белки (например, 3a, 3b, 6, 7a, 7b, 8, 9b, 9c и 10). Примечательно, что ORF1ab составляет примерно 67 % всего генома и кодирует 15 или 16 неструктурных белков, в зависимости от биоинформатического анализа различных групп [25,33]. Один из спорных вопросов заключается в том, существует ли крошечный белок nsp11 (4,8 кДа) отдельно и, если это так, играет ли он какую-либо роль в вирусных инфекциях [25,33].
Структурные белки помогают в сборке и высвобождении новых копий вируса. M- и E-белки участвуют в формировании вирусных оболочек, в то время как N-белок образует спиральный рибонуклеокапсидный комплекс с вирусной геномной РНК положительной направленности и взаимодействует с белком вирусной мембраны при сборке вирионов [34]. Белок S важен для прикрепления и проникновения SARS-CoV-2 в клетки организма-хозяина с образованием синцития между инфицированными клетками. Во время вирусной инфекции тримерный S-белок расщепляется на субъединицы S1 и S2. Субъединица S1, содержащая рецептор-связывающий домен (РСД), высвобождается при переходе к постфузионной конформации, тогда как прикрепленная к мембране субъединица S2 содержит механизм слияния. Ангиотензин I-превращающий фермент 2 (АПФ2), экспрессируемый, в частности, в клетках альвеолярного эпителия второго типа, является предполагаемым рецептором входа SARS-CoV-2 в клетки организма человека (рис. 4) [24,27,35]. В общем случае SARS-CoV-2 сначала связывается с АПФ2 на поверхности клетки организма-хозяина через субъединицу S1, а затем объединяет мембраны вируса и клеток хозяина через субъединицу S2. SARS-CoV также распознает АПФ2 в качестве своего рецептора, тогда как MERS-CoV распознает дипептидилпептидазу 4 (DPP4; также известную как CD26) [21]. SARS-CoV-2 филогенетически более связан с SARS-CoV, чем MERS-CoV [27]. Стоит отметить, что эти рецепторы не только служат точками соединения вирусов, но также могут быть важны для проникновения вируса, направленного внутриклеточного взаимодействия и сбрасывания оболочки.
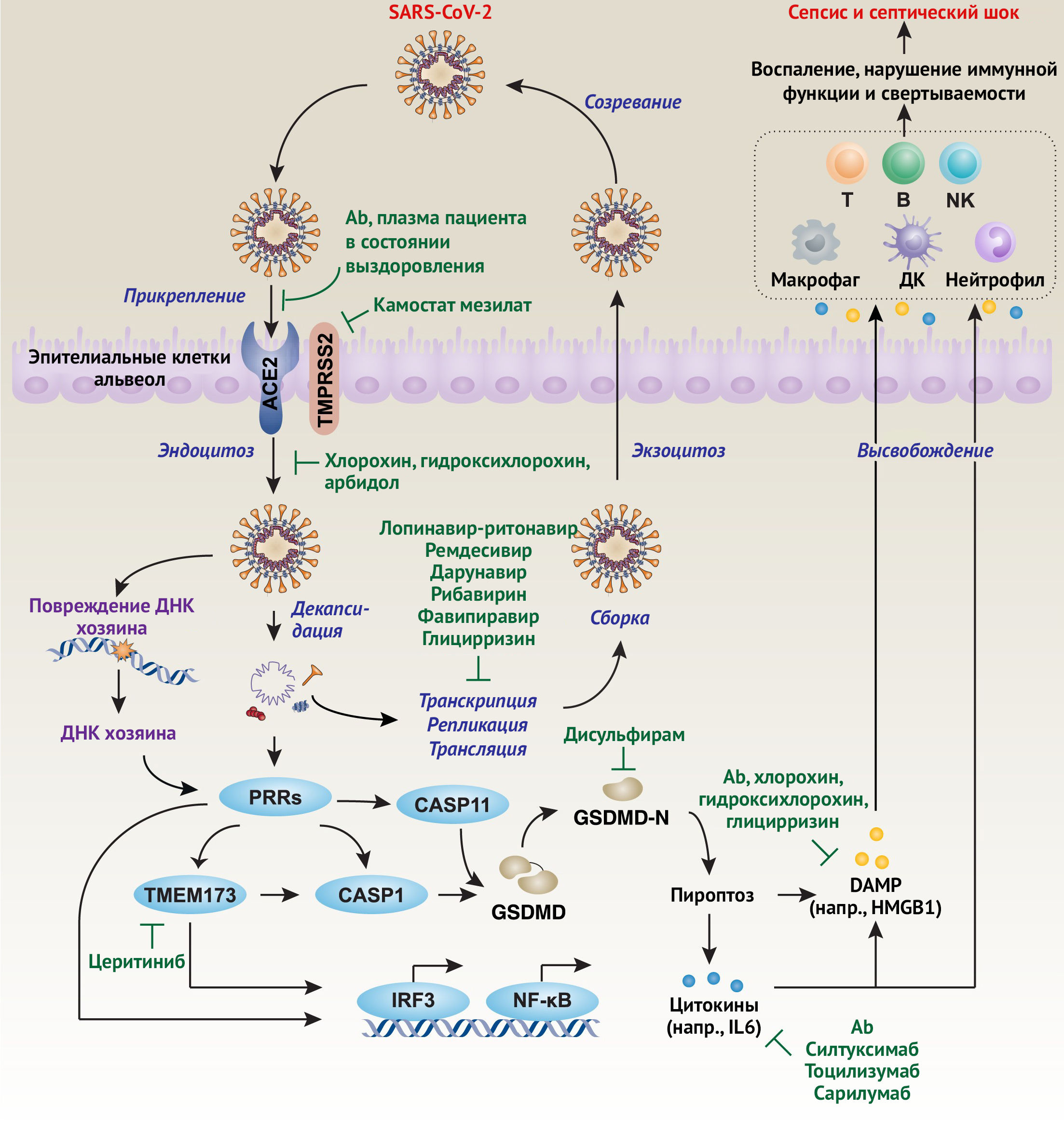
Хотя N- и S-белки SARS-CoV-2 менее консервативны, чем у других коронавирусов группы 2B (SARS-CoV и MERS-CoV), РСД в субъединице S1 SARS-CoV-2, по-видимому, является важным функциональным доменом, ответственным за связывание с пептидазным доменом (ПД) рецепторного белка АПФ2 человека [24,25]. Это связано с тем, что несколько ключевых остатков РСД, ответственных за связывание SARS-CoV с рецептором АПФ2 (например, Ala426, Thr487, Asn479 и Leu472), в SARS-CoV-2 отличаются (например, Asn439, Asn501, Gln493, Gly485 и Phe486) [24]. Однако специфические ингибиторы или антитела, нацеленные на эти сайты SARS-CoV-2, все еще не идентифицированы.
Большинство структурных исследований с помощью криогенной электронной микроскопии (крио-ЭМ) показывают, что SARS-CoV-2 связывает АПФ2 с более высоким сродством, чем SARS-CoV [36–38]. Однако исследование интерферометрии биослоя показывает, что SARS-CoV-2 и SARS-CoV имеют сходное сродство к АПФ2 [39], что указывает на то, что другие молекулы могут быть вовлечены в модулирование АПФ2-опосредованной инвазии SARS-CoV-2. Тримерная структура S-белка SARS-CoV-2 включает один РСД в конформации «вверх» и два РСД в конформации «вниз» [36]. Конформация «вверх» РСД S-белка связывается с ПД АПФ2 на расстоянии около 15 нм [36]. Структурный анализ крио-ЭМ позволяет также предположить, что два тримера S-белка могут одновременно связываться с димером АПФ2, главным образом через полярные остатки [40]. Подобно SARS-CoV и MERS-CoV, тример S-белка SARS-CoV-2 встречается во многих различных конформационных состояниях [39], что также указывает на то, что различные структуры могут независимо иметь различные возможности вирусной инвазии. Чтобы SARS-CoV-2 вошел в клетку хозяина, его S-белок должен быть расщеплен клеточными протеазами в двух местах, этот процесс называется S-белковым праймингом. Таким образом вирусные и клеточные мембраны могут соединиться. SARS-CoV-2 может дополнительно использовать трансмембранную сериновую протеазу 2 (TMPRSS2), чтобы проникнуть в клетки легких человека посредством прайминга S-белка, в то время как ингибитор TMPRSS2 камостата мезилат блокирует проникновение вируса SARS-CoV-2 в клетку [41]. Помимо опосредования прайминга S-белка, TMPRSS2 может также участвовать в репликации SARS-CoV-2 посредством неизвестных механизмов [42]. Кроме того, наличие двух типичных участков расщепления фурина в S-белке SARS-CoV-2 может играть аналогичную роль в стимулировании вирусной инвазии и репликации [39]. Поскольку фурин в изобилии содержится в дыхательных путях, S-белок может расщепляться после выхода из эпителиальных клеток легких, тем самым эффективно заражая другие клетки. Таким образом, функциональное взаимодействие между TMPRSS2 и фурином является ключевым фактором в определении уровня прайминга S-белка. Другие белки хозяина, такие как член 5 семейства А белков теплового шока (hsp70) (HSPA5, также известный как GRP78) [43] и CD147 (индуктор синтеза матриксных металлопротеиназ) [44], могут играть альтернативную или синергическую роль в опосредовании инвазии SARS-CoV-2, хотя их структурная основа до сих пор неизвестна. Также остается выяснить, имеет ли экспрессия АПФ2 в тканях других органов, таких как желудочно-кишечный тракт, почки и сердце, те же функции, что и в легких.
Как и в случае SARS-CoV и MERS-CoV, жизненный цикл SARS-CoV-2 представляет собой динамический процесс [34] (рис. 4). После слияния мембран вирусная геномная РНК высвобождается в цитоплазму, а непокрытая оболочкой РНК транслирует два полипротеина, pp1a и pp1ab, которые кодируют неструктурные белки и образуют репликационно-транскрипционный комплекс (РТК) в двумембранной везикуле [34]. РТК непрерывно реплицирует и синтезирует набор субгеномных РНК, кодирующих вспомогательные и структурные белки [34]. После того, как компоненты РНК и белка собраны, новые вирусы продуцируются и затем высвобождаются во внеклеточное пространство клетки-хозяина посредством экзоцитоза [34]. Эта информация может быть использована для разработки противовирусных препаратов, направленных на подавление вирусных инфекций путем нарушения жизненного цикла SARS-CoV-2.
Клинические особенности
В самом раннем исследовании из больницы Цзинь-инь-тан в городе Ухань были описаны клинические характеристики первых 41 пациента с лабораторно подтвержденным COVID-19, из которых 30 составляли мужчины и 11 — женщины (средний возраст 49 лет) [5] (таблица 1). В общей сложности 66 % пациентов имели связь с оптовым рынком морепродуктов Хуанань, также наблюдался один семейный кластер инфекции SARS-CoV-2. В этой когорте 13 человек (31,7 %) были госпитализированы в отделение интенсивной терапии (ОИТ), а 6 умерли (14,6 %). Некоторые пациенты имели другие проблемы со здоровьем, такие как сахарный диабет (20 %), артериальная гипертензия (15 %), сердечно-сосудистые заболевания (15 %), хроническая обструктивная болезнь легких (2 %), хроническая болезнь печени (2 %) и онкологические заболевания (2 %). Клинические симптомы и признаки были похожи на проявления многих других острых респираторных инфекций, включая SARS и MERS. При COVID-19 у пациентов обычно наблюдается лихорадка (98 %), кашель (76 %), одышка (55 %; медиана времени от начала заболевания до дебюта одышки составляет 8,0 дней) и миалгия или усталость (44 %). Возможны и другие признаки, такие как выделение мокроты (28 %), головная боль (8 %), кровохарканье (5 %) и диарея (3 %). Медиана времени от появления симптомов до первой госпитализации, одышки, острого респираторного дистресс-синдрома (ОРДС), начала искусственной вентиляции легких и поступления в ОИТ составила 7, 8, 9, 10,5 и 10,5 дней соответственно.
Некоторые пациенты с COVID-19 имели отклонения показателей анализа крови при поступлении, такие как снижение или нормальное количество лейкоцитов, снижение количества лимфоцитов, увеличение протромбинового времени, повышение уровня D-димера или повышение уровня аспартатаминотрансферазы, креатинина, креатинкиназы и лактатдегидрогеназы, что указывает на нарушения свертывания крови и дисфункцию органов. С другой стороны, при поступлении у пациентов с COVID-19 уровень сывороточного прокальцитонина, являющегося маркером бактериальных инфекций, был в пределах нормы.
Кроме того, с развитием инфекции SARS-CoV-2 связаны цитокиновые штормы. Во-первых, уровень цитокинов (например, IL1B, IL1RA, IL7, IL8, IL9, IL10, FGF, GCSF, GMCSF, IFNG, IP10, MCP1, MIP1A, MIP1B, ТФР, ФНО и ФРСЭ) в плазме был значительно повышен у пациентов с COVID-19 по сравнению со здоровой контрольной группой. Во-вторых, уровень некоторых провоспалительных цитокинов (IL2, IL7, IL10, GCSF, IP10, MCP1, MIP1A и ФНО) был дополнительно повышен у пациентов в ОИТ по сравнению с пациентами вне ОИТ, что указывает на то, что чрезмерные острые воспалительные реакции могут привести к септическому шоку и смерти пациентов с COVID-19. У 98 % пациентов с COVID-19 наблюдалась еще одна распространенная аномалия на компьютерных томограммах (КТ) грудной клетки, а именно двусторонняя множественная дольковая и субсегментарная зоны консолидации.
Во вторичном исследовании, также проведенном в больнице Цзинь-инь-тан в городе Ухань, были описаны эпидемиологические и клинические характеристики 99 пациентов с лабораторно подтвержденным COVID-19, в их числе были 67 мужчин и 32 женщины (средний возраст пациентов составил 55,5 лет) [7]. Это исследование также позволяет предположить, что подозрительный рынок морепродуктов Хуанань не может быть единственным источником вируса, поскольку только 49 % пациентов имели в анамнезе связь с ним; у 51 % пациентов были хронические заболевания с нарушением функции иммунной системы, особенно сердечно-сосудистые и цереброваскулярные заболевания (40 %), болезни эндокринной (13 %) и пищеварительной систем (11 %). При поступлении у большинства пациентов наблюдалась лихорадка (83 %) или кашель (82 %), а у трети — одышка (31 %). К другим симптомам относились мышечные боли (11 %), головные боли (8 %), боль в горле (5 %), ринорея (4 %), боль в груди (2 %) и диарея (2 %). В первых двух случаях смерти от заболевания выявлялись полиорганная недостаточность и септический шок, развившиеся в течение короткого промежутка времени. Повреждение Т-лимфоцитов может быть важным фактором, который приводит к ухудшению состояния пациента. Низкое абсолютное значение лимфоцитов может быть использовано в качестве эталонного показателя для диагностики. В дополнение к мазкам из носоглотки и ротоглотки SARS-CoV-2 иногда можно обнаружить в образцах стула, как это было показано в первом описанном в США случае [45]; это натолкнуло исследователей на мысль о том, что инфекция может передаваться фекально-оральным путем.
В недавних исследованиях, проведенных среди лабораторно подтвержденных случаев, у пациентов с COVID-19 при поступлении наблюдаются сходные клинические, лабораторные и рентгенологические особенности болезни [8,11,18]. В целом, лихорадка, кашель и усталость являются наиболее распространенными симптомами, хотя некоторые пациенты не демонстрируют никаких внешних признаков болезни. Двусторонние пятнистые тени или помутнение по типу матового стекла в легких — типичные результаты при проведении КТ грудной клетки. Лимфопения, тромбоцитопения, повышенный уровень С-реактивного белка, активация лактатдегидрогеназы, повышенный уровень D-димера и увеличение протромбинового времени являются наиболее распространенными лабораторными отклонениями, которые аналогичны ранее наблюдавшимся у пациентов с инфекциями MERS-CoV или SARS-CoV (таблица 1). Тяжесть заболевания является независимым предиктором неблагоприятного исхода. Первое вскрытие жертвы COVID-19 в Китае показало, что тяжесть легочного фиброза и сопутствующих заболеваний была не столь высокой, как при SARS, а реакция экссудации была более выраженной, чем при SARS [46]. Альвеолы пациента были заполнены жидкостью, лейкоцитами, слизью и обломками поврежденных клеток легких [46]. Нет сомнений в том, что легкие — это орган, который повреждается в наибольшей степени при инфицировании SARS-CoV-2; однако этот вирус может нанести вред многим другим органам, включая сердце, печень, почки, мозг и кишечник. Эти результаты клинических и лабораторных методов обследования предоставляют важную информацию о диагностике инфекции SARS-CoV-2, которая связана с иммунной дисфункцией, изменением коагуляции и повреждением тканей.
Клиническое ведение
Инфицирование SARS-CoV-2 может вызвать заболевание легкой или тяжелой степени, в то время как тяжелая инфекция может привести к ОРДС, сепсису, септическому шоку и даже смерти. Руководящие принципы клинического ведения COVID-19 были изданы ВОЗ и каждой страной; их содержание может со временем обновляться и совершенствоваться. Рекомендации ВОЗ по ведению пациентов с COVID-19 предполагают следующие меры: 1) скрининг и сортировка пациентов: раннее выявление пациентов с тяжелой острой респираторной инфекцией, ассоциированной с инфицированием COVID-19; 2) немедленное внедрение надлежащих мер по профилактике инфекций и инфекционному контролю (ПИИК); 3) забор материала для лабораторной диагностики; 4) ведение пациентов с COVID-19 при легком течении: симптоматическое лечение и мониторинг; 5) ведение пациентов с COVID-19 при тяжелом течении: оксигенотерапия и мониторинг; 6) ведение пациентов с COVID-19 при тяжелом течении: лечение сопутствующих инфекций; 7) ведение пациентов с COVID-19 в критическом состоянии: ОРДС; 8) ведение пациентов с COVID-19 в критическом состоянии: профилактика осложнений; 9) ведение пациентов с COVID-19 в критическом состоянии: септический шок; 10) дополнительное лечение пациентов с COVID-19: кортикостероиды; 11) оказание медицинской помощи беременным женщинам с COVID-19; 12) оказание медицинской помощи детям и их матерям с COVID-19: ПИИК и кормление грудью; 13) оказание медицинской помощи пожилым людям с COVID-19; 14) клинические исследования и специфическое лечение пациентов с COVID-19 [47]. Эти рекомендации содержат общие принципы эффективной профилактики, управления вспышками и лечения заболеваний, связанных с инфицированием SARS-CoV-2, являясь отражением значительного прогресса в эпидемиологической науке, методах диагностики, поддерживающем уходе и разработке лекарств. Примечательно, что внутрибольничная передача инфекции является важной причиной инфицирования COVID-19 и смерти медицинских работников, что требует самого пристального внимания [8].
Поскольку SARS-CoV-2 является новым вирусом, в настоящее время не существует препаратов, направленных на этиотропное лечение вызванных им заболеваний. Основным методом лечения по-прежнему является поддерживающая терапия, включающая повышенную доставку кислорода с помощью аппарата искусственной вентиляции легких, инфузионную терапию и лечение антибиотиками. Кроме того, некоторые противовирусные препараты, моноклональные антитела человека и другие лекарственные средства могут использоваться только в контексте этически одобренных клинических испытаний. Например, комбинированный препарат лопинавир-ритонавир, обладающий эффектом против ВИЧ, используется для лечения пациентов с COVID-19 в Китае [7]. Однако рандомизированное клиническое исследование показало, что преимущества лечения лопинавиром-ритонавиром не перевешивают преимущества стандартного лечения пациентов с тяжелой формой COVID-19 [48]. Ремдесивир (GS-5734), 1'-цианозамещенный аналог аденозин-нуклеотидного пролекарства, разработанный компанией Gilead Sciences Inc. (Фостер Сити, штат Калифорния), показал эффективность в лечении некоторых пациентов с COVID-19 [45], но результаты продолжающихся рандомизированных плацебо-контролируемых исследований пока остаются неизвестными. Традиционная китайская медицина имеет очень долгую историю лечения инфекционных заболеваний, хотя ее методы воздействия могут иметь неясный терапевтический механизм. Возможно также, что традиционная китайская медицина в сочетании с западными лекарствами может улучшить состояние пациентов, что отмечено в руководстве по клиническому ведению COVID-19 в Китае [49]. Следует отметить, что некоторые противовирусные (например, осельтамивир), антибактериальные (например, моксифлоксацин, цефтриаксон и азитромицин) и глюкокортикоидные препараты не дают существенного преимущества при лечении пациентов с COVID-19 [8]. Таким образом, по-прежнему остро необходимы дополнительные и улучшенные методы лечения, включая вакцины и новую таргетную терапию; в настоящее время проводятся несколько клинических испытаний. 16 марта 2020 года в США начались первые клинические испытания одного из вариантов вакцины от COVID-19, который представляет собой мРНК-вакцину против SARS-CoV-2 (мРНК-1273), кодирующую префузионную стабилизированную форму S-белка, разработанную компанией Moderna и исследовательским центром вакцин при Национальном институте аллергии и инфекционных заболеваний США. К другим препаратам и вакцинам от COVID-19, разрабатываемым фармацевтическими компаниями по всему миру, относятся TJM2 (нейтрализующие антитела к гранулоцитарно-моноцитарному колониестимулирующему фактору человека [GM-CSF]) от компании I-Mab biopharma (Шанхай, Китай), AT-100 (рекомбинантная форма сурфактантного белка D человека) от компании Airway Therapeutics (Цинциннати, штат Огайо), TZLS-501 (нейтрализующее антитело к IL6 человека) от компании Tiziana Life Sciences (Лондон, Великобритания), BPI-002 (маломолекулярный агент для активации хелперных T-клеток CD4+ и цитотоксических Т-клеток CD8+) от компании BeyondSpring (Нью-Йорк, штат Нью-Йорк), INO-4800 (вакцина) от компаний Inovio Pharmaceuticals (Сан-Диего, штат Калифорния) и Beijing Advaccine Biotechnology (Пекин, Китай), TNX-1800 (вакцина) от компании Tonix Pharmaceuticals (Нью-Йорк, штат Нью-Йорк) и рекомбинантная субъединичная вакцина от компании Clover Biopharmaceuticals (Чэнду, Китай).
Потенциальные терапевтические мишени
Хотя патогенез инфекции SARS-CoV-2 остается неясным, тяжелая форма COVID-19 подразумевает развитие полиорганной дисфункции и угрожающего жизни синдрома, вызванного реакцией организма-хозяина на вирус, что приводит к неконтролируемому иммунному ответу и последующему сепсису или септическому шоку посредством немедленного и взрывного высвобождения различных иммунных медиаторов, особенно цитокинов и молекулярных паттернов, ассоциированных с повреждениями (damage-associated molecular patterns, DAMP) [50] (рис. 4). Направленные стратегии лечения COVID-19 могут включать в себя разработку антител или ингибиторов для блокирования взаимодействия между S-белком SARS-CoV-2 и рецептором АПФ2 хозяина, создание олигонуклеотидов против РНК-генома SARS-CoV-2 и введение пассивных антител из сыворотки пациентов с COVID-19. В противовес этому, перенаправление уже существующих препаратов на лечение пациентов с COVID-19 (т.е. изменение их целевых назначений) может быть более быстрым, более эффективным и безопасным способом решения проблемы. В дополнение к противовирусным препаратам (например, ремдесивиру, пенцикловиру, галидесивиру и рибавирину), которые используются при MERS или SARS [51], ниже авторы обсуждают некоторые потенциальные иммунопатологические мишени, а также связанные с ними доступные препараты для лечения этого нового вирусного заболевания.
Гибель клеток-хозяев
Большинство вирусных инфекций в конечном итоге приводят к гибели клеток-хозяев. Различные типы регулируемой клеточной смерти (РКС) имеют определенные молекулярные механизмы и сигнальные регуляторы [52]. Среди них пироптоз — широко изученная форма провоспалительной гибели иммунных и эпителиальных клеток, которая имеет место при различных инфекционных заболеваниях, в том числе вирусных инфекциях [53,54]. Чрезмерная активация пироптоза в основном за счет воспалительных каспазы 1 (CASP1) и каспазы 11 (CASP11) (CASP4 и CASP5 у человека) может вызвать расщепление гасдермина Д (GSDMD), который продуцирует N-концевой домен (GSDMD-N), чтобы вызвать гибель клеток и высвобождение провоспалительных цитокинов (например, IL1 и IL18) и DAMP (например, группа высокой мобильности [HMGB1] и фактор свертывания крови III [F3; также известный как тканевый фактор]) [53–60].
Этот процесс дополнительно модулируется многими факторами, такими как приток Ca2+, выход К+ и перекисное окисление липидов. GSDMD-N-опосредованный пироптоз связывает каноническую и неканоническую активацию инфламмасом с различными иммунными реакциями и служит новой мишенью для лечения инфекционных заболеваний [61]. Действительно, мыши с дефицитом или мутацией GSDMD устойчивы к перевязке слепой кишки и вызванным пункцией септическому шоку и смерти от воздействия эндотоксина [53,54,57,58,60,62,63]. Вполне вероятно, что ингибитор GSDMD может ограничить вирус-опосредованную гибель клеток хозяина. В частности, дисульфирам — препарат, используемый для лечения алкогольной зависимости — эффективно ингибирует функцию GSDMD in vitro [64]. Поскольку была доказана эффективность дисульфирама в ингибировании SARS-CoV, MERS-CoV и ВИЧ-инфекции [65–67], он также может замедлять и инфекцию, вызванную SARS-CoV-2.
РКС
Гибель клеток — это важный физиологический или патологический феномен, который тесно связан с понятиями человеческого здоровья и болезни. Существует много типов гибели клеток, причем их классификация основана на различных критериях. Самый старый классификационный критерий был описан Швайхелем и Меркером и опубликован в 1973 году [111]. По нему клеточная смерть делится на тип I (апоптоз), тип II (клеточная смерть, связанная с аутофагией) и тип III (некроз). В настоящее время классификация клеточной смерти основывается не на морфологических критериях, а на молекулярно-генетических определениях Номенклатурного комитета по клеточной смерти (Nomenclature Committee on Cell Death, NCCD) [112]. В общем случае клеточная смерть делится на случайную клеточную смерть (СКС) и РКС. СКС — это пассивный и неконтролируемый процесс, в то время как РКС — активный и контролируемый. К основным типам РКС относятся апоптоз, некроптоз, пироптоз, ферроптоз, энтотическая гибель клеток, нетотическая гибель клеток, партанатоз, лизосомозависимая гибель, аутофагозависимая гибель, алкалиптоз и оксеиптоз, которые имеют четко выраженные молекулярные механизмы и трансдукцию сигналинга. Апоптоз обычно инициируется активацией каспаз и далее разделяется на внешний и внутренний пути, которые в основном опосредуются CASP8 и CASP9 соответственно [113]. Некроптоз представляет собой некроз, зависимый от псевдокаспазы MLKL в условиях ингибирования каспазы [114,115]. Пироптоз в основном обусловлен GSDMD-N после активации CASP1 и CASP11 в ответ на внеклеточные или внутриклеточные сигналы опасности, включая молекулярные структуры, ассоциированные с патогеном (pathogen-associated molecular pattern molecules, PAMP) и DAMP [55–59]. Ферроптоз — это форма железозависимого регулируемого некроза, требующая активации перекисного окисления липидов [116,117]. Партанатоз — это форма регулируемого некроза, зависимая от поли(АДФ-рибоза) полимеразы 1 (PARP1) [118], в то время как энтотическая клеточная смерть — это тип клеточной смерти, основанный на активации энтоза [119]. Нетотическая [120], лизосомозависимая [121] и аутофагозависимая гибель клеток [122] запускаются активацией нейтрофильных внеклеточных ловушек, гидролитических ферментов (например, катепсинов) или механизмов аутофагии (например, связанных с аутофагией белков) соответственно. Алкалиптоз опосредован внутриклеточным подщелачиванием в раковых клетках, тогда как оксеиптоз — это вызванная кислородными радикалами противовоспалительная форма гибели иммунных клеток.
DAMP
DAMP — это эндогенные молекулы, которые могут высвобождаться или секретироваться стимуляторами смерти или цитокинами [68]. Большинство DAMP — это ядерные или цитозольные белки, такие как HMGB1, гистоны, семейство белков теплового шока, семейство S100 и митохондриальный транскрипционный фактор А (TFAM). HMGB1, второй по распространенности ядерный белок, также является типичным DAMP. Ядерный HMGB1 является архитектурным хроматин-связывающим фактором, ответственным за поддержание целостности генома, тогда как внеклеточный HMGB1 является медиатором воспаления и иммунной дисфункции в ответ на различные стрессы, включая голодание, окислительное повреждение, гипоксию и инфицирование патогеном [69–72]. Таким образом, HMGB1 становится все более привлекательной мишенью воздействия при различных заболеваниях и патологиях человека, особенно при потенциально летальных состояниях и септическом шоке [73]. Учитывая, что HMGB1 является потенциальной мишенью воздействия при SARS [74], авторы предполагают, что HMGB1 может играть аналогичную патогенетическую роль при COVID-19, опосредуя воспаление и иммунную дисфункцию. Фармакологическое ингибирование высвобождения и активности HMGB1 лекарственными средствами (например, хлорохином и глицирризином) показало значительные защитные эффекты при потенциально летальной инфекции у мышей [75]. Глицирризин, прямой ингибитор HMGB1, ингибирует репликацию SARS-CoV [76]. Хлорохин — аминохинолин, используемый для профилактики и терапии малярии, эффективен в защите от сепсиса и септического шока, частично за счет ингибирования высвобождения HMGB1 и воспаления [77] (в настоящее время мнение врачебного сообщества в отношении использования данного препарата изменилось, т. к. выяснилось, что его применение не улучшает выживаемость и чревато развитием потенциально жизнеугрожающих сердечно-сосудистых осложнений — прим. ред.). Хлорохин и его аналоги (например, гидроксихлорохин) проявляют сильную противовирусную активность, предотвращая репликацию и распространение SARS-CoV, MERS-CoV и ВИЧ посредством многочисленных механизмов, таких как повышение рН эндосомы, препятствие слиянию эндосомы с лизосомой, блокирование терминального гликозилирования АПФ2 или ингибирование переработки S-белка [78–84]. Хлорохин и гидроксихлорохин также ингибируют продукцию SARS-CoV-2 в клетках культуры in vitro [85–87]. Важно отметить, что небольшие клинические исследования, проведенные в Китае и Франции, продемонстрировали, что хлорохин и гидроксихлорохин повышают клиническую эффективность и клиренс вируса при COVID-19 [88–90], и в настоящее время во всем мире проводятся дополнительные испытания. Антибиотик азитромицин дополнительно усиливает этот эффект гидроксихлорохина у некоторых пациентов с COVID-19; это говорит о том, что бактериальная инфекция может усугубить течение вирусного заболевания [90]. Для определения безопасности и эффективности хлорохина при лечении COVID-19 необходимы дополнительные рандомизированные контролируемые исследования, поскольку он может играть двойственную роль в противовирусном иммунитете [91].
Трансмембранный белок 173
Как PAMP, так и DAMP могут функционировать как «начальный сигнал» для инициации врожденного иммунного ответа [68]. Таким образом, авторы рассудили, что специализированные рецепторы распознавания структур (PRR) могут способствовать иммунной дисрегуляции, опосредованной SARS-CoV-2. В дополнение к хорошо известным PRR (таким как Toll-подобные рецепторы [TLR], рецепторы нуклеотид-связывающего домена олигомеризации [NOD]; рецепторы генов, индуцируемые ретиноевой кислотой [RIG]; AIM2-подобные рецепторы (absent in melanoma 2), C-тип лектиновых рецепторов [CLR] и специфические рецепторы конечных продуктов гликозилирования [AGER/RAGE] [92]) авторы предполагают, что трансмембранный белок 173 (TMEM173; также известный как STING), внутриклеточный иммунный регулятор для активации PRR во время инфекции и повреждения тканей [93,94], может быть вовлечен в SARS-CoV-2-опосредованный сепсис и септический шок. TMEM173 активируется многими стимулами, такими как повреждения ядерной или митохондриальной ДНК хозяина, ДНК или РНК вируса, циклическими динуклеотидами от грамотрицательных и грамположительных бактерий [93,94]. Как и другие механизмы врожденных иммунных реакций, активация пути TMEM173 может быть первой линией защиты от вторгающихся патогенов, включая вирусы [95–98]. Однако чрезмерная активация TMEM173 может продуцировать интерферон I типа (IFNα и IFNß) и различные цитокины (например, IL6 и TNF), которые вызывают цитокиновый шторм [99–105]. Чрезмерная активация TMEM173 также вызывает активацию инфламмасомы [106], пироптоз, опосредованный GSDMD-N, а также последующий летальный иммунокоагуляционный ответ при септическом шоке, смоделированном в экспериментальных условиях [60]. Примечательно, что летучие мыши устойчивы к различным вирусным инфекциям отчасти из-за потери TMEM173-опосредованной продукции интерферона I типа [107]. Напротив, избыток интерферона I типа приводит к повреждению легких, вызванному SARS-CoV, и иммунной дисфункции у мышей [108]. Эти данные делают TMEM173 потенциальной мишенью терапии при SARS, а также COVID-19. Учитывая, что препарат церитиниб, ингибитор киназы анапластической лимфомы (ALK), проявляет многообещающую роль в защите от экспериментальной септической смерти путем блокирования пути TMEM173 [109], было бы интересно выяснить, можно ли использовать этот препарат для подавления опосредованной SARS-CoV-2 органной дисфункции.
PAMP и DAMP
Наиболее важной функцией иммунной системы является ее способность распознавать экзогенные или эндогенные сигналы опасности, условно называемые нулевыми сигналами [68]. Экзогенные сигналы опасности под названием PAMP являются структурными компонентами микробов (например, бактерий, грибов, вирусов и паразитов): это ДНК, РНК, белок и мембранные компоненты (например, липополисахарид) [123]. Напротив, эндогенными сигналами опасности являются DAMP — компоненты клетки-хозяина [124,125]. DAMP можно разделить на белковые и небелковые подгруппы. Важными источниками DAMP являются ядерные (например, HMGB1 и гистон), цитозольные (например, белки теплового шока или семейства S100) или митохондриальные (например, TFAM, структурный и функциональный гомолог HMGB1) белки. Кроме того, к небелковым DAMP в основном относятся ДНК хозяина (например, геномная или митохондриальная ДНК), РНК хозяина (например, микроРНК [миРНК]), аденозинтрифосфат и мочевая кислота. DAMP не только пассивно высвобождаются из мертвых или умирающих клеток, но и активно секретируются различными иммунными клетками, главным образом через лизосомозависимые пути. Как PAMP, так и DAMP могут быть распознаны одними и теми же или различными PRR, такими как TLR, NOD-подобные рецепторы, RIG-I–подобные рецепторы, AIM2-подобные рецепторы, CLR и AGER/RAGE; это происходит на клеточных мембранах или в цитозоле и приводит к воспалению. Хотя соответствующая воспалительная реакция является способом защиты клеток-хозяев от инфекции и повреждения, чрезмерное или неконтролируемое воспаление способствует дальнейшему развитию инфекции, повреждению тканей и аутоимунной реакции, которая является ведущим звеном патогенеза многих заболеваний человека. Поэтому крайне важно контролировать иммунный ответ на PAMP или DAMP.
Выводы и перспективы
SARS-CoV-2 — это третий обнаруженный высокопатогенный коронавирус человека, который впервые был зарегистрирован в городе Ухань и быстро распространился по Китаю и за его пределы. SARS-CoV-2 является глобальной проблемой системы здравоохранения; на данный момент он более заразен, но менее смертоносен по сравнению с SARS-CoV. Хотя летучие мыши и рассматривались как первоначальные хозяева SARS-CoV-2, вопрос о промежуточных хозяевах, а также о путях передачи среди людей остается во многом невыясненным. Этот новый коронавирус, по-видимому, использует тот же рецептор входа в клетку (АПФ2), что и HCoV-NL63 и SARS-CoV, несмотря на то, что степень тяжести заболеваний различается (рис. 2). Поскольку вирусы постоянно изменяются в результате генетического отбора, вполне вероятно, что SARS-CoV-2 будет в дальнейшем адаптироваться к хозяину-человеку посредством мутаций или рекомбинации. Получение эпидемиологической информации (например, истории контактов) и молекулярно-диагностических профилей животных или людей с SARS-CoV-2 может способствовать пониманию эволюции вируса и разработке новых стратегий профилактики или клинических вмешательств. Кроме того, необходимо большое популяционное когортное исследование COVID-19 для дальнейшего определения молекулярных механизмов передачи вируса от человека к человеку и клинических особенностей заболевания, то есть той информации, которая должна быть распространена на международном уровне. Большинство людей с легкой формой заболевания могут полностью выздороветь без лечения, но те, кто страдает тяжелой формой заболевания, определенно нуждаются в интенсивной терапии. Изменение целевого назначения уже существующих препаратов может стать новым вариантом борьбы с COVID-19, поскольку общие молекулярные пути способствуют развитию многих различных патогенных инфекций. Крупномасштабные рандомизированные контролируемые исследования среди пациентов необходимы для оценки безопасности и эффективности потенциальных препаратов для лечения инфекции, вызванной SARS-CoV-2. Наконец, после окончания этой войны с SARS-CoV-2 человечеству еще только предстоит оценить психосоциальные последствия эпидемии в долгосрочной перспективе на индивидуальном, национальном и международном уровнях.
