Деградация белков-циклинов типа D

Выявлен молекулярный механизм разрушения одного из ключевых видов белков клеточного цикла — циклинов типа D. Этот механизм может лежать в основе отсутствия ответа некоторых опухолей на лечебное воздействие ингибиторными препаратами.
Белки, называемые циклинами D-типа (циклин D1, D2 и D3), — это ключевые компоненты ядерного комплекса, управляющего делением клетки. В своих работах в «Nature» Simoneschi с соавт. [1], Chaikovsky с соавт. [2] и Maiani с соавт. [3] отвечают на основные вопросы о деградации D-циклинов.
Во время деления клетки циклины D-типа связываются со своими ферментативными партнерами, называемыми циклин-зависимой киназой 4 (CDK4) и циклин-зависимой киназой 6 (CDK6), и активируют их. Эти киназы фосфорилируют белки-супрессоры опухолей RB1, RBL1 и RBL2, и это способствует клеточному делению (рис. 1). Неконтролируемая активация комплексов циклина D и киназ CDK4/6 является движущей силой в развитии многих типов рака [4].
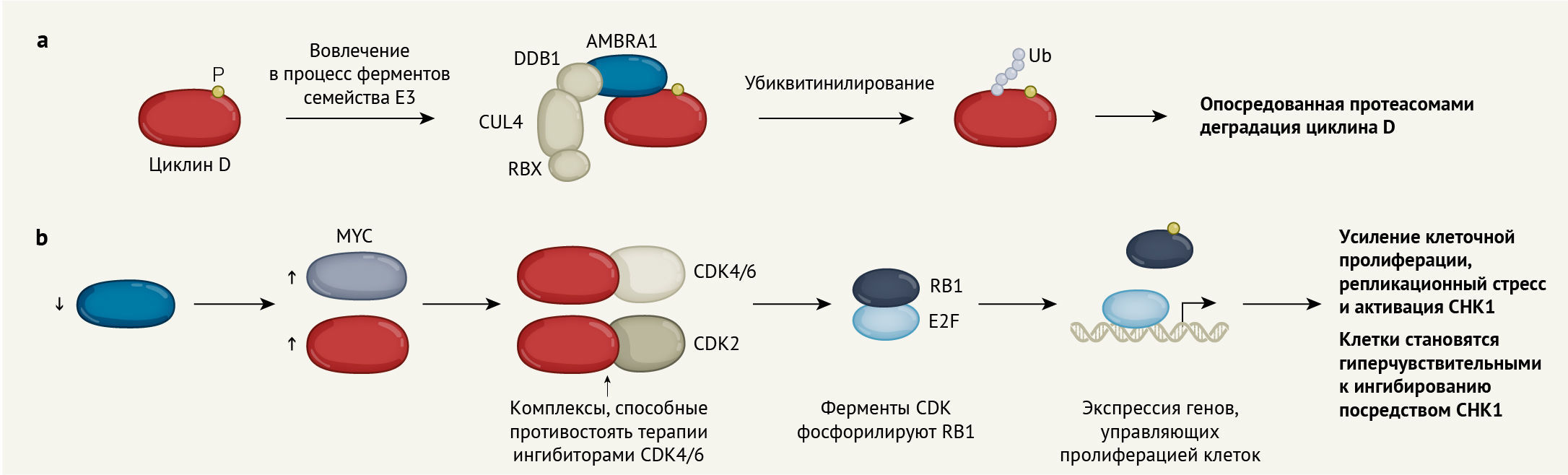
а. Добавление фосфатной группы (P) как метка для белкового комплекса Е3, опосредующего деградацию циклина D. Данный комплекс называется CRL4 и включает белки cullin 4 (CUL4), RBX и DDB1. Белок AMBRA1 направляет циклин D на E3. E3 прикрепляет цепи белков-убиквитинов (Ub) к циклину D, помечая его для разрушения белковым комплексом, называемым протеасомой.
b. Исчезновение AMBRA1 приводит к повышению концентрации циклина D и белков MYC. Обычно циклин D связывается с ферментами CDK4 и CDK6, которые фосфорилируют белок RB1. Фосфорилированный RB1 высвобождает факторы транскрипции E2F для управления экспрессией генов, необходимых для протекания клеточного цикла. В клетках, в которых отсутствует AMBRA1, циклин D образует комплексы с ферментом CDK2. Эти комплексы позволяют раковым клеткам противостоять лечению препаратами-ингибиторами CDK4/6. Клеточная пролиферация, вызванная высоким содержанием циклина D, приводит к повреждению ДНК, репликационному стрессу и активации фермента CHK1. Клетки, в которых отсутствует AMBRA1, гиперчувствительны к лечению ингибиторами CHK1.
В последнее время возрос интерес к метаболизму циклина D и CDK4/6, поскольку в клиническое применение вошли низкомолекулярные ингибиторы киназ CDK4/6. Результаты клинических испытаний этих веществ свидетельствуют об их способности увеличивать продолжительность жизни людей с раком груди. Ингибиторы CDK4/6 (палбоциклиб, рибоциклиб и абемациклиб) получили одобрение для лечения запущенных форм рака молочной железы. Более того, эти препараты задействованы в нескольких сотнях клинических испытаний, в ходе которых происходит поиск способов лечения многих различных типов рака [4, 5].
Циклины D-типа интенсивно изучаются с момента их открытия в 1990-е годы, но вопрос о том, как происходит их деградация во время клеточного цикла, остается спорным. Фосфорилирование карбоксильной концевой области D-циклинов запускает разрушение этих белков с помощью пути деградации, опосредованного убиквитин-протеасомной системой [6]. Система состоит из комплекса ферментов, включающего активатор убиквитина (E1), конъюгатор убиквитина (E2) и убиквитин-лигазу (E3); эти структуры связывают цепи нескольких молекул небольшого белка убиквитина с белками-мишенями посредством процесса, называемого убиквитинилированием. Эти убиквитинилированные белки затем подвергаются деградации в белковом комплексе, называемом протеасомой.
Самым большим семейством среди E3 являются cullin-RING лигазы (CRL). CRL состоят из cullin-белка, белка RING (который запускает E2), адаптивного белка и одного из многих различных белков субстрата-рецептора, ответственных за вовлечение целевого белка в комплекс E3 [7–9]. Некоторые субстратные рецепторы к E3, называемые CRL1, вовлечены в деградацию циклина D1, другие считаются мишенями воздействия для циклинов D2 и D3 для разрушения в протеасомах. Кроме того, как было выявлено, циклин D1 убиквитинилируется комплексом, запускаемым в анафазу, E3, который воздействует на несколько белков клеточного цикла [9]. В отличие от этих моделей функционирования, результаты других исследований [10] свидетельствуют, что на уровень и стабильность циклина D1 не влияет снижение содержания этих белков. Это указывает на то, что другие E3 регулируют деградацию циклина D1.
В статьях Simoneschi, Chaikovsky, Maiani с соавт. сообщается, что три циклина D-типа убиквитинилирутся и воздействуют на протеасомную деградацию с помощью подвида E3, называемого CRL4, с белком AMBRA1 в качестве рецептора субстрата. Уже было известно, что AMBRA1 играет ключевую роль в регуляции аутофагии — процесса, при котором клетки разрушают поврежденные органеллы или белковые структуры [11, 12]. Белок AMBRA1 также удалось идентифицировать как субстратный рецептор E3, в том числе и CRL4 [7, 13]. Проведя серию экспериментов с использованием методов клеточной, молекулярной биологии и генетики эмбриогенеза для получения сведений, одинаково применимых для биологии как мышей, так и человека, Simoneschi, Chaikovsky and Maiani с соавт. удалось продемонстрировать, что снижение концентрации AMBRA1 в нормальных и раковых клетках, а также в развивающихся эмбрионах мыши приводит к повышению содержания циклинов D-типа. Это приводит к большей степени фосфорилирования RB1 и большей пролиферации клеток, нежели чем это происходит в клетках с нормальным количеством AMBRA1.
Maiani с соавт. также продемонстрировали, что снижение содержания AMBRA1 приводит к повышению концентрации белка фактора транскрипции N-MYC. Этой же группой исследователей ранее было показано [14], что AMBRA1 регулирует стабильность и активность еще одного фактора транскрипции c-MYC. Белки семейства MYC могут повышать экспрессию циклинов D-типа и E-типа [15], тем самым ускоряя клеточный цикл.
Исходя из этих наблюдений, предполагается, что AMBRA1 может действовать как белок-супрессор опухоли. Действительно, у мышей с одной функциональной копией гена, кодирующего AMBRA1, чаще возникают опухоли легких, печени и почек, чем у нормальных мышей с двумя функциональными копиями этого гена [14]. Эти новые исследования предоставляют убедительные доказательства в поддержку данной гипотезы.
Авторы показывают, что при онкологическом заболевании у человека ген AMBRA1 мутирован. Как и ожидалось, учитывая то, что AMBRA1 способствует деградации циклина D1, авторы указывают, что уровень AMBRA1 в опухолевых тканях человека находился в обратной корреляционной зависимости от уровня циклина D1. Более того, низкий уровень AMBRA1 в опухолях оказался связан с плохим прогнозом для людей с онкологическими процессами. Экспериментальная инактивация AMBRA1 либо в опухолевых клетках человека, либо в клетках мыши, выращенных с помощью методов генной инженерии с мутациями, приводящими к развитию рака, увеличила опухолевый потенциал клеток, что было оценено после введения инъекции мышам. Кроме того, удаление гена AMBRA1 стимулировало образование опухоли (что было продемонстрировано на мышиной модели рака легкого), вызванной мутантной версией гена Kras, и у этих AMBRA1-дефицитных опухолей обнаружился более высокий уровень D-циклинов. Данные всех трех исследований свидетельствуют о том, что в основном AMBRA1 сдерживает пролиферацию клеток, не давая D-циклинам достигать высоких концентраций.
Кроме того, Chaikovsky, Simoneschi с соавт. демонстрируют, что исчезновение AMBRA1 и соответствующее повышение концентрации D-циклинов приводит к снижению чувствительности опухолевых клеток человека к ингибиторам CDK4/6. Интересно, что эти же авторы указывают, что в клетках со сниженной концентрацией AMBRA1, а не в комплексе с CDK4/6, циклин D1 также образует каталитически активный комплекс с циклин-зависимым ферментом киназой CDK2. Также у этих комплексов отсутствует чувствительность к ингибиторам CDK4/6.
Maiani с соавт. также указывают, что исчезновение AMBRA1 и, как следствие, повышение содержания D-циклинов (и, возможно, также других белков, таких как c-MYC), вызывает повреждение ДНК и репликационный стресс, который сопровождается активацией фермента киназы CHK1. Важно отметить, что Maiani с соавт. сообщают о том, что раковые клетки со сниженной концентрацией AMBRA1 гиперчувствительны к лечению ингибиторами CHK1, что предполагает потенциальную возможность терапевтического воздействия на опухоли, у которых обнаруживается дефицит AMBRA1.
Эти удивительные результаты поднимают несколько важных вопросов. Например, может ли снижение уровня AMBRA1 лежать в основе существующей или приобретенной устойчивости опухолей человека к ингибиторам CDK4/6? Является ли повышение содержания D-циклинов, которое наблюдается при исчезновении AMBRA1, единственным фактором, ответственным за развитие устойчивости к ингибиторам CDK4/6? Анализ клинических испытаний на людях с раком груди [16–19] не выявил корреляции между наличием добавочных копий гена, кодирующего циклин D1, или уровнем матричной РНК циклина-D1, или белка в опухолях и реакцией пациента на ингибиторы CDK4/6. Действительно, Chaikovsky с соавт. обнаружили, что раковые клетки человека, у которых более выражена экспрессия D-циклинов по сравнению с нормой, не обладают всеми характеристиками устойчивости к ингибиторам, как при почти полном исчезновении AMBRA1. Возможно, другие белки, регулируемые AMBRA1, такие как c-MYC, которые могут активировать белок циклин E и комплексы циклин E-CDK2, влияют на устойчивость к лечению.
Наблюдение Chaikovsky с соавт. и Simoneschi с соавт. того, как образуются комплексы циклин D – CDK2, устойчивые к препаратам-ингибиторам CDK4/6, в клетках, в которых снижено содержание AMBRA1, является невероятно занимательным для молекулярной онкологии. Как было обнаружено ранее, такие «атипичные» комплексы лежат в основе приобретенной устойчивости к ингибированию CDK4/6 [20]. Итак, можно предположить, что снижение концентрации AMBRA1 каким-то образом способствует образованию этих комплексов циклина D с CDK2, и это наряду с повышением концентрации циклина D приводит к устойчивости к ингибиторам CDK4/6. Особенно интересная перспектива, проистекающая из работы Maiani с соавт., заключается в том, что ингибиторы CHK1 можно использовать для лечения опухолей, устойчивых к ингибиторам CDK4/6, в которых крайне мало содержание AMBRA1.
Необходимы дальнейшие исследования роли AMBRA1 в развитии рака у человека. Опосредуется ли супрессивная функция AMBRA1 на опухоль преимущественно циклином D1 или c-MYC, либо же она также опосредована иными соединениями? Опухолевые клетки, которые больше не продуцируют RB1, не требовательны к наличию D-циклинов для клеточного цикла [4], поэтому, как можно предположить, исчезновение AMBRA1 будет наблюдаться в опухолях, которые продуцируют RB1, в случае, если D-циклины являются основной молекулярной мишенью AMBRA1. Также еще предстоит определить, является ли исчезновение AMBRA1 в опухолях человека взаимоисключающим параметром в связи с наличием мутаций, затрагивающих C-концы D-циклинов, которые, как предполагают, могут сделать D-циклины устойчивыми к деградации, опосредованной AMBRA1. Другой нерешенный вопрос заключается в том, почему (по данным Chaikovsky с соавт.), существует корреляционная зависимость между низкой степенью экспрессии AMBRA1 и высокими концентрациями циклина D1. Также неясно, почему эта низкая степень экспрессии AMBRA1 связана с плохой выживаемостью при опухолях легких, в которых присутствуют определенные типы генетических изменений, например, мутации Kras. Этот эффект не наблюдается для опухолей легких, в которых вместо этой мутации были мутантные версии гена, кодирующего белок EGFR, или Kras дикого типа.
Независимо от ответов на эти вопросы, впечатляющие исследования Chaikovsky с соавт., Maiani с соавт. and Simoneschi с соавт. вносят свой важный вклад в понимание механизмов, управляющих клеточным циклом.
