Определена нейронная цепь, участвующая в ноцицептивной стимуляции дофаминергических нейронов
Нейромедиатор дофамин (DA) выполняет несколько важных функций. Например, известно, что он участвует в создании ощущения удовольствия, а также в способности концентрироваться на повседневных задачах, сохранять концентрацию внимания и приобретать специфические навыки (т. е. в процессе обучения).
Нейробиологические исследования, проведенные ранее, показывают, что ноцицепция снижает активность дофаминергических нейронов в вентральной области покрышки (ВОП) — структуре среднего мозга, прилегающей к черной субстанции. ВОП — ключевая часть системы поощрения; это сеть структур в мозге человека и других млекопитающих, которая поддерживает способность обучаться посредством поощрения.
Хотя, согласно данным исследований, боль снижает активность многих дофаминергических нейронов ВОП, остаются неизученными конкретные нейронные цепи, обьединяющие ноцицепцию (т. е. процесс, посредством которого восприятие хронической боли и стресса передается по нервной системе) и активность дофаминергических нейронов.
Недавно ученые из Калифорнийского университета в Беркли (UC Berkeley) и Университета науки и технологий Хуачжун в Китае провели исследование, посвященное изучению нейронных цепей, участвующих в восприятии боли и стрессорных воздействий. Результаты этой работы, опубликованные в Nature Neuroscience, помогут раскрыть детали того, как боль влияет на приобретение паттернов поведения как у людей, так и у других животных.
В ходе исследования командой из Калифорнийского университета в Беркли была проведена серия экспериментов на взрослых мышах. Авторы применяли разные методы, такие как антероградная трассировка аденоассоциированного вируса (AAВ) и флуоресцентная микрооптическая секционная томография (фМОСТ). Результаты этих методик были объединены с данными нейровизуализации мозга взрослых мышей.
Затем исследователи выполнили ретроградную трассировку нескольких структур:
- сетчатого слоя черной субстанции (ССЧС) — ключевого центра обработки информации в базальных ганглиях;
- вентральной области покрышки (ВОП) — области, прилегающей к черной субстанции;
- центрального ядра миндалины (ЦЯМ).
Авторы отмечают, что латеральные парабрахиальные (ЛПБ) нейроны, имеющие проекции в вышеперечисленных структурах, обособлены анатомически.
В опубликованной ими статье ученые сообщают, что группа латеральных парабрахиальных (ЛПБ) нейронов играет решающую роль в процессе передачи ноцицептивных сигналов от спинного мозга к ССЧС.
ЛПБ-нейроны, имеющие проекции в ССЧС, активируются болевыми раздражителями, а их подавление блокирует болевые ответные реакции в двух разных паттернах болевого восприятия. Нейроны, направляющиеся к ЛПБ-нейронам и нейроны ССЧС, воспринимающие ноцицептивные сигналы, регулируют дофаминергическую активность нейронов ВОП как непосредственно с помощью прямого ингибирования, так и опосредованно — путем подавления определенной популяции ЛПБ-нейронов, имеющих проекции в ВОП, что приводит к снижению возбуждающего действия на дофаминергические нейроны ВОП.
Результатами экспериментов, проведенных этой группой исследователей, стали интересные и очень ценные наблюдения. В конце концов команда смогла определить конкретную нейронную цепь, которая передает болевые сигналы дофаминергическим нейронам.
Полученные данные могут оказаться крайне полезными для изучения боли, особенно для исследований, посвященных ее влиянию на приобретение людьми определенных паттернов поведения. Таким образом, эта работа может проложить путь к будущему изучению уникальной спинально-парабрахиально-мезэнцефальной цепи нейронов, которую удалось выявить ученым.
В своей работе авторы отмечают, что определение нейронной цепи, передающей ноцицептивный сигнал к дофаминергическим нейронам, крайне важно для понимания того, как боль влияет на обучение и поведение человека.
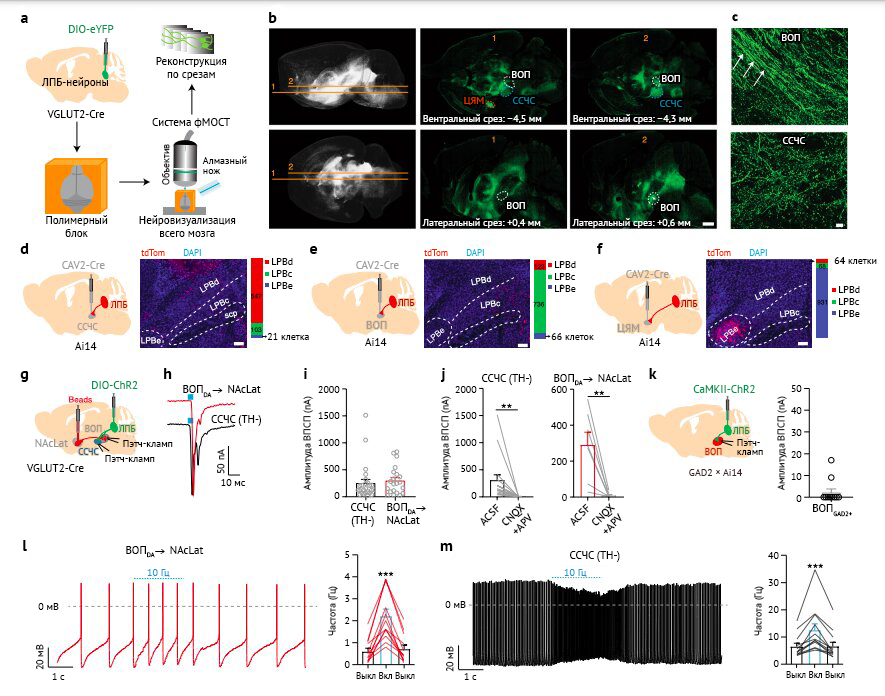
b — Метод флуоресцентной визуализации всего мозга, демонстрирующий проекции глутаматергических ЛПБ-нейронов (экспрессия желтого флуоресцирующего белка — зеленый цвет; верхний ряд изображений — горизонтальный срез; нижний ряд — сагиттальный срез). ВОП, ССЧС и ЦЯМ выделены разными цветами (шкала масштаба — 1 мм).
c — Окончания глутаматергических ЛПБ-нейронов и волокна их аксонов (белые стрелки) в различных зонах вентральной части среднего мозга (шкала масштаба, 50 мкм).
d–f: слева — Инъекция CAV2-Cre в ССЧС (г), ВОП (д) и ЦЯМ (е) мышей линии Ai14 (n = 3 мыши для каждой группы искомой проекции нейронов); в центре — ретроградно меченные нейроны (положительные по оранжевому флуоресцирующему белку tdTomato, обозначены красным) в различных зонах ЛПБ (окрашены DAPI, синий цвет на рисунке; шкала масштаба — 100 мкм). Справа: количественная оценка ретроградно меченных клеток различных зонах ЛПБ.
g — Проект эксперимента.
h — Возбуждающие постсинаптические потенциалы (ВПСП), генерируемые при –70 мВ за счет световой стимуляции в глутаматергических ЛПБ-нейронах, которые передаются на дофаминергические нейроны ВОП (т. е. иммунопозитивные по тирозин-гидроксилазе; расширенные данные на рис. 1о), проекции которых идут к латеральной части прилежащего ядра (NAcLat) и недофаминергическим клеткам сетчатого слоя черной субстанции (показано черным).
i — Средние амплитуды возбуждающих постсинаптических потенциалов, инициированных стимуляцией светом глутаматергических нейронов ЛПБ и переданных в различные группы клеток (DA → NAcLat (латеральная часть прилежащего ядра), n = 21 клетка; ССЧС, n = 25 клеток; запись производилась в искусственной спинномозговой жидкости (ACSF)).
j — Применение 20 мкмоль CNQX (6-циано-7-нитрохиноксалин-2,3-дионe) и 50 мкмоль APV (R-2-амино-5-фосфонопентоат) блокировало ВПСП в клетках ССЧС (n = 16 клеток) и DA-нейронах, являющихся проекциями NAcLat (n = 7 клеток).
k — Проект эксперимента (слева) и амплитуды ВПСП, полученные при световой стимуляции возбуждающих входов ЛПБ-нейронов, переданные GAD2-tdT-положительным (по глутамат-декарбоксилазе 2 и tdTomato) нейронам ВОП (справа; VTAGAD2 +, n = 10 клеток; регистрация проведена в ACSF).
l, m — Спонтанное возбуждение от дофаминергических нейронов ВОП, имеющих проекции в NAcLat (м) и клеток ССЧС (н) в ответ на световую стимуляцию 10 Гц глутаматергических нейронов ЛПБ. Стимуляция последних значительно увеличивала активацию как дофаминергических нейронов, имеющих проекции в NAcLat, так и клеток ССЧС (NAcLat, n = 12 клеток; ССЧС, n = 12 клеток). Статистическая значимость была рассчитана с помощью парного t-критерия внутригруппового сравнения (к), непарного t-критерия (и) или одностороннего анализа с повторными измерениями (ПИ) с апостериорным критерием Тьюки (м и н).
