Тирзепатид: новый способ снизить массу тела и уровень глюкозы крови

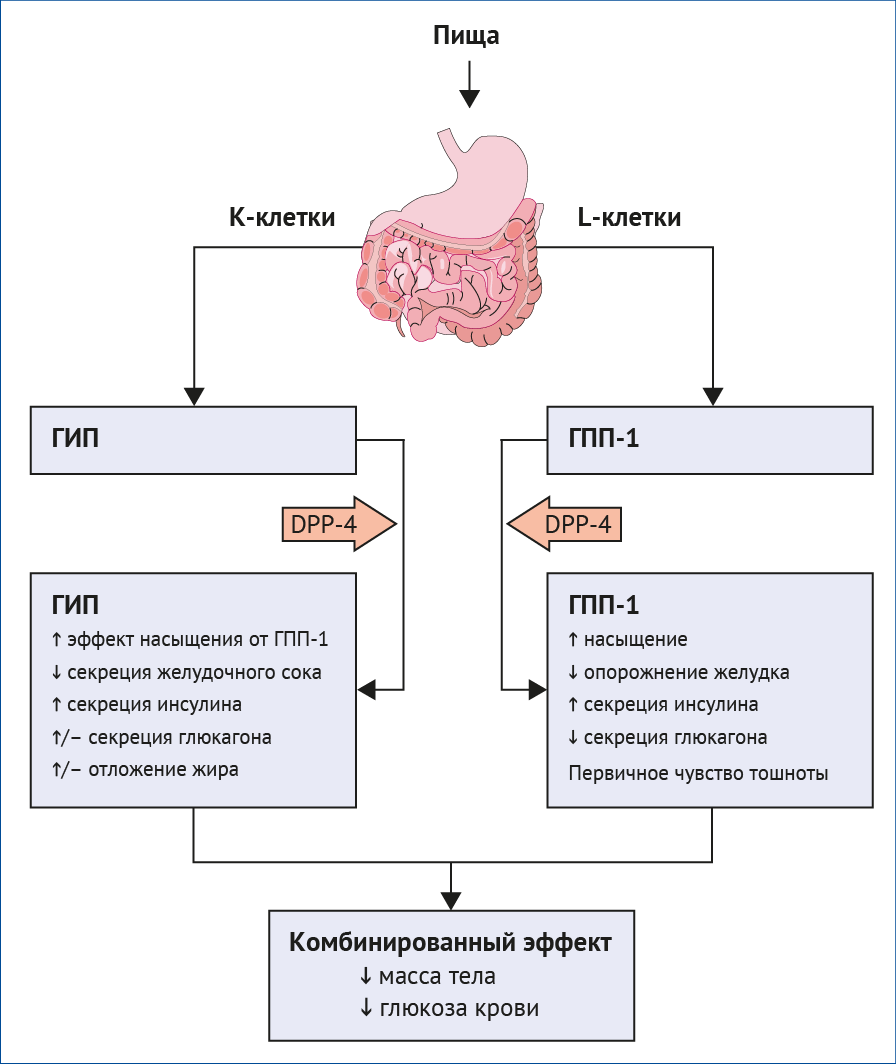
Нормальный эффект инкретина — усиленный ответ на прандиальный инсулин — главным образом стимулируется приемом пищи и, как следствие, ведет к высвобождению кишечных гормонов глюкагоноподобного пептида 1 (ГПП-1) и глюкозозависимого инсулинотропного пептида (ГИП). Аналоги ГПП-1, которые действуют как агонисты рецептора ГПП-1, являются доказанными сахароснижающими веществами, которые потенцируют высвобождение инсулина и подавляют глюкагон глюкозозависимым образом. Агонисты рецептора ГПП-1 также способствуют снижению веса за счет уменьшения потребления пищи, создавая ощущение сытости за счет замедленного опорожнения желудка, а также посредством регулирования чувства голода и насыщения на уровне гипоталамуса.
ГИП, вероятно, вносит больший вклад в нормальную реакцию на прандиальный инсулин, нежели ГПП-1, однако ГИП не использовался в терапевтических целях, поскольку его инсулинотропная активность значительно снижается при диабете второго типа. Тем не менее, последующие исследования показали, что инсулинотропная активность ГИП восстанавливается у людей с диабетом второго типа, если гипергликемия контролируется другим агентом, например, инсулином. Это открытие позволило вернуть к рассмотрению вопрос об использовании ГИП в терапевтических целях, что в итоге привело к созданию новового миметика инкретина, тирзепатида, в котором сочетаются агонисты рецепторов ГИП и ГПП-1 в одном химерном пептиде.
В чем заключается терапевтический эффект ГИП, помимо инсулинотропного эффекта? Интересно, что доклинические исследования показали, что как усиление, так и ингибирование действия ГИП может предотвратить или обратить вспять развитие инсулиннезависимых форм диабета в моделях ожирения на грызунах, но видовые различия относительно чувствительности рецепторов ГИП затрудняют экстраполирование доклинических данных на диабет второго типа у людей. Более того, фармакологические концентрации ГИП могут увеличивать секрецию глюкагона и способствовать отложению жира, однако этим эффектам можно противостоять путем подавления секреции глюкагона и снижения потребления пищи посредством активации ГПП-1. Тирзепатид был разработан, чтобы точно имитировать физиологический баланс инкретинов ГИП и ГПП-1 и продлять активность эффекта с помощью структуры, которая предотвращает разложение дипептидилпептидазы 4 (ДПП-4) и присоединяется к альбумину через жирную кислоту C20.
На данный момент существует недостаточно данных для выявления корреляции между ГИП и потреблением пищи, но данный пептид, по-видимому, усиливает центральный эффект насыщения и потерю веса, связанные с ГПП-1. ГИП также может увеличить прочность костей, когнитивные функции и некоторые аспекты липидного профиля, но его влияние на здоровье сердечно-сосудистой системы еще предстоит выяснить.
Эффективность и безопасность тирзепатида у людей с сахарным диабетом второго типа были изучены в рамках фазы III программы SURPASS. Тирзепатид вводили подкожно один раз в неделю в течение 40 или 52 недель; результаты, обобщенные ниже, относятся к группе, получавшей увеличенную дозу 15 мг (самая высокая испытанная доза).
Монотерапия тирзепатидом снижала гликозирированный гемоглобин (HbA1c) на 2,07 % (23 ммоль/моль) и массу тела на 9,5 кг по сравнению с исходным уровнем 7,9 % (63 ммоль/моль) и индексом массы тела 31,9 кг/м2. Аналогично, в качестве дополнения к метформину, тирзепатид снижал HbA1c на 2,3 % (25 ммоль/моль) и массу тела на 11,2 кг по сравнению с исходным уровнем 8,28 % (67 ммоль/моль) и индексом массы тела 34,2 кг/м2. Для сравнения, наиболее сильный на данный момент агонист рецептора ГПП-1 семаглутид (с дозировкой 1 мг один раз в неделю) оказался менее эффективен, чем тирзепатид, и снижал HbA1c на 1,86 % (20 ммоль/моль) и массу тела на 5,7 кг.
В следующих двух исследованиях SURPASS тирзепатид был добавлен к существующему лечению по схеме «метформин ± ингибитор SGLT2» и сравнивался с добавлением базального инсулина. Тирзепатид снижал HbA1c на 2,37–2,58 % (25–28 ммоль/моль) от исходных значений 8,17–8,52 % (65–69 ммоль/моль), превышая снижение HbA1c с помощью деглудека и гларгина (1,34 % [14 ммоль/моль] и 1,44 % [15 ммоль/моль], соответственно) и позволяя избежать умеренного увеличения веса (2,3 кг и 1,9 кг, соответственно), связанного с базальными инсулинами.
Когда в ходе другого исследования тирзепатид был добавлен в терапию инсулинзависимых пациентов (применяющих гларгин) с сахарным диабетом второго типа, уровень HbA1c был снижен на 2,59 % (28 ммоль/моль) по сравнению с 0,98 % (11 ммоль/моль) посредством инсулина, тогда как масса тела была снижена на 10,9 кг с терзипатидом и увеличена на 1,7 кг с инсулином в схеме терапии.
Поскольку при применении тирзепатида было зафиксировано существенное снижение уровня HbA1c и массы тела, превышающее эффект снижения глюкозы агонистом рецептора ГПП-1 и базальным инсулином, возникает вопрос, можно ли и в какой степени заменить эти признанные препараты на тирзепатид при лечении диабета второго типа. Инсулин остается препаратом выбора для пациентов с трудноконтролируемой гипергликемией, поэтому компании, синтезирующие агонисты рецепторов ГПП-1, стремятся изучать эффективность более высоких доз препарата и комбинаций с другими пептидами. Например, более высокие дозы семаглутида уже одобрены для лечения ожирения и приводят к большему снижению уровня HbA1c, чем доза, протестированная в исследованиях SURPASS.
Кроме того, комбинация семаглутида с аналогом амилина кагрилинтидом (в обоих случаях препарат вводился подкожно один раз в неделю в течение 20 недель с увеличением дозы до 2,4 мг) снижала массу тела на 17,1 % у участников с избыточным весом или ожирением, но без диабета. Значительное снижение массы тела и гликемии также наблюдалось в ходе пилотных исследований с комбинациями пептидов и химерных структур с агонистом рецепторов ГПП-1 оксинтомодулином, пептидом YY и другими желудочно-кишечными гормонами. Однако модифицированные пептиды несут риск иммунологических реакций, а побочные эффекты со стороны желудочно-кишечного тракта часто ограничивают увеличение дозы терапии на основе инкретина.
Исследования тирзепатида служат своевременным напоминанием о том, что контроль веса остается ключевым фактором в лечении сахарного диабета второго типа. Ограничение калорийности, снижающее вес на 10–15 кг, позволило достичь уровня HbA1c менее 6,5 % (< 48 ммоль/моль) без применения противодиабетических препаратов у 57 % людей с недавно диагностированным избыточным весом или ожирением и диабетом второго типа. Однако людям с диабетом второго типа труднее похудеть и в дальнейшем поддерживать более низкий вес, отчасти из-за снижения глюкозурии и повышенной чувствительности к инсулину.
Тем не менее, долгосрочная консолидация снижения веса и поддержания контроля гликемии у людей с диабетом второго типа была достигнута с помощью бариатрической хирургии, что позволяет поддерживать уровень HbA1c менее 6,5 % (< 48 ммоль/моль) примерно у 50 % пациентов без противодиабетических препаратов в течение пяти лет.
В исследованиях SURPASS более 80 % участников, получавших тирзепатид в дозе 15 мг, достигли уровня HbA1c менее 6,5 % (< 48 ммоль/моль). Это открытие позволяет предположить, что фармакотерапия с двойным агонистом на основе инкретина, снижающая уровень глюкозы, может стать альтернативой строгим ограничениям в питании и может бросить вызов противодиабетическим эффектам бариатрической хирургии.
