Мужское бесплодие

Бесплодие обычно определяется как неспособность пары зачать ребенка после одного года незащищенных половых отношений [1]. Бесплодием страдают не менее 180 миллионов пар по всему миру [2]. Мужское бесплодие — это неспособность мужчины зачать ребенка фертильной женщине в течение как минимум одного года незащищенных половых контактов. Поскольку мужские и женские причины часто сосуществуют, важно, чтобы оба партнера обследовались на предмет бесплодия и лечились вместе. Факторы со стороны мужчины, когда причины бесплодия кроются в патологических состояниях мужского организма, вносят существенный вклад примерно в 50 % всех случаев бесплодия [3].
Существует несколько причин возникновения мужского бесплодия, включая как обратимые, так и необратимые состояния. К факторам, которые могут влиять как на мужскую, так и на женскую фертильность, относятся возраст, прием лекарственных препаратов, перенесенные оперативные вмешательства, воздействие токсинов окружающей среды, генетические аномалии и системные заболевания. Ключевые задачи при оценке фертильности мужчины — выявить факторы, приводящие к развитию бесплодия, предложить лечение для устранения обратимых факторов, определить, является ли мужчина кандидатом на вспомогательные репродуктивные методы (ВРТ), и предоставить консультации при выявлении необратимых и неизлечимых состояний [4]. В редких случаях мужское бесплодие может быть предвестником или симптомом более серьезного заболевания. Это еще одна причина проводить комплексное обследование мужчин в бесплодных парах, чтобы можно было выявить и вылечить любые серьезные заболевания, лежащие в основе бесплодия [5].
Этиология
Существует множество причин мужского бесплодия. Довольно условно их можно разделить на три большие группы: претестикулярные, тестикулярные и посттестикулярные. Претестикулярные причины, к которым относятся эндокринные нарушения, составляют от 2 до 5 % всех случаев мужского бесплодия. К ним относятся врожденный дефицит гонадолиберина (гонадотропин-рилизинг-гормона, ГнРГ) — синдром Каллмана, изолированные дефициты лютеинизирующего гормона и фолликулостимулирующего гормона. Существуют генетические заболевания, приводящие к вторичному гипогонадизму и/или гипопитуитаризму — например, синдром Прадера-Вилли, синдром Лоуренса — Муна и наследственная мозжечковая атаксия. Также к претестикулярным причинам относятся избыток железа в организме (например, гемохроматоз и гемосидероз), гипофизарная недостаточность, вызванная опухолевыми процессами, травмами головного мозга, операциями и лучевой терапией, избыточный прием тестостерона или гипертиреоз.
Тестикулярные причины — врожденные и приобретенные патологии развития яичек составляют 65–80 %. Посттестикулярные причины — нарушения транспорта спермы, например, вазэктомия, врожденная аплазия семявыносящего протока, обструкция вследствие перенесенного острого и хронического эпидидимита, являются причиной мужского бесплодия в 5 % случаев. Это приблизительные оценки процентного соотношения причин мужского бесплодия, поскольку точные статистические данные недоступны из-за сложностей в сборе данных, культурных и региональных различий [6]
Рассмотрим подробнее патологические причины и факторы, которые приводят к мужскому бесплодию:
- Генетические причины: мутации гена-регулятора трансмембранной проводимости при муковисцидозе (CFTR), первичная цилиарная дискинезия, синдром Клайнфельтера, синдром Юнга, синдром Дель Кастильо, дефекты генов GnRH1/GNRHR и PROK2/PROK2R, микроделеция Y-хромосомы, мутации андрогенового рецептора и др.
- Врожденные аномалии мочеполовой системы: отсутствие или закупорка придатка яичка, врожденные аномалии семявыносящего протока, крипторхизм.
- Приобретенные урогенитальные аномалии: двусторонняя непроходимость или перевязка семявыносящих протоков (вазэктомия), двусторонняя орхиэктомия, эпидидимит, варикоцеле, ретроградная эякуляция.
- Иммунологические причины: лимфоцитарный гипофизит, саркоидоз, гистиоцитоз, туберкулез, грибковые инфекции.
- Урогенитальные инфекции, в том числе рецидивирующие: гонококковая и хламидийная, сифилис, туберкулез, простатит и рецидивирующий простатовезикулит.
- Сексуальная дисфункция: преждевременная эякуляция, анэякуляция, редкие половые контакты и эректильная дисфункция.
- Злокачественные новообразования: опухоли хиазмально-селлярной и параселлярной области (в области турецкого седла, которые могут сдавливать гипофиз): аденомы гипофиза, краниофарингиомы, перенесенное хирургическое или лучевое лечение этих состояний, опухоли яичек или надпочечников, приводящие к избытку андрогенов.
- Прием лекарств, употребление наркотиков: каннабиноиды, опиаты, психотропные препараты могут вызывать ингибирование продукции ГнРГ. Прием препаратов экзогенного тестостерона или андрогенных стероидов, аналогов и антагонистов ГнРГ, используемых при раке предстательной железы, длительная глюкокортикоидная терапия, прием алкилирующих препаратов при химиотерапии, прием антиандрогенов, кетоконазола, циметидина.
- Действие токсических веществ: инсектицидов, фунгицидов и пестицидов, курение и алкоголизм.
- Идиопатические случаи мужского бесплодия, когда у мужчины нет отклонений в параметрах спермограммы и других органических и функциональных причин бесплодия, представляют от 10 до 20 % в этиологической структуре [6].
Мужское бесплодие также классифицируют по возможной эффективности медицинских вмешательств, которые могут способствовать зачатию [7]:
- Излечимые причины мужского бесплодия встречаются у 18 %. К таким причинам относятся обструктивная азооспермия, кисты эякуляторных протоков и средней линии предстательной железы, дефицит гонадотропина, нарушения половой функции, аутоиммунитет сперматозоидов, варикоцеле и обратимые эффекты токсических веществ.
- К случаям неизлечимого мужского бесплодия относятся пациенты, у которых есть теоретическая способность к зачатию. Мужчины становятся кандидатами на вспомогательные репродуктивные технологии (ВРТ). Неизлечимое бесплодие составляет 70% случаев, и к нему относится олигозооспермия, астенозооспермия, тератозооспермия и нормоспермия с функциональными дефектами. Также в эту группу относят пациентов с бесплодием, рефрактерным к лечению.
- Остальные 12 % составляют случаи полной стерильности, обусловленные первичной недостаточностью семенных канальцев, синдромом Дель Кастильо, двусторонней орхиэктомией. Это состояния, при которых отсутствует даже теоретическая возможность к зачатию.
Спермограмма — лабораторная оценка эякулята
Большую озабоченность вызывает широко распространенная за последние десятилетия общемировая тенденция к снижению количества сперматозоидов [8]. Среднее количество сперматозоидов в 1940 году составляло 113 млн в 1 мл эякулята, но в 1990-х годах упало до 66 млн/мл [9]. Точные причины неизвестны, но считается, что это связано с долгосрочным воздействием токсинов окружающей среды и с улучшением качества и доступности медицинской помощи по всему миру. Это, как ни парадоксально, позволяет большинству мужчин с достаточно серьезными проблемами со здоровьем иметь детей. Возможно, что зарегистрированное снижение количества сперматозоидов может быть вызвано разными использованными лабораторными методами и различными референсными значениями в каждой лаборатории.
Бесплодные мужчины, по-видимому, имеют повышенный риск развития онкологических заболеваний по сравнению с населением в целом. Этот риск наиболее высок у мужчин с азооспермией [10]. Например, сообщалось, что от 5 до 8 % пациентов с раком яичек страдают азооспермией [11]. Прежде чем перейти к трактовке спермограммы, мы должны дать определения, с помощью которых специалисты по лабораторной диагностике описывают эякулят и характеристики сперматозоидов в образцах.
Номенклатура, характеризующая патологическую сперму, адаптирована из Лабораторного руководства Всемирной организации здравоохранения по исследованию и обработке спермы человека, разработанному в 2010 году [12]. Это руководство также подробно описывает методологию сбора спермы.
- Аспермия — полное отсутствие эякулята вообще.
- Астенозооспермия — наличие менее 32 % подвижных сперматозоидов. При абсолютной астенозооспермии сперматозоиды вообще не движутся, но при этом они не мертвы.
- Азооспермия — отсутствие сперматозоидов в эякуляте.
- Криптозооспермия — сперматозоиды, отсутствующие в свежем препарате, но обнаруженные в центрифугированной пробирке c эякулятом.
- Лейкоспермия (пиоспермия, лейкоцитоспермия) — наличие более 1 × 106мл лейкоцитов в эякуляте.
- Некроспермия или некрозооспермия — полная, когда все сперматозоиды в образце свежей спермы мертвы; неполная, если 5–45 % все еще жизнеспособны.
- Нормоспермия — все параметры спермы в пределах допустимых референсных значений.
- Олигозооспермия — концентрация сперматозоидов более 15 × 106/мл; общее количество сперматозоидов < 39 × 106/мл
- Тератозооспермия — наличие более 4 % морфологически нормальных сперматозоидов.
- Олигоастенотератозооспермия — нарушение всех трех параметров: количество сперматозоидов меньше нормы, они малоподвижны и морфологически аномальны.
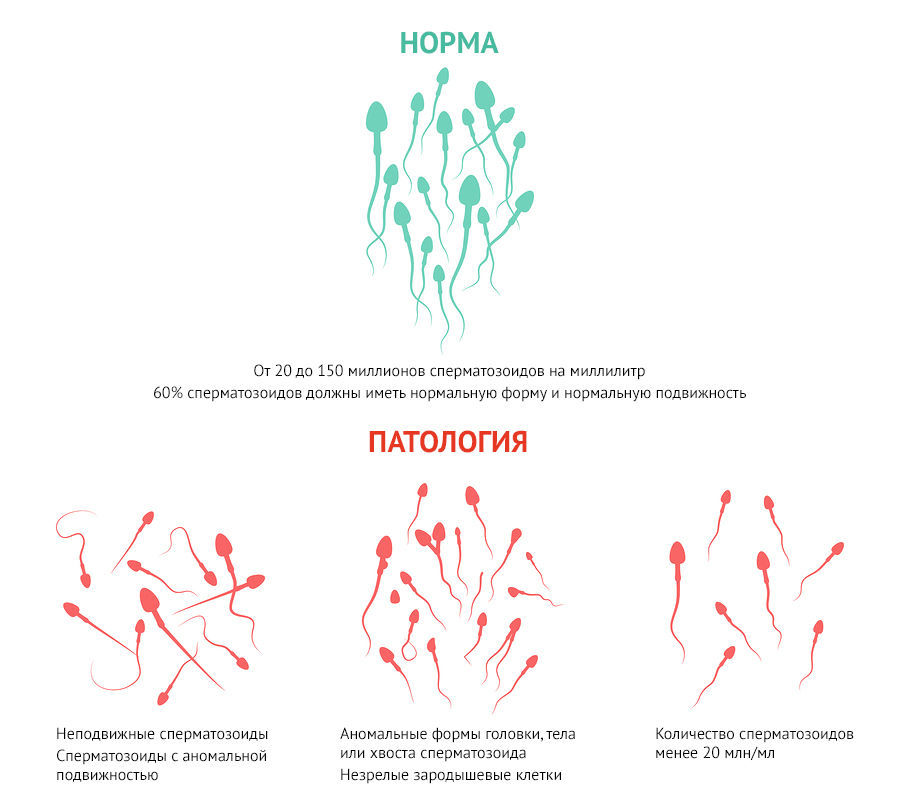
Рисунок 1 | Анализ спермы
Анализ спермы — краеугольный камень лабораторной диагностики мужского бесплодия. Необходимо собрать по крайней мере два отдельных образца с интервалом не менее одной недели. Сбору первой пробы должны предшествовать как минимум три дня воздержания от половых контактов и мастурбации [13]. Это рекомендуется из-за чрезвычайно высокой степени вариабельности анализов спермы [14]. Прогноз и возможные результаты лечения мужского бесплодия в значительной степени зависят от результатов анализа спермы, от статуса фертильности партнерши, а также от того, является ли бесплодие первичным (если беременность не наступала вообще) или вторичным (если женщина была беременна) [15, 16]. Без лабораторного анализа спермы невозможно выявить или исключить патологический фактор со стороны мужчины, который может вызвать бесплодие.
Сегодня на рынке существуют даже домашние тест-системы для анализа спермы на дому, но их применение категорически не рекомендуется, поскольку их надежность сомнительна, и они не проверяют все рекомендуемые параметры спермы.
Важно дать пациентам четкие инструкции по сбору биоматериала. Эякулят можно собрать при помощи мастурбации или с помощью специальных презервативов, которые не содержат токсичных веществ, которые могут повлиять на сперматозоиды [17]. В идеальных условиях, образец собирается в лаборатории, но может быть собран и дома: в таком случае следует хранить его при комнатной температуре и срочно доставить в лабораторию, поскольку очень важно, чтобы материал был исследован в течение часа после сбора.
Оценивается объем спермы, рН, наличие лейкоцитов, незрелых половых клеток, плотность, в то время как сперматозоиды оценивают на количество, концентрацию, жизнеспособность, подвижность, прогрессирование и морфологию [18].
Следует использовать либо критерии ВОЗ для оценки морфологии спермы, либо критерии Крюгера — Тигерберга. Нижние границы нормы с 95-процентными доверительными интервалами, адаптировано по руководству ВОЗ, 2010 [19].
Основные показатели:
- рН > 7,2.
- Объем эякулята: 1,5 мл (1,5–5). При низком объеме возможна ретроградная эякуляция, анэякуляция, обструкция эякуляторных протоков или гипогонадизм.
- Концентрация сперматозоидов: 15 млн/мл (12–16). Обычно нормальное значение: 20 млн/мл.
- Общее количество сперматозоидов: 39 млн в эякуляте (33–46 млн).
- Морфологические (нормальные) формы сперматозоидов: более 4 %. Обычное нормальное значение: более 30 %
- Подвижность: 40 % (38–42 %). Обычное нормальное значение составляет 60 %. Если значение слишком низкое, пациента следует обследовать на наличие варикоцеле и антиспермальных антител.
- Жизнеспособность: 58 % живых сперматозоидов (55–63%).
- Общая подвижность: более 40 % (нормальное значение > 60).
Дополнительные показатели:
- Иммуноферментный тест с более 50 % подвижных сперматозоидов со связанными частицами.
- MAR-тест на смешанную антиглобулиновую реакцию с более 50 % подвижных сперматозоидов.
- Семенная фруктоза ≥ 13 мкмоль/весь эякулят.
- Семенная нейтральная глюкозидаза ≤ 20 миллиунций (mU)/весь эякулят.
- Семенной цинк ≥ 2,4 мкмоль/весь эякулят.
Какова последовательность действий в лаборатории?
В период с 30 до 60 мин после получения образца:
- Оценка разжижения и внешнего вида эякулята.
- Измерение объема эякулята.
- Измерение рН (если требуется).
- Подготовка нативного препарата для оценки микроскопических параметров, подвижности сперматозоидов и разведение образца, требуемое для подсчета количества половых клеток.
- Оценка «живые-мертвые», если процент подвижных клеток низок.
- Приготовление мазка для оценки морфологии сперматозоида.
- Приготовление разведения эякулята для расчета концентрации сперматозоидов.
- Оценка количества сперматозоидов.
- Выполнение смешанной антиглобулиновой реакции (MAR-тест), если требуется.
- Подсчет пероксидаза-положительных клеток (если округлые клетки присутствуют).
- Подготовка сперматозоидов для MAR-теста с иммунными шариками (если необходимо).
- Центрифугирование эякулята (если необходимо оценить биохимические маркеры).
В течение 3 часов после сбора эякулята:
- Доставка образцов в микробиологическую лабораторию (если необходимо).
После 4 часов после сбора эякулята:
- Фиксация, окраска и оценка мазков на предмет морфологии сперматозоидов.
Позднее в тот же день (или на следующий день, если образец заморожен):
- Оценка маркеров секреции предстательной и бульбоуретральных желез (если необходимо).
- Выполнение смешанного антиглобулинового теста (если необходимо).
Другие лабораторные тесты
Анализ на антиспермальные антитела (антитела к спермальным антигенам) в плазме крови следует проводить при агглютинации сперматозоидов или изолированной астенозооспермии при нормальной концентрации сперматозоидов. Эти антитела могут образовываться у мужчин после операции на яичках или вазэктомии, при простатите или в любое время, когда сперма вступает в контакт с кровью. У женщин антитела появляются при аллергической реакции на сперму.
Тест на фрагментацию ДНК сперматозоидов следует проводить, если у женщины есть анамнез повторных выкидышей [20].
Генетический скрининг и выявление хромосомных аномалий могут быть показаны при азооспермии или тяжелой олигозооспермии, поскольку хромосомные аномалии чаще встречаются у бесплодных мужчин (до 15 %), чем у нормальных мужчин (около 0,6 %) [21]. Общими генетическими факторами, которые связаны с бесплодием у мужчин, являются нарушение функции яичек из-за хромосомных аномалий, изолированное нарушение сперматогенеза из-за микроделеций Y-хромосомы и врожденное отсутствие семявыносящего протока из-за мутации гена трансмембранного регулятора проводимости при муковисцидозе (CTFR). И хотя интрацитоплазматическая инъекция сперматозоида в цитоплазму яйцеклетки (ИКСИ, англ. Intra Cytoplasmic Sperm Injection, ICSI) позволила многим мужчинам с поломкой генов иметь детей, существует также повышенный риск передачи различных генетических дефектов потомству. Поэтому генетическое тестирование обычно рекомендуется пациентам с тяжелой олигозооспермией (менее 5 млн сперматозоидов/мл) или азооспермией и состоит из тестирования кариотипа, выявления мутаций в гене CFTR и поиска микроделеций в Y-хромосоме (молекулярное тестирование AZF-регионов).
Анализы на измерение уровня гормонов: показаны, если имеется низкое количество и концентрация сперматозоидов или клинические данные указывают на эндокринное расстройство или сексуальную дисфункцию. Многие эксперты рекомендуют проводить гормональное лабораторное тестирование всем мужчинам, проходящим обследование на бесплодие. Обследование включает уровни фолликулостимулирующего гормона (ФСГ), тестостерона, лютеинизирующего гормона (ЛГ), пролактина, тиреотропного гормона и эстрадиола в сыворотке крови. Повышенный уровень эстрадиола и/или соотношение тестостерон/эстрадиол (T/E) менее 10 предполагает, что препараты ингибитора ароматазы могут улучшить фертильность, нивелируя действие эстрогена. В целом повышенный уровень ФСГ указывает на нарушения сперматогенеза. При желании некоторые дополнительные гормональные тесты могут включать глобулин, связывающий половые гормоны, свободный тестостерон и эстрадиол.
- Низкий уровень тестостерона при высоком уровне ФСГ и ЛГ предполагает первичный гипергонадотропный гипогонадизм, который влияет как на выработку спермы (ФСГ), так и на уровень тестостерона (ЛГ). Низкий уровень тестостерона при нормальных или низких ФСГ и ЛГ указывает на вторичный гипогонадизм.
- Нормальные уровни тестостерона и ЛГ при высоком уровне ФСГ свидетельствуют о первичной сперматогенной недостаточности, особенно если они связаны с азооспермией или тяжелой олигозооспермией.
- Менее тяжелая форма с легкой олигозооспермией может указывать на дисфункцию клеток Сертоли, которая снижает выработку ингибина, повышающего уровень ФСГ.
- Высокий уровень тестостерона и ЛГ, но нормальный уровень ФСГ: это соответствует частичной резистентности к андрогенам.
Посткоитальный тест: рекомендуется в случаях повышенной вязкости спермы, нормальной плотности спермы при увеличенном или уменьшенном объеме спермы, а также в случаях идиопатического или необъяснимого бесплодия. Около 10 % всех бесплодных пар имеют отклонения в показателях посткоитального теста. Тест проводится путем исследования цервикальной слизи на наличие жизнеспособных сперматозоидов через 8 часов после полового акта. Оптимально это делать за 1–2 дня до женской овуляции, когда цервикальная слизь наиболее разжижена. Обнаружение любых жизнеспособных сперматозоидов, которые все еще подвижны, предполагает нормальное взаимодействие спермы и влагалищной слизи.
Роль образа жизни
Как было сказано в начале нашего обзора, наряду с растущей распространенностью не только бесплодия в парах, но и мужского бесплодия, данные свидетельствуют о том, что за последние несколько десятилетий наблюдается мировая тенденция к снижению показателей мужской фертильности. Согласно исследованиям, это может быть, по крайней мере частично, объяснено вредными привычками и воздействием образа жизни. К ним относятся употребление алкоголя и табака, употребление рекреационных наркотиков (например, каннабиса, опиоидов), бесконтрольный прием анаболических стероидов, неправильное питание, ожирение и метаболический синдром, тепловое воздействие на половые органы (например, облучение через сотовые телефоны и ноутбуки, длительное сидение, облегающее нижнее белье и периодические горячие ванны или сауны), воздействие химических веществ, разрушающих эндокринную систему (например, наличие пестицидов в пище, бисфенол А, фталаты и диоксины), a также психологический стресс. Рассмотрим эти факторы по отдельности.
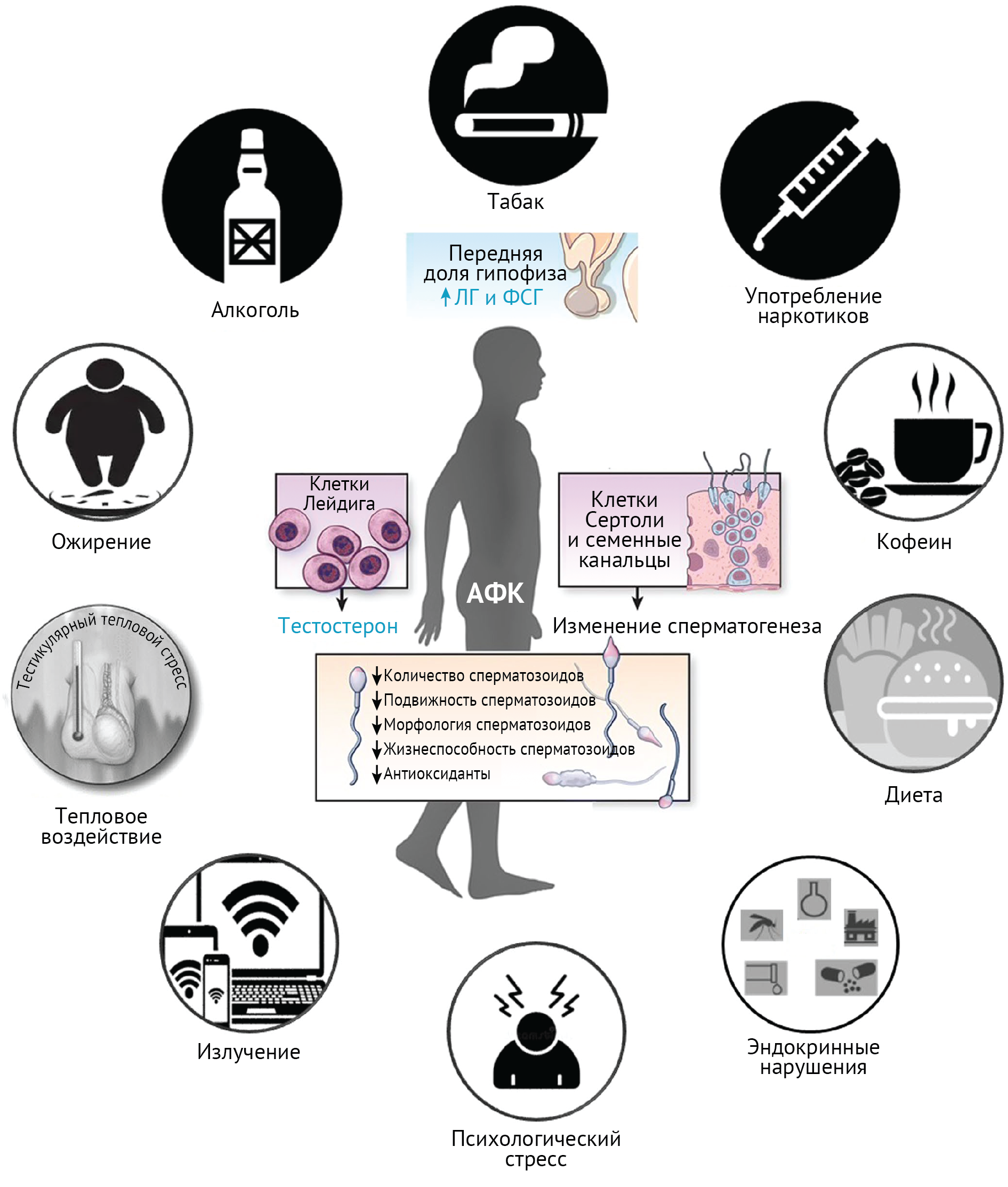
Рисунок 2 | Факторы образа жизни и их влияние на мужскую фертильность
Употребление алкоголя
Потребление алкоголя в малом количестве (менее пяти единиц в неделю, около одного литра пива крепостью 4,8 %), по-видимому, оказывает минимальное влияние на параметры спермы, за исключением уменьшения объема спермы, и даже может повышать уровень тестостерона и улучшать результаты вспомогательных репродуктивных технологий (ВРТ) [22,23]. Однако хроническое и интенсивное (более 20–25 единиц в неделю) употребление алкоголя негативно влияет на сперматогенез и характеристики спермы, включая концентрацию, подвижность и морфологию сперматозоидов [24]. Хроническое злоупотребление алкоголем связано с олигозооспермией, астенозооспермией и тератозооспермией [25], при этом только у 12 % мужчин с хроническим алкоголизмом сообщается о нормозооспермии по сравнению с 37 % мужчин, не употребляющих алкоголь. Есть данные, что остановка сперматогенеза и синдром Дель Кастильо (Сертоли-клеточный синдром) являются распространенной патологией яичек, доказанно вызываемой алкоголем [26]. Сообщалось также об увеличении количества лейкоцитов в сперме при долговременном употреблении алкоголя [27]. Предполагается, что нарушение стероидогенеза и метаболизма тестостерона у алкоголиков частично опосредовано уменьшением числа клеток Лейдига и атрофией яичек [28].
Курение табака
Примерно 21 % мужчин репродуктивного возраста в США регулярно курят табак, что оказывает пагубное влияние на их здоровье в целом и фертильность в частности [29]. Курение подвергает мужчин воздействию более 4700 потенциально мутагенных соединений, особенно полициклических ароматических углеводородов среди других токсичных химических веществ [30]. Однако влияние курения табака на фертильность мужчин в целом остается недооцененным [31]. Олигозооспермия, астенозооспермия и тератозооспермия часто обнаруживаются даже у «умеренных» курильщиков [32]. Сообщалось, что выкуривание более 15 сигарет в день партнерами-мужчинами снижает фертильность пар, пытающихся зачать ребенка [33], и этот эффект пропорционален количеству выкуриваемых сигарет в день и продолжительности курения [34]. Негативное влияние курения на параметры сперматозоидов включает снижение их концентрации, подвижности и жизнеспособности, увеличение числа сперматозоидов с аномальной морфологией, повышение концентрации лейкоцитов в эякуляте и увеличение степени фрагментации ДНК [35, 36, 37]. Курение отца изменяет физиологическую эпигенетическую регуляцию и увеличивает риск генетических заболеваний, пороков развития и возникновения рака у потомства [38]. Курение вызывает окислительный стресс в яичках, влияя на сперматогенез и стероидогенез [39]. Это приводит к нарушению конденсации хроматина, целостности ДНК, нарушению взаимодействия c ооцитом, а также к эпигенетическим модификациям, передающимся следующему поколению [40, 41]. Дополнительные механизмы включают гипоксию, измененную регуляцию энергии в сперматозоидах за счет нарушения активности креатинкиназы, снижение синтеза тестостерона в клетках Лейдига и усиление метаболизма тестостерона в печени [42, 43].
Употребление наркотиков
Употребление многочисленных рекреационных наркотиков, таких как каннабис, опиоидных наркотиков, кокаина, метамфетамина и других психостимуляторов, может оказать негативное влияние на мужскую фертильность. Эти вещества вызывают гипогонадизм за счет нарушения функционирования гипоталамо-гипофизарно-тестикулярной оси (ГГТ) [44, 45]. Каннабис — запрещенное вещество, наиболее широко используемое в рекреационных целях: до 2,5 % взрослого населения мира хотя бы эпизодически употребляют каннабис, среди них преимущественно мужчины репродуктивного возраста (~ 20 % мужчин в возрасте 26–34 лет и ~ 11 % в возрасте 35–49 лет) [46]. Каннабис модулирует биологию и репродуктивную функцию человека преимущественно через эндогенную эндоканнабиноидную систему (ЭКС), опосредованную активностью липофильных эндогенных каннабиноидов (эфир арахидоноилглицерина, иродамин, N-арахидоноилэтаноламин и 2-арахидоноилглицерин), которые действуют через каннабиноидные рецепторы CB1 и CB2. Эти рецепторы были выделены в семенниках, предстательной железе и семенных пузырьках, включая зародышевые клетки, сперматиды, зрелые сперматозоиды, клетки Сертоли и клетки Лейдига [47]. ЭКС можно модулировать с помощью потребления каннабиса, в частности, путем воздействия экзогенных каннабиноидов дельта-9-тетрагидроканнибинола (TГК) и каннабидиола, которые являются наиболее известными и изученными из более чем 130 каннабиноидов, идентифицированных в настоящее время среди всего рода Cannabis [48]. Потребление каннабиса может снизить уровень ЛГ и тестостерона при остром (менее 10 косяков в неделю) и хроническом употреблении (более 10 косяков в неделю) [48]. ТГК ингибирует синтез и высвобождение ЛГ из передней доли гипофиза, что приводит к дозозависимому гипогонадизму, который может вызывать клинические проявления, включая эректильную дисфункцию, снижение либидо и эякуляторную дисфункцию [50]. Гипогонадизм приводит к нарушению сперматогенеза, отрицательно влияющему на параметры сперматозоидов, включая концентрацию, подвижность, морфологию, жизнеспособность и повышенную концентрацию семенных лейкоцитов, наряду с нарушением капацитации, гиперактивностью, акросомальной реакцией и связыванием гемизоны [51, 52]. Приблизительно 33 % мужчин, постоянно употребляющих каннабис, страдают олигозооспермией [53]. Хроническое введение ТГК в животных моделях нарушает митотические и мейотические стадии сперматогенеза, что приводит к аномальным морфологическим формам [53]. Употребление каннабиса может дополнительно вызывать эпигенетические изменения, которые могут передаваться следующему поколению [52].
Ожирение
Взаимосвязь между ожирением и мужским бесплодием была широко исследована: более 14 000 статей посвящены изучению влияния ожирения и метаболического синдрома на мужское бесплодие [54]. Доказано, что ожирение ухудшает потенциал мужской фертильности, отрицательно влияя на качество спермы из-за гипогонадизма и увеличения температуры яичек [55, 56, 57 58]. Ожирение у женщин также коррелирует с увеличением числа осложнений беременности, повышением числа мертворождений, уменьшением эффективности ВРТ и эпигенетической передачи заболевания потомству за счет изменения уровней РНК в эякуляте, метилирования ДНК, протаминирования и ацетилирования гистонов [59, 58]. Сообщалось, что метаболический синдром, который, что важно, может включать метаболический риск независимо от ожирения, снижает параметры мужской фертильности [60]. Исследования на животных описывают приток воспалительных цитокинов и повышенную экспрессию цитокинов в тестикулярных клетках [61]. Индуцированное ожирением воспаление яичек негативно влияет на сперматогенез и стероидогенез, нарушает созревание придатка яичка, увеличивает фрагментацию ДНК и вызывает эпигенетическую модификацию [62]. Сообщается об измененной экспрессии генов антиоксидантной защиты, включая гены супероксиддисмутазы (SOD), глутатионпероксидазы (GPx) и Nrf2 [58]. Вызванные ожирением изменения в гистологии яичка включают уменьшение диаметра семенных канальцев, уменьшение числа зародышевых клеток, атрофию эпителиальных клеток, снижение баллов по шкале Джонсона, уменьшение спаек между клетками Сертоли и сперматогенными клетками и нарушение гемато-тестикулярного барьера за счет изменений экспрессии белков плотных контактов [63, 64].
Если мужчина хочет улучшить свою фертильность и качество спермы, то рекомендуется исключить сладости и сладкие газированные напитки, картофель, насыщенные жиры и трансжиры, красное мясо, прожаренное мясо, обезжиренное молоко, соевые продукты, также следует прекратить или резко уменьшить потребление алкоголя и кофеина. Потребление сладкого увеличивает риск астенозооспермии, потенциально опосредованной повышенной резистентностью к инсулину и окислительным стрессом [65]. Рафинированные сахара, содержащиеся в сладостях и продуктах с высоким содержанием углеводов, связаны со снижением концентрации сперматозоидов и нарушением их подвижности [66]. Потребление красного мяса, богатого насыщенными жирными кислотами, было связано с ухудшением параметров спермы [67] и ухудшением количества и подвижности сперматозоидов дозозависимым образом [68, 69, 70]. Повышенное потребление молочных продуктов также связано с олигоастенозооспермией и астенозооспермией, хотя рекомендуемый порог не определен [65]. Сокращение потребления фруктов и овощей, клетчатки, полиненасыщенных жирных кислот (особенно омега-3-полиненасыщенных жирных кислот) и продуктов, богатых микроэлементами, антиоксидантами и фитохимическими веществами (особенно витамином С и Е, бета-каротином, цинком, селеном, L-карнитином и ликопином) увеличивает риск плохого качества спермы [67]. Неблагоприятное питание коррелирует с повышенным тестикулярным и семенным окислительным стрессом и связанной с ним фрагментацией ДНК сперматозоидов и нарушением конденсации хроматина [71, 72, 73].
Факторы окружающей среды
Процесс сперматогенеза чувствителен к температуре, при этом оптимальная температура примерно на 2°C ниже температуры тела [74]. Повышение температуры мошонки приводит к генитальному тепловому стрессу (ГТС), нарушающему сперматогенез [74]. Профессиональные вредности, такие как высокая температура на рабочем месте (например, в стекольной, литейной и сталелитейной промышленности, в горячих кухонных цехах, в пекарнях и шахтах), могут создавать для рабочих риск теплового стресса и ГТС [75]. ГТС отрицательно коррелирует с качеством спермы и считается важной причиной мужского бесплодия [74, 76]. В настоящее время исследования предполагают, что длительное сидячее положение, высокие температуры окружающей среды в дневное время, регулярные поездки на дальние расстояния, пристрастие к частым горячим ваннам, очень тесное нижнее белье и интенсивная езда на велосипеде, размещение ноутбука или электрических гаджетов на коленях в течение долгих часов, подогрев автомобильных сидений могут вызывать снижение фертильности через ГТС [74]. Заболевания, связанные с высокой температурой мошонки и ГТС, включают крипторхизм, варикоцеле и острые и хронические воспалительные заболевания [77]. Механизм нарушений сперматогенеза, вызванных ГТС, включает индукцию окислительного стресса с высокой концентрацией активных форм кислорода (АФК) и снижением содержания антиоксидантов в половых путях и эякуляте, распад хроматина сперматозоидов, фрагментацию ДНК, дисфункцию митохондрий сперматозоидов и повышенную скорость апоптоза зародышевых клеток [74,77]. Сперматозоиды могут быть наиболее восприимчивы к повреждениям на премейотической стадии, когда хроматин остается в основном нестабильным из-за продолжающихся процессов модификации гистонов и гиперацетилирования. Этот нестабильный хроматин может легко подвергаться воздействию повышенной температуры половых органов и препятствовать конденсации хроматина сперматозоидов [78].
Воздействие неионизирующего излучения — предмет обсуждения c тех самых времен, как оно вошло в нашу жизнь. C повсеместным распространением мобильных телефонов, Wi-Fi и другой бытовой техники споры о их вреде не утихают до сих пор. Так, ряд исследований сообщает, что неионизирующее излучение может воздействовать на организм через радиочастотные источники, такие как Wi-Fi, сотовые телефоны, Bluetooth, индукционные нагреватели, высокочастотные диэлектрические инструменты, радиовещательные антенны и импульсные радары большой мощности. Согласно некоторым исследованиям, воздействие радиочастот может привести к ухудшению качества спермы за счет уменьшения объема спермы, концентрации сперматозоидов, их жизнеспособности и подвижности [79]. Поскольку регуляция температуры яичек в основном зависит от поверхностной проводимости, а не от кровотока, энергия электромагнитных больше поглощается яичками, чем любыми другими органами, что повышает температуру яичек и вызывает ГТС, влияя на сперматогенез [80]. Нетепловые эффекты, которые обсуждались в исследовании 2011 года, включают индукцию окислительного стресса и изменение потенциалов клеточных мембран, что нарушает пролиферацию зародышевых клеток и стимулирует апоптоз [81]. Это может также вызвать фрагментацию ДНК сперматозоидов и эпигенетические изменения, дегенерацию клеток Лейдига и снижение уровня тестостерона и, таким образом, нарушение поддержания сперматогенеза [81].
Стресс
Психологический стресс может быть вызван различными межличностными, социальными и средовыми факторами. Стресс потенциально повышает уровни кортизола, адреналина и норадреналина [82] и индуцирует внутриклеточные АФК, что приводит к нарушению клеточных микроструктур [83] и возникновению воспалительных реакций [82]. Под действием стресса изменяется действие глюкокортикоидов на клетки Лейдига, что подавляет синтеза андрогенов и индуцирует апоптоз [84, 85, 86]. Опосредованный 11β-гидроксистероиддегидрогеназой (11βHSD) синтез глюкокортикоидов ингибирует активность стероидогенного фермента и, таким образом, нарушает стероидогенез в клетках Лейдига [87]. Это может снизить уровень тестостерона без изменения уровня ЛГ, в то время как при хроническом стрессе ожидается снижение уровня как гонадотропинов, так и ГнРГ [88]. Это опосредовано стимуляцией адренергической системы, сужением сосудов яичек, снижением выработки тестостерона и, таким образом, нарушением сперматогенеза [89].
Влияние COVID-19 на мужскую фертильность
Во время пандемии и особенно после введения обязательной вакцинации против коронавируса, реципиенты вакцины беспокоились о том, что вакцина против SARS-CoV-2 может снизить фертильность. Влияет ли COVID-19 на мужское репродуктивное здоровье? И влияет ли вакцина COVID-19 на характеристики спермы?
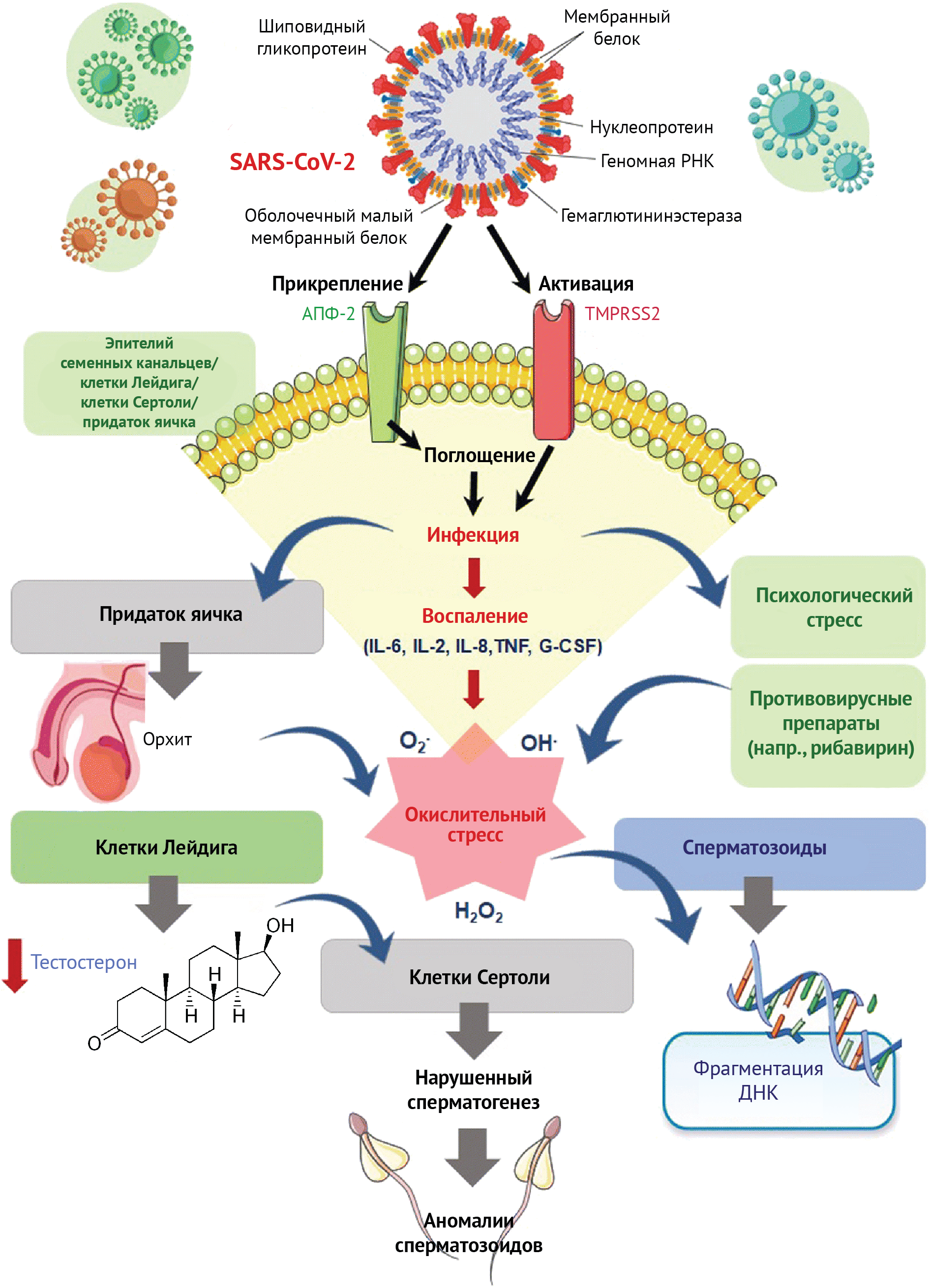
Рисунок 3 | SARS-CoV-2 и мужское бесплодие
Известно, что рецепторы ангиотензинпревращающего фермента 2 (АПФ2) играют ключевую роль в патогенезе COVID-19. Если клетки интенсивно экспрессируют АПФ2, то они могут быть мишенями и повреждаться вирусом [90]. Многие исследования показали, что высокий уровень экспрессии АПФ2 обнаруживается в клетках семявыносящих протоков, сперматогониях, клетках Лейдига и Сертоли [90, 91]. Эта экспрессия АПФ2 в клетках яичек связана с возрастом [91]: в возрасте 30 лет ее уровень выше, чем у пациентов 20 лет, тогда как у 60-летних пациентов экспрессия АПФ2 намного ниже [92]. Это может указывать на то, что молодые пациенты мужского пола подвержены более высокому риску поражения яичек при COVID-19, чем пациенты старшего возраста. Также была выдвинута гипотеза о другой возможности повреждения яичек, которая опосредована вторичной иммунологической и воспалительной реакцией, которая усиливается во время тяжелой инфекции из-за высокой вирусной нагрузки в кровотоке. Инфекция COVID-19 может также снизить мужскую фертильность за счет различных патогенных механизмов, таких как усиление окислительного стресса и усиление метилирования и фрагментации ДНК. Возможно прямое некротическое действие на клетки Лейдига и сперматоциты через АПФ2 [92]. Кроме того, сохранение высокой температуры при активной вирусной инфекции может повредить гемато-тестикулярный барьер (ГТБ), что приведет к проникновению вируса в семенные канальцы. Это подтверждает, что орхит, вызванный SARS-CoV-2, может повредить ГТБ и способствовать проникновению вируса в сперму. Таким образом, теоретически существует вероятность того, что инфекция COVID-19 может повредить клетки яичек, которые являются потенциальной мишенью для инфекции и впоследствии привести к бесплодию. Но как же все обстоит на самом деле?
В шести исследованиях изучались образцы спермы инфицированных пациентов [93, 94, 95, 96, 97]. В пяти из шести исследований, в которых приняли участие в общей сложности 82 пациента с активной или разрешающейся инфекцией, не удалось обнаружить присутствие вирусной РНК SARS-CoV-2 ни в одном из образцов спермы [93, 94, 95, 96, 97]. С другой стороны, Li с соавт. [98] протестировали образцы спермы 38 пациентов и выявили РНК SARS-CoV-2 в сперме шести пациентов (15.8 %), четыре (66.7 %) из них находились в острой стадии инфекции, а двое (33,3 %) — выздоравливали. Кроме того, авторы не обнаружили каких-либо существенных различий в клинических характеристиках (возраст, анамнез урогенитальных заболеваний) или в прогрессировании заболевания (дни с момента начала, дни с момента госпитализации или дни с момента клинического выздоровления) между пациентами с обнаруженной РНК SARS-CoV-2 в сперме и без нее [99]. Таким образом, данные от всех 120 пациентов в этих шести исследованиях показывают, что вирус обнаружен в сперме только у шести пациентов (5 %) с инфекцией COVID-19 [93, 94, 95, 96, 97].
Вирусный орхит может влиять как на сперматогенез, так и на выработку тестостерона. Вирусная инфекция ткани яичек связана с периваскулярной лимфоцитарной инфильтрацией и интерстициальным отеком, которые могут вызывать гиалинизацию семенных канальцев, фиброз и атрофию яичек [100]. В острой фазе инфекции дискомфорт в мошонке и орхидоптоз выражены в разной степени [101]. Хорошо известно, что лихорадка — распространенный симптом вирусных заболеваний, вызывает временное нарушение сперматогенеза [102]. Тем не менее, стойкое ухудшение характеристик спермы, о котором сообщалось после постпубертатного паротитного орхита, может быть связано с повреждением семенных канальцев вирусом [103].
В одном исследовании изучалось влияние вирусной инфекции SARS-CoV-2 на результаты анализа спермы [104]. Авторы сравнили обычные параметры спермы между 20 пациентами с COVID-19 (18 выздоровели, два — с активной инфекцией) и 14 здоровыми добровольцами. Пациенты были подразделены на группы легкой и средней степени тяжести в зависимости от того, требовалась ли госпитализация во время активной инфекции. У пациентов с умеренной степенью тяжести концентрация сперматозоидов, общее количество сперматозоидов в эякуляте, подвижных сперматозоидов и прогрессивно подвижных сперматозоидов было значительно ниже по сравнению с пациентами с легкой формой инфекции или с контрольной группой.
Влияние SARS-CoV-2 на мужские половые гормоны изучалось в трех исследованиях. В первом исследовании Ma с соавт. [105] сообщили о первых доказательствах связи инфекции SARS-CoV-2 с нарушениями в мужских половых гормонах в исследовании, которое не прошло рецензирование. Авторы сравнили уровень половых гормонов у 81 мужчины репродуктивного возраста при COVID-19 и у 100 здоровых мужчин. Хотя уровень сывороточного тестостерона статистически не отличался между обеими группами, у выздоровевших пациентов наблюдалось значительное повышение уровня сывороточного лютеинизирующего гормона (ЛГ) (р <0,0001) и снижение соотношения тестостерон/ЛГ (р<0,0001) и фолликулостимулирующего гормона/ЛГ (р <0,0001) по сравнению со здоровыми [105]. Линейный регрессионный анализ показал, что соотношение тестостерона и ЛГ у пациентов с COVID-19 было отрицательно связано с тяжестью заболевания (р=0,0236), концентрацией аспартаттрансаминазы (р=0,0287) и уровнями С-реактивного белка (СРБ) (р<0,0001), в то время как сообщалось о положительной связи c уровнем антимюллерова гормона в сыворотке (p= 0,0128) [105].
Во втором исследовании [106] сообщалось, что у выздоровевших пациентов с COVID-19 уровень общего тестостерона был отрицательно связан с уровнем СРБ, причем в наиболее тяжелых случаях наблюдался низкий уровень общего тестостерона. В третьем исследовании сообщалось, что у большинства мужчин с COVID-19 низкий уровень тестостерона и дигидротестостерона [107].
C вирусом все понятно, a что насчет влияния вакцинации на мужскую репродуктивную функцию? В одноцентровом проспективном исследовании в Университете Майами [108] были отобраны здоровые добровольцы в возрасте от 18 до 50 лет, которым была назначена вакцинация против COVID-19. Мужчины проходили предварительный скрининг, чтобы убедиться, что у них нет проблем с фертильностью. Участники сдали образец спермы после 2–7 дней воздержания, до получения первой дозы вакцины и примерно через 70 дней после второй. Анализы спермы проводились квалифицированными андрологами в соответствии с руководством Всемирной организации здравоохранения и включали объем спермы, концентрацию сперматозоидов, подвижность сперматозоидов и общее количество подвижных сперматозоидов (TMSC). Были включены лица с олигоспермией (концентрация сперматозоидов менее 15 млн/мл). Исходные образцы были получены после медианного периода воздержания в 2,8 дня (межквартильный размах IQR, 2-3), а последующие образцы — через медиану в 3 дня (IQR, 3-4). Из 45 мужчин 21 (46,7 %) получили вакцину BNT162b2, а 24 (53,3 %) получили вакцину мРНК-1273. Исходная медианная концентрация сперматозоидов и TMSC составили 26 млн/мл (IQR, 19,5-34) и 36 млн (IQR, 18-51) соответственно. После второй дозы вакцины средняя концентрация сперматозоидов значительно увеличилась до 30 млн/мл (IQR, 21,5-40,5; P = 0,02), а медиана TMSC — до 44 млн (IQR, 27,5-98; P = 0,001).
У восьми из 45 мужчин до вакцинации была олигоспермия (средняя концентрация, 8,5 млн / мл [IQR, 5,1-12]). Из этих 8, у 7 мужчин концентрация сперматозоидов была повышена до нормозооспермического диапазона при последующем наблюдении (медиана концентрации 22 млн/мл [IQR, 17-25,5]), а у 1 мужчины сохранялась олигоспермия. Ни у одного мужчины после вакцинации не возникло азооспермии.
Позднее отцовство
С помощью ВРТ возраст родителей больше не считается серьезным препятствием для родительства. Возраст матери является хорошо известным фактором риска неблагоприятных репродуктивных результатов, однако еще предстоит выяснить, как возраст отца влияет на потомство. Мутации de novo (MDN) в значительной степени связаны с поздним возрастом отцовства [109, 110, 111]. MDN — один из основных источников детской заболеваемости и смертности, создавая значительные социально-экономические и психологические трудности для общества. Хотя по отдельности эти нарушения встречаются редко, общая распространенность этих нарушений так же высока, как и хромосомных анеуплоидий, что указывает на растущую потребность в пренатальном скрининге. С помощью передовых репродуктивных технологий семьи с потенциальными отцами старшего и пожилого возраста имеют возможность неинвазивного пренатального тестирования (НИПТ) на множественные MDN, чувствительность и специфичность которого составляет почти 100%. Для выявления MDN было проведено полногеномное секвенирование (ПС) всех трио или квартетов родители-ребенок [112]. Для 34 из 53 трио/квартетов ПС проводили дважды, чтобы независимо обнаружить и подтвердить наличие MDN. Как и ожидалось, после поправки на метод зачатия и возраст матери наблюдался явный эффект возраста отца (модель множественной регрессии, t = 5,636, P-значение = 8,97 × 10-7), в среднем в 71 ДНК в геномах детей, рожденных от молодых отцов (менее 35 лет) и в среднем в 94 ДНК в геномах детей, рожденных от отцов старшего возраста (более 45 лет). Возраст родителей, как и риски развития MDN, увеличиваются во всем мире, поэтому комбинированный неинвазивный тест для хромосомных анеуплоидий и синдромов микроделеции, а также тесты на MDN могут стать частью рутинного ведения беременности в ближайшем будущем. Кроме того, необходимо тщательно оценить этические проблемы, связанные с внедрением этих тестов в рутинную клиническую практику [112].
Источники:
- Practice Committee of tAmerican Society for Reproductive Medicine. Definitions of infertility and recurrent pregnancy loss. Fertil Steril. 2008 Nov;90(5 Suppl):S60.
- Thonneau P, Marchand S, Tallec A, Ferial ML, Ducot B, Lansac J, Lopes P, Tabaste JM, Spira A. Incidence and main causes of infertility in a resident population (1,850,000) of three French regions (1988-1989). Hum Reprod. 1991 Jul;6(6):811-6.
- Hull MG, Glazener CM, Kelly NJ, Conway DI, Foster PA, Hinton RA, Coulson C, Lambert PA, Watt EM, Desai KM. Population study of causes, treatment, and outcome of infertility. Br Med J (Clin Res Ed) 1985 Dec 14;291(6510):1693-7.
- Shih KW, Shen PY, Wu CC, Kang YN. Testicular versus percutaneous epididymal sperm aspiration for patients with obstructive azoospermia: a systematic review and meta-analysis. Transl Androl Urol. 2019 Dec;8(6):631-640.
- Honig SC, Lipshultz LI, Jarow J. Significant medical pathology uncovered by a comprehensive male infertility evaluation. Fertil Steril. 1994 Nov;62(5):1028-34.
- Winters BR, Walsh TJ. The epidemiology of male infertility. Urol Clin North Am. 2014 Feb;41(1):195-204.
- Barak S, Baker HWG. Clinical Management of Male Infertility. Wilson DP, editors. Endotext [Internet] MDText.com, Inc.; South Dartmouth (MA): Feb 5, 2016.
- Sengupta P, Dutta S, Krajewska-Kulak E. The Disappearing Sperms: Analysis of Reports Published Between 1980 and 2015. Am J Mens Health. 2017 Jul;11(4):1279-1304.
- Carlsen E, Giwercman A, Keiding N, Skakkebaek NE. Evidence for decreasing quality of semen during past 50 years. BMJ. 1992 Sep 12;305(6854):609-13.
- Eisenberg ML, Betts P, Herder D, Lamb DJ, Lipshultz LI. Increased risk of cancer among azoospermic men. Fertil Steril. 2013 Sep;100(3):681-5.
- Petersen PM, Skakkebaek NE, Vistisen K, Rørth M, Giwercman A. Semen quality and reproductive hormones before orchiectomy in men with testicular cancer. J Clin Oncol. 1999 Mar;17(3):941-7.
- Krausz C. Male infertility: pathogenesis and clinical diagnosis. Best Pract Res Clin Endocrinol Metab. 2011 Apr;25(2):271-85.
- Lotti F, Maggi M. Ultrasound of the male genital tract in relation to male reproductive health. Hum Reprod Update. 2015 Jan-Feb;21(1):56-83.
- Poland ML, Moghissi KS, Giblin PT, Ager JW, Olson JM. Variation of semen measures within normal men. Fertil Steril. 1985 Sep;44(3):396-400.
- Snick HK, Snick TS, Evers JL, Collins JA. The spontaneous pregnancy prognosis in untreated subfertile couples: the Walcheren primary care study. Hum Reprod. 1997 Jul;12(7):1582-8.
- Rowe T. Fertility and a woman's age. J Reprod Med. 2006 Mar;51(3):157-63.
- Jones DM, Kovacs GT, Harrison L, Jennings MG, Baker HW. Immobilization of sperm by condoms and their components. Clin Reprod Fertil. 1986 Dec;4(6):367-72.
- Gottardo F, Kliesch S., World Health Organization. [Semen analysis: spermiogram according to WHO 2010 criteria]. Urologe A. 2011 Jan;50(1):101-8. [Abstract]
- Cooper TG, Noonan E, von Eckardstein S, Auger J, Baker HW, Behre HM, Haugen TB, Kruger T, Wang C, Mbizvo MT, Vogelsong KM. World Health Organization reference values for human semen characteristics. Hum Reprod Update. 2010 May-Jun;16(3):231-45. [Abstract]
- Zini A, Boman JM, Belzile E, Ciampi A. Sperm DNA damage is associated with an increased risk of pregnancy loss after IVF and ICSI: systematic review and meta-analysis. Hum Reprod. 2008 Dec;23(12):2663-8.
- Rucker GB, Mielnik A, King P, Goldstein M, Schlegel PN. Preoperative screening for genetic abnormalities in men with nonobstructive azoospermia before testicular sperm extraction. J Urol. 1998 Dec;160(6 Pt 1):2068-71.
- Jensen, T. K., Swan, S., Jørgensen, N., Toppari, J., Redmon, B., Punab, M., … Andersson, A.-M. (2014). Alcohol and male reproductive health: A cross-sectional study of 8344 healthy men from Europe and the USA. Human Reproduction, 29(8), 1801–1809.
- Sermondade, N., Faure, C., Fezeu, L., Shayeb, A. G., Bonde, J. P., Jensen, T. K., … Czernichow, S. (2012). BMI in relation to sperm count: An updated systematic review and collaborative meta-analysis. Human Reproduction Update, 19(3), 221–231.
- Li, Y., Lin, H., Li, Y., & Cao, J. (2011). Association between socio-psycho-behavioral factors and male semen quality: Systematic review and meta-analyses. Fertility and Sterility, 95(1), 116–123.
- Gaur, D. S., Talekar, M. S., & Pathak, V. P. (2010). Alcohol intake and cigarette smoking: Impact of two major lifestyle factors on male fertility. Indian Journal of Pathology and Microbiology, 53(1), 35.
- Pajarinen, J., & Karhunen, P. (1994). Spermatogenic arrest and ‘Sertoli cell-only’syndrome—Common alcohol-induced disorders of the human testis. International Journal of Andrology, 17(6), 292–299.
- Close, C. E., Roberts, P. L., & Berger, R. E. (1990). Cigarettes, alcohol and marijuana are related to pyospermia in infertile men. The Journal of Urology, 144(4), 900–903.
- Li, Y., Lin, H., Li, Y., & Cao, J. (2011). Association between socio-psycho-behavioral factors and male semen quality: Systematic review and meta-analyses. Fertility and Sterility, 95(1), 116–123.
- Penzias, A., Bendikson, K., Butts, S., Coutifaris, C., Falcone, T., Gitlin, S., … Vernon, M. (2018). Smoking and infertility: A committee opinion. Fertility and Sterility, 110(4), 611–618.
- Borgerding, M., & Klus, H. (2005). Analysis of complex mixtures–cigarette smoke. Experimental and Toxicologic Pathology, 57, 43–73.
- Penzias, A., Bendikson, K., Butts, S., Coutifaris, C., Falcone, T., Gitlin, S., … Vernon, M. (2018). Smoking and infertility: A committee opinion. Fertility and Sterility, 110(4), 611–618.
- Gaur, D. S., Talekar, M. S., & Pathak, V. P. (2010). Alcohol intake and cigarette smoking: Impact of two major lifestyle factors on male fertility. Indian Journal of Pathology and Microbiology, 53(1), 35.
- Hassan, M. A., & Killick, S. R. (2004). Negative lifestyle is associated with a significant reduction in fecundity. Fertility and Sterility, 81(2), 384–392.
- Harlev, A., Agarwal, A., Gunes, S. O., Shetty, A., & du Plessis, S. S. (2015). Smoking and male infertility: An evidence-based review. The World Journal of Men's Health, 33(3), 143–160.
- Dai, J.-B., Wang, Z.-X., & Qiao, Z.-D. (2015). The hazardous effects of tobacco smoking on male fertility. Asian Journal of Andrology, 17(6), 954
- Penzias, A., Bendikson, K., Butts, S., Coutifaris, C., Falcone, T., Gitlin, S., … Vernon, M. (2018). Smoking and infertility: A committee opinion. Fertility and Sterility, 110(4), 611–618.
- Sharma, R., Harlev, A., Agarwal, A., & Esteves, S. C. (2016). Cigarette smoking and semen quality: A new meta-analysis examining the effect of the 2010 World Health Organization laboratory methods for the examination of human semen. European Urology, 70(4), 635–645.
- Calogero, A., Polosa, R., Perdichizzi, A., Guarino, F., Vignera, S. L., Scarfia, A., … Vicari, E. (2009). Cigarette smoke extract immobilizes human spermatozoa and induces sperm apoptosis. Reproductive Biomedicine Online, 19(4), 564–571.
- Zalata, A. A., Ahmed, A. H., Allamaneni, S., Comhaire, F. H., & Agarwal, A. (2004). Relationship between acrosin activity of human spermatozoa and oxidative stress. Asian Journal of Andrology, 6(4), 313–318.
- Sharma, R., Biedenharn, K. R., Fedor, J. M., & Agarwal, A. (2013). Lifestyle factors and reproductive health: Taking control of your fertility. Reproductive Biology and Endocrinology, 11(1), 66.
- Sharma, R., Harlev, A., Agarwal, A., & Esteves, S. C. (2016). Cigarette smoking and semen quality: A new meta-analysis examining the effect of the 2010 World Health Organization laboratory methods for the examination of human semen. European Urology, 70(4), 635–645.
- Dai, J.-B., Wang, Z.-X., & Qiao, Z.-D. (2015). The hazardous effects of tobacco smoking on male fertility. Asian Journal of Andrology, 17(6), 954.
- Ghaffari, M. A., & Rostami, M. (2013). The effect of cigarette smoking on human sperm creatine kinase activity: As an ATP buffering system in sperm. International Journal of Fertility & Sterility, 6(4), 258.
- Du Plessis, S. S., Cabler, S., McAlister, D. A., Sabanegh, E., & Agarwal, A. (2010). The effect of obesity on sperm disorders and male infertility. Nature Reviews Urology, 7(3), 153.
- de Souza, G. L., & Hallak, J. (2011). Anabolic steroids and male infertility: A comprehensive review. BJU International, 108(11), 1860–1865.
- Fronczak, C. M., Kim, E. D., & Barqawi, A. B. (2012). The insults of illicit drug use on male fertility. Journal of Andrology, 33(4), 515–528.
- Du Plessis, S. S., Agarwal, A., & Syriac, A. (2015). Marijuana, phytocannabinoids, the endocannabinoid system, and male fertility. Journal of Assisted Reproduction and Genetics, 32(11), 1575–1588.
- Di Marzo, V., & Piscitelli, F. (2015). The endocannabinoid system and its modulation by phytocannabinoids. Neurotherapeutics: the Journal of the American Society for Experimental NeuroTherapeutics, 12(4), 692–698
- Du Plessis, S. S., Agarwal, A., & Syriac, A. (2015). Marijuana, phytocannabinoids, the endocannabinoid system, and male fertility. Journal of Assisted Reproduction and Genetics, 32(11), 1575–1588.
- Barazani, Y., Katz, B. F., Nagler, H. M., & Stember, D. S. (2014). Lifestyle, environment, and male reproductive health. Urologic Clinics, 41(1), 55–66.
- Close, C. E., Roberts, P. L., & Berger, R. E. (1990). Cigarettes, alcohol and marijuana are related to pyospermia in infertile men. The Journal of Urology, 144(4), 900–903
- Du Plessis, S. S., Agarwal, A., & Syriac, A. (2015). Marijuana, phytocannabinoids, the endocannabinoid system, and male fertility. Journal of Assisted Reproduction and Genetics, 32(11), 1575–1588.
- Fronczak, C. M., Kim, E. D., & Barqawi, A. B. (2012). The insults of illicit drug use on male fertility. Journal of Andrology, 33(4), 515–528.
- Baskaran, S., Agarwal, A., Leisegang, K., Peter, N. P., Selvam, M. K. P., & Henkel, R. (2019). An in-depth bibliometric analysis and current perspective on male infertility research. The World Journal of Men's Health, https://doi.org/10.5534/wjmh.180114. [Epub ahead of print].
- Bandel, I., Bungum, M., Richtoff, J., Malm, J., Axelsson, J., Pedersen, H. S., … Giwercman, A. (2015). No association between body mass index and sperm DNA integrity. Human Reproduction, 30(7), 1704–1713.
- Hammoud, A. O., Gibson, M., Peterson, C. M., Meikle, A. W., & Carrell, D. T. (2008). Impact of male obesity on infertility: A critical review of the current literature. Fertility and Sterility, 90(4), 897–904
- MacDonald, A., Herbison, G., Showell, M., & Farquhar, C. (2009). The impact of body mass index on semen parameters and reproductive hormones in human males: A systematic review with meta-analysis. Human Reproduction Update, 16(3), 293–311.
- Palmer, N. O., Bakos, H. W., Fullston, T., & Lane, M. (2012). Impact of obesity on male fertility, sperm function and molecular composition. Spermatogenesis, 2(4), 253–263.
- Davidson, L. M., Millar, K., Jones, C., Fatum, M., & Coward, K. (2015). Deleterious effects of obesity upon the hormonal and molecular mechanisms controlling spermatogenesis and male fertility. Human Fertility, 18(3), 184–193.
- Leisegang, K., Bouic, P. J., & Henkel, R. R. (2016). Metabolic syndrome is associated with increased seminal inflammatory cytokines and reproductive dysfunction in a case-controlled male cohort. American Journal of Reproductive Immunology, 76(2), 155–163
- Salas-Huetos, A., Bulló, M., & Salas-Salvadó, J. (2017). Dietary patterns, foods and nutrients in male fertility parameters and fecundability: A systematic review of observational studies. Human Reproduction Update, 23(4), 371–389
- Yildirim, O. G., Sumlu, E., Aslan, E., Koca, H. B., Pektas, M. B., Sadi, G., & Akar, F. (2019). High-fructose in drinking water initiates activation of inflammatory cytokines and testicular degeneration in rat. Toxicology Mechanisms and Methods, 29(3), 224–232
- Demirci, T., & Sahin, E. (2019). The effect of chronic stress and obesity on sperm quality and testis histology in male rats; a morphometric and immunohistochemical study. Histology and Histopathology, 34(3), 287–302.
- Yang, X.-Y., Gu, Y.-J., An, T., Liu, J.-X., Pan, Y.-Y., Mo, F.-F., … Jiang, G.- J. (2018). Proteomics analysis of testis of rats fed a high-fat diet. Cellular Physiology and Biochemistry, 47(1), 378–389.
- Oostingh, E. C., Steegers-Theunissen, R. P., de Vries, J. H., Laven, J. S., & Koster, M. P. (2017). Strong adherence to a healthy dietary pattern is associated with better semen quality, especially in men with poor semen quality. Fertility and Sterility, 107(4), 916–923. e912
- Attaman, J. A., Toth, T. L., Furtado, J., Campos, H., Hauser, R., & Chavarro, J. E. (2012). Dietary fat and semen quality among men attending a fertility clinic. Human Reproduction, 27(5), 1466–1474.
- Giahi, L., Mohammadmoradi, S., Javidan, A., & Sadeghi, M. R. (2015). Nutritional modifications in male infertility: A systematic review covering 2 decades. Nutrition Reviews, 74(2), 118–130.
- Gaskins, A. J., Colaci, D. S., Mendiola, J., Swan, S. H., & Chavarro, J. E. (2012). Dietary patterns and semen quality in young men. Human Reproduction, 27(10), 2899–2907
- Jensen, T. K., Heitmann, B. L., Jensen, M. B., Halldorsson, T. I., Andersson, A.-M., Skakkebæk, N. E., … Jørgensen, N. (2012). High dietary intake of saturated fat is associated with reduced semen quality among 701 young Danish men from the general population. The American Journal of Clinical Nutrition, 97(2), 411–418.
- Mendiola, J., Torres-Cantero, A. M., Moreno-Grau, J. M., Ten, J., Roca, M., Moreno-Grau, S., & Bernabeu, R. (2009). Food intake and its relationship with semen quality: A case-control study. Fertility and Sterility, 91(3), 812–818.
- Siddeek, B., Mauduit, C., Simeoni, U., & Benahmed, M. (2018). Sperm epigenome as a marker of environmental exposure and lifestyle, at the origin of diseases inheritance. Mutation Research/Reviews in Mutation Research, 778, 38–44.
- Soubry, A. (2015). Epigenetic inheritance and evolution: A paternal perspective on dietary influences. Progress in Biophysics and Molecular Biology, 118(1–2), 79–85.
- Vujkovic, M., de Vries, J. H., Dohle, G. R., Bonsel, G. J., Lindemans, J., Macklon, N. S., … Steegers-Theunissen, R. (2009). Associations between dietary patterns and semen quality in men undergoing IVF/ ICSI treatment. Human Reproduction, 24(6), 1304–1312.
- Durairajanayagam, D., Agarwal, A., & Ong, C. (2015). Causes, effects and molecular mechanisms of testicular heat stress. Reproductive Biomedicine Online, 30(1), 14–27.
- Epstein, Y., & Moran, D. S. (2006). Thermal comfort and the heat stress indices. Industrial Health, 44(3), 388–398.
- Hamerezaee, M., Dehghan, S. F., Golbabaei, F., Fathi, A., Barzegar, L., & Heidarnejad, N. (2018). Assessment of semen quality among workers exposed to heat stress: A cross-sectional study in a steel industry. Safety and Health at Work, 9(2), 232–235.
- Durairajanayagam, D., Sharma, R. K., du Plessis, S. S., & Agarwal, A. (2014). Testicular heat stress and sperm quality. In Male infertility (pp. 105–125). Berlin, Gemany: Springer Science+Business Media.
- Mima, M., Greenwald, D., & Ohlander, S. (2018). Environmental toxins and male fertility. Current Urology Reports, 19(7), 50
- Deepinder, F., Makker, K., & Agarwal, A. (2007). Cell phones and male infertility: Dissecting the relationship. Reproductive Biomedicine Online, 15(3), 266–270.
- Wallach, E. E., Kandeel, F. R., & Swerdloff, R. S. (1988). Role of temperature in regulation of spermatogenesis and the use of heating as a method for contraception. Fertility and Sterility, 49(1), 1–23.
- Hamada, A. J., Singh, A., & Agarwal, A. (2011). Cell phones and their impact on male fertility: Fact or fiction. The Open Reproductive Science Journal, 5(4), 125–137.
- Flaherty, R. L., Owen, M., Fagan-Murphy, A., Intabli, H., Healy, D., Patel, A., … Flint, M. S. (2017). Glucocorticoids induce production of reactive oxygen species/reactive nitrogen species and DNA damage through an iNOS mediated pathway in breast cancer. Breast Cancer Research, 19(1), 35.
- Dutta, S., Henkel, R., Sengupta, P., & Agarwal, A. (2020). Physiological role of ROS in sperm function. In S. J. Parekattil, S. C. Esteves, & A. Agarwal (Eds.), Male infertility: Contemporary clinical approaches, Andrology, ART and antioxidants, Vol. 2 (pp. 337–345). Cham, Switzerland: Springer.
- Hardy, M. P., Gao, H.-B., Dong, Q., Ge, R., Wang, Q., Chai, W. R., … Sottas, C. (2005). Stress hormone and male reproductive function. Cell and Tissue Research, 322(1), 147–153.
- Ikeda, M., Kodama, H., Fukuda, J., Shimizu, Y., Murata, M., Kumagai, J., & Tanaka, T. (1999). Role of radical oxygen species in rat testicular germ cell apoptosis induced by heat stress. Biology of Reproduction, 61(2), 393–399
- Maneesh, M., & Jayalekshmi, H. (2006). Role of reactive oxygen species and antioxidants on pathophysiology of male reproduction. Indian Journal of Clinical Biochemistry, 21(2), 80–89.
- MacADAMS, M. R., White, R. H., & Chipps, B. E. (1986). Reduction of serum testosterone levels during chronic glucocorticoid therapy. Annals of Internal Medicine, 104(5), 648–651.
Wagenmaker, E. R., Breen, K. M., Oakley, A. E., Tilbrook, A. J., & Karsch, F. J. (2009). Psychosocial stress inhibits amplitude of gonadotropin-releasing hormone pulses independent of cortisol action on the type II glucocorticoid receptor. Endocrinology, 150(2), 762–769. - Pook, M., Tuschen-Caffier, B., Kubek, J., Schill, W. B., & Krause, W. (2005). Personality, coping and sperm count. Andrologia, 37(1), 29–35.
- Fan,C., Li,K., Ding,Y., Lu,W. & Wang J.ACE2 expression inkidney and testis may cause kidney and testis damage after 2019-nCoV infection, medRxivdoi: https://doi.org/10.1101/2020.0... (2020).
- Shen,Q., Xiao,X., Aierken,A., Liao,M. & Hua J. The ACE2expression in Sertoli cells and germ cells may cause male reproductive disorder after SARS-CoV-2 infection. https://doi.org/10.1111/jcmm.1... (2020).
- Doring,N. How is the COVID-19 pandemic affecting our sexualities? An overview of the current media narratives and research hypotheses. Arch. Sex Behav.49(8):1–14(2020).
- Pan F, Xiao X, Guo J, Song Y, Li H, Patel DP, et al. No evidence of severe acute respiratory syndrome-coronavirus 2 in semen of males recovering from coronavirus disease 2019. Fertil Steril. 2020;113:1135–1139.
- Song C, Wang Y, Li W, Hu B, Chen G, Xia P, et al. Absence of 2019 novel coronavirus in semen and testes of COVID-19 patients. Biol Reprod. 2020;103:4–6.
- Holtmann N, Edimiris P, Andree M, Doehmen C, Baston-Buest D, Adams O, et al. Assessment of SARS-CoV-2 in human semen-a cohort study. Fertil Steril. 2020 doi: 10.1016/j.fertnstert.2020.05.028.
- Paoli D, Pallotti F, Colangelo S, Basilico F, Mazzuti L, Turriziani O, et al. Study of SARS-CoV-2 in semen and urine samples of a volunteer with positive naso-pharyngeal swab. J Endocrinol Invest. 2020 doi: 10.1007/s40618-020-01261-1.
- Ning J, Li W, Ruan Y, Xia Y, Wu X, Hu K, et al. Effects of 2019 novel coronavirus on male reproductive system: a retrospective study. Preprints. 2020
- Li D, Jin M, Bao P, Zhao W, Zhang S. Clinical characteristics and results of semen tests among men with coronavirus disease 2019. JAMA Netw Open. 2020;3:e208292.
- Paoli D, Pallotti F, Colangelo S, Basilico F, Mazzuti L, Turriziani O, et al. Study of SARS-CoV-2 in semen and urine samples of a volunteer with positive naso-pharyngeal swab. J Endocrinol Invest. 2020 doi: 10.1007/s40618-020-01261-1.
- Lane TM, Hines J. The management of mumps orchitis. BJU Int. 2006;97:1–2.
- Teelin KL, Babu TM, Urban MA. Prostatitis, epididymitis, and orchitis: acute scrotal pain. In: Domachowske J, editor. Introduction to clinical infectious diseases. Cham: Springer; 2019. pp. 191–198.
- Carlsen E, Andersson AM, Petersen JH, Skakkebaek NE. History of febrile illness and variation in semen quality. Hum Reprod. 2003;18:2089–2092
- Masarani M, Wazait H, Dinneen M. Mumps orchitis. J R Soc Med. 2006;99:573–575.
- Holtmann N, Edimiris P, Andree M, Doehmen C, Baston-Buest D, Adams O, et al. Assessment of SARS-CoV-2 in human semen-a cohort study. Fertil Steril. 2020 doi: 10.1016/j.fertnstert.2020.05.028.
- Ma L, Xie W, Li D, Shi L, Mao Y, Xiong Y, et al. Effect of SARS-CoV-2 infection upon male gonadal function: a single center-based study. medRxiv. 2020 doi: 10.1101/2020.03.21.20037267.
- Rastrelli G, Di Stasi V, Inglese F, Beccaria M, Garuti M, Di Costanzo D, et al. Low testosterone levels predict clinical adverse outcomes in SARS-CoV-2 pneumonia patients. Andrology. 2020 doi: 10.1111/andr.12821.
- Schroeder M, Tuku B, Jarczak D, Nierhaus A, Bai T, Jacobsen H, et al. The majority of male patients with COVID-19 present low testosterone levels on admission to intensive care in
- Hamburg, Germany: a retrospective cohort study. medRxiv. 2020 doi: 10.1101/2020.05.07.20073817.
- Gonzalez DC, Nassau DE, Khodamoradi K, et al. Sperm Parameters Before and After COVID-19 mRNA Vaccination. JAMA. 2021;326(3):273–274. doi:10.1001/jama.2021.9976
- Catford SR, McLachlan RI, O'Bryan MK, Halliday JL. Long-term follow-up of ICSI-conceived offspring compared with spontaneously conceived offspring: a systematic review of health outcomes beyond the neonatal period. Andrology 2018;6:635–653.
- Pastuszak AW, Herati AS, Eisenberg ML, Cengiz C, Langlois PH, Kohn TP, Lamb DJ, Lipshultz LI. The risk of birth defects is not associated with semen parameters or mode of conception in offspring of men visiting a reproductive health clinic. Hum Reprod 2019;34:733–739.
- Zhytnik L, Peters M, Tilk K, Simm K, Tõnisson N, Reimand T, Maasalu K, Acharya G, Krjutškov K, Salumets A. From late fatherhood to prenatal screening of monogenic disorders: evidence and ethical concerns. Hum Reprod Update. 2021 Oct 18;27(6):1056-1085. doi: 10.1093/humupd/dmab023. PMID: 34329448.
- R M Smits, M J Xavier, M S Oud, G D N Astuti, A M Meijerink, P F de Vries, G S Holt, B K S Alobaidi, L E Batty, G Khazeeva, K Sablauskas, L E L M Vissers, C Gilissen, K Fleischer, D D M Braat, L Ramos, J A Veltman, De novo mutations in children born after medical assisted reproduction, Human Reproduction, Volume 37, Issue 6, June 2022, Pages 1360–1369, https://doi.org/10.1093/humrep...
