Разнообразие сарком Капоши. Часть 3: посттрансплантационная и ВИЧ-ассоциированная саркомы Капоши

В прошлых статьях мы рассмотрели две формы саркомы Капоши: классическую и эндемическую. Для России данные заболевания не характерны, а потому российский врач может за всю свою деятельность никогда не столкнуться с этими патологиями. В третьей, заключительной, статье цикла речь пойдет о тех видах сарком Капоши, которые распространены повсеместно.
Посттрансплантационная (ятрогенная) саркома Капоши
Данная форма СК, как и другие рассматриваемые формы в этой статье, развивается на фоне приобретенного иммунодефицита. После трансплантации обычно пациент получает иммуносупрессивную терапию, что в свою очередь может провоцировать самые разнообразные патологии, одной из которых является ПСК [1].
Иногда бывает трудно диагностировать ПСК; основным критерием является наличие саркомы Капоши при отсутствии антител к ВИЧ. С другой стороны, если во время гемотрансфузии или трансплантации произошло заражение вирусом иммунодефицита и впоследствии возникла СК, то вряд ли можно отличить одну форму саркомы от другой [1].
Принято считать, что подавляющее большинство посттрансплантационных сарком Капоши принимают кожную форму, гораздо реже процесс затрагивает внутренние органы. Наибольший риск — в первые 2 года после трансплантации [2].
Клиника, морфология сакром Капоши не отличается от таковых, рассмотренных в прошлых частях. Таким образом, для ПСК характерны те же проявления в виде узелков или бляшек (диффузные или диссеминированные формы практически никогда не развиваются, поскольку пациент постоянно находится под присмотром медперсонала). Однако подход к лечению ПСК существенно отличается.
В отличие от рассмотренных ранее форм сарком Капоши, где терапия подбиралась практически наугад, лечение ПСК обладает гораздо более убедительной доказательной базой (хотя отсутствие гайдлайнов ощущается).
Существует достаточно эффективный (и общепризнанный) подход к лечению ПСК — терапия сиролимусом. Сиролимус (или рапамицин) — иммунодепрессант, который обладает доказанной эффективностью при трансплантации почки и активно применяется в этой области [3], а также способен устранять ПСК. В своем исследовании [4] авторы описали лечение 15 пациентов, у которых после пересадки кадаверной почки обнаружились узлы саркомы Капоши (анализ на ВИЧ — отрицательный).
Для достижения иммуносупрессии пациенты принимали циклоспорин и микофенолата мофетил. После диагностирования ПСК прием препаратов был прекращен, вместо них был назначен сиролимус. Спустя три месяца обнаружилось, что кожные узлы СК исчезли у всех пациентов, через шесть месяцев была достигнута стойкая ремиссия.
К похожим результатам пришли и другие исследователи [5–7]. В одной из публикаций сообщается, что при увеличении дозы сиролимуса произошел рецидив ПСК, после снижения дозы до обычной терапевтической (1–2 мг/день) вновь наступила ремиссия. Вследствие этого авторы пришли к выводу, что выздоровление произошло из-за более слабой депрессии иммунитета сиролимусом (в сравнении с другими иммунодепрессантами), а не с непосредственным противоопухолевым действием препарата [8]. Так или иначе, сиролимус является достаточно эффективным средством против ПСК.
Эпидемическая саркома Капоши (ВИЧ-ассоциированная)
И, наконец, последняя разновидность саркомы Капоши — эпидемическая (ЭСК) или ВИЧ-ассоциированная. Данная форма СК получила наибольшую «славу» на волне угрожающего распространения ВИЧ-инфекции, которая в ряде стран принимает вид полноценной эпидемии.
Перед описанием ЭСК следует уточнить: вирус иммунодефицита способен провоцировать не только саркому Капоши. Приобретенный иммунодефицит позволяет достаточно вольготно реплицироваться онкогенным вирусам, а также значительно снижает иммунный надзор над пролиферирующими клетками [9]. Тем не менее наиболее частой неоплазией на фоне ВИЧ-инфекции является именно саркома Капоши.
В 1981 году в США среди пациентов с синдромом приобретенного иммунодефицита в 40 % случаев выявлялась саркома Капоши; в 1992 году этот показатель упал до 20 % [1]. Позднее было выявлено значительное снижение случаев развития СК среди европейского населения (за период 1994–2003 гг.), причем саркомы не обнаруживались у людей с достаточным уровнем CD4+ клеток [10].
Однако не ВИЧ является причиной развития саркомы Капоши. В 1994 году Чанг с коллегами обнаружили в узлах саркомы (биоптат был получен от пациента со СПИДом) неизвестный в то время вирус (рис. 1), который исследователи отнесли к семейству гамма-герпесвирусов [11]. Ученые назвали его «вирусом герпеса, ассоциированным с саркомой Капоши» (KSHV — Kaposi sarcoma-associated herpesvirus); оказалось, что KSHV обнаруживается в 95 % случаях сарком Капоши [1].
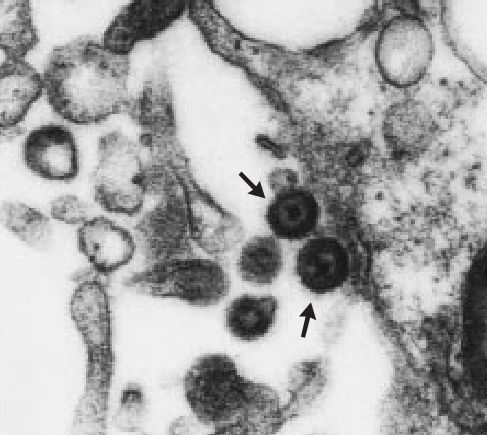
Рисунок 1 | Электронная микрофотография, на которой видны вирионы KSHV (обозначено стрелками), ×36,000 [1].
Открытие оказалось крайне важным: сейчас мы знаем, что KSHV сосуществовал вместе с человеком уже очень давно, однако мог стать патогенным лишь несколько тысячелетий назад [1]. По современным данным, данный вирус ассоциирован с саркомой Капоши, мультицентрическим вариантом болезни Кастельмана и первичной выпотной лимфомой [9].
Вирус использует множество различных факторов, которые позволяют ему оставаться в организме человека и реплицироваться, ускользая от иммунного надзора. К слову, имеются данные, что в развитии посттрансплантационной саркомы Капоши также принимает участие KSHV [2].
Гистология
Морфологически достаточно сложно дифференцировать эпидемическую саркому Капоши от прочих. Заподозрить ЭСК можно по следующим признакам:
– увеличение клеток с эксцентрично расположенным ядром;
– расширенные васкуляризованные пространства в верхней порции дермы;
– поверхностная, перифокальная лимфоплазмоцитарная инфильтрация [12].
Однако вне зависимости от нюансов гистологической картины, патологоанатомом
будет рекомендовано исключить ВИЧ-инфекцию.
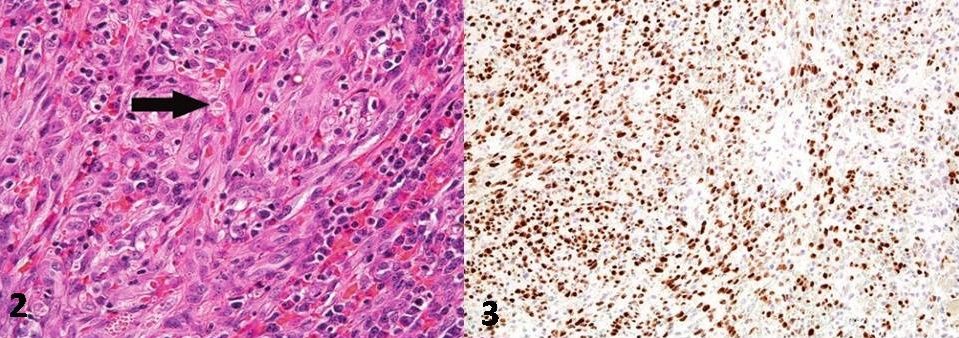
Рисунок 2 | Саркома Капоши с хроническим воспалением. Определяются редкие эозинофильные инфильтраты (обозначено стрелкой).
Рисунок 3 | Эндотелиоциты саркомы Капоши положительны на LANA-1 герпесвируса-8 (latency-associated nuclear antigen-1 — связанный с латентностью ядерный антиген). Иммуногистохимическая микроскопия. («Soft tissue pathology», Kyle Perry, 2017, p. 142).
Лечение
Основная причина смерти при ВИЧ-ассоциированной саркоме Капоши — оппортунистические инфекции (то есть на первый план все равно выходит иммунодефицитное состояние). Самое приятное в этом моменте — все осложнения ВИЧ-инфекции (включая саркому Капоши) удается устранить с помощью высокоактивной антиретровирусной терапии (ВААРТ) [1]. Поэтому неагрессивные формы ЭСК не нуждаются в специфическом лечении.
Однако встречаются и тяжелые, прогрессирующие, инфильтративные формы ЭСК. В таком случае наиболее эффективным будет сочетание ВААРТ с системной химиотерапией [13]. Также возможно применение поверхностной радиотерапии при кожных формах ЭСК [14].
Источники:
1. K. Antman and Y. Chang, «Kaposi’s Sarcoma», N. Engl. J. Med., vol. 342, no. 14, pp. 1027–1038, 2000.
2. S. M. Mbulaiteye and E. A. Engels, «Kaposi’s sarcoma risk among transplant recipients in the United States (1993-2003)», Int. J. Cancer, vol. 119, no. 11, pp. 2685–2691, 2006.
3. W. A.C., L. V.W., C. J.R., and C. J.C., «Target of rapamycin inhibitors ({TOR-I;} sirolimus and everolimus) for primary immunosuppression in kidney transplant recipients», Cochrane database Syst. Rev., no. 2, 2006.
4. G. Stallone et al., «Sirolimus for Kaposi’s Sarcoma in Renal-Transplant Recipients», N. Engl. J. Med., vol. 352, no. 13, pp. 1317–1323, 2005.
5. S. C. Zmonarski, M. Boratyńska, J. Rabczyński, K. Kazimierczak, and M. Klinger, «Regression of Kaposi’s sarcoma in renal graft recipients after conversion to sirolimus treatment», Transplant. Proc., vol. 37, no. 2, pp. 964–966, 2005.
6. J. M. Campistol, A. Gutierrez-Dalmau, and J. V. Torregrosa, «Conversion to sirolimus: A successful treatment for posttransplantation Kaposi’s sarcoma», Transplantation, vol. 77, no. 5, pp. 760–762, 2004.
7. A. Gutiérrez-Dalmau et al., «Efficacy of conversion to sirolimus in posttransplantation Kaposi’s sarcoma», Transplant. Proc., vol. 37, no. 9, pp. 3836–3838, 2005.
8. M. Boratyńska, S. C. Zmonarski, and M. Klinger, «Reccurence of Kaposi’s sarcoma after increased exposure to sirolimus», Int. Immunopharmacol., vol. 6, no. 13–14, pp. 2018–2022, 2006.
9. V. Bouvard et al., «A review of human carcinogens--Part B: biological agents», Lancet. Oncol., vol. 10, no. 4, pp. 321–2, 2009.
10. A. Mocroft et al., «The changing pattern of Kaposi sarcoma in patients with HIV, 1994-2003: The EuroSIDA study», Cancer, vol. 100, no. 12, pp. 2644–2654, 2004.
11. Y. Chang et al., «Identification of Herpesvirus-Like DNA Sequences in AIDS-Associated Kaposi’s Sarcoma», Science (80-. )., vol. 266, no. December, pp. 1865–1869, 1994.
12. F. M. Buonaguro et al., «Kaposi’s sarcoma: Aetiopathogenesis, histology and clinical features», J. Eur. Acad. Dermatology Venereol., vol. 17, no. 2, pp. 138–154, 2003.
13. F. G. Oluwatoyin, I. O. Charles, D. Martin, and E. F. Esther, «Treatment of severe or progressive Kaposi’s sarcoma in HIV-infected adults», Cochrane Database Syst. Rev., no. 9, 2014.
14. M. S. Nestor et al., «Consensus Guidelines on the Use of Superficial Radiation Therapy for Treating Nonmelanoma Skin Cancers and Keloids», J. Clin. Aesthet. Dermatol., vol. 12, no. 2, pp. 12–18, 2019.
