Акардия: братские узы

Введение
Зарождение жизни — это всегда очень захватывающий процесс. Недаром все мировые религии и более-менее серьезные философские учения сравнивали человека с микрокосмом по аналогии с макрокосмом — вселенной. Однако даже если во вселенной есть воля случая, то тем более от нее не застрахован человек, обреченный в поте лица добывать хлеб и в мучении рождать детей. И если одни случайности полезны — например, мутагенез в Т-клеточном рецепторе или в антителах, а другие — являются данностью и не сильно мешают нам жить, как цвет глаз или предрасположенность к облысению, то третьи случайности приносят нам неудобства и опасности.
Беременность двойней — это случайность. Не в наш век продвинутых технологий, повышающих шанс на двойню, правда, но все же. Однако не всегда эта случайность может быть хорошей. По славной традиции, заложенной Каином и Авелем, Иаковом и Исавом, один близнец пытается убить другого, даже не выйдя из утробы матери. Такое явление ученые назвали ишиопаг, или близнец-паразит. Близнец-паразит не способен жить самостоятельно, поэтому, как правило, рождается уже мертвым, но до родов он получает питание за счет здорового близнеца, попутно доставляя ему неприятности, вплоть до риска мертворождения.
▶ Читайте также: Вспомогательные репродуктивные технологии
Наиболее редкая форма ишиопага — это акардия, когда здоровый близнец то ли был вынужден поставлять кислород и питательные вещества менее способному сородичу, то ли, наоборот, победил его и «накормил до смерти». Но обо всем по порядку.
Историческая справка
«Четвертого декабря 1551 года, в пятницу… родились трое детей… Один из них был маленьким мальчиком, который умер вскоре после крещения… Изображенный здесь третий имел удивительно редкую и устрашающую форму. Ибо у него не было ни головы, ни рук, можно было различить только туловище и ступни. Это был мертворожденный ребенок. Поскольку такие устрашающие чудовища без сомнения указывают на гнев Бога, весь христианский люд должен каяться и молиться… чтобы предотвратить наказание».
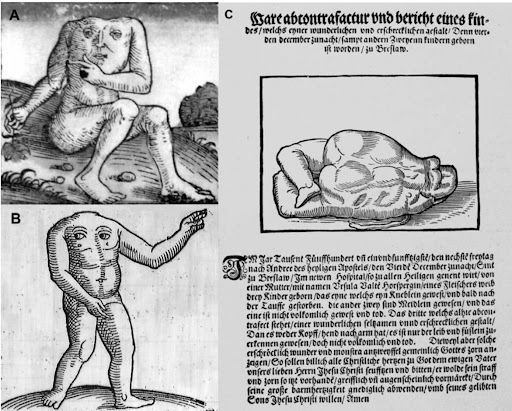
Это, пожалуй, первое свидетельство касательно акардических новорожденных в Европе. Хотя мир сталкивался с подобными феноменами и раньше, именно в Средние века и во времена Ренессанса, с развитием печатного дела и какой-никакой прессы, такие сообщения стали распространятся и получать огласку.
Неонатальные патологии, в частности акардические новорожденные, известны с древности. Так, свидетельства об этом встречаются и в Талмуде (III–V век), и у Геродота (V век), и в других средневековых европейских источниках. В одних источниках отмечалось, что это мертворожденные дети, в других же, как у Геродота, подчеркивалась жизнеспособность подобных объектов [3].
Почти каждый деформированный выкидыш тогда называли moon-calf, подразумевая негативное влияние Луны на беременность. Наиболее известный пример moon-calf — персонаж Калибан, уродливый слуга герцога Просперо из пьесы Шекспира «Буря». Однако безголовый плод был из ряда вон выходящим событием.
Несмотря на то, что акардия — довольно редкая патология, народная молва и мистический ужас перед безголовыми младенцами сильно раздули проблему, поэтому священник и врач Франческо Кангиамило постановил в 1745 году, что подобных новорожденных, не имеющих головы, не нужно крестить, так как у них нет души, которая, «как всем известно, в мозгу». Кангиамило не был первым, потому как еще Аристотель связывал человеческую душу с когнитивными процессами. Таким образом, можно сделать вывод, что с акардией человечество было знакомо давно.
Источник: видео Twin to twin transfusion syndrome (TTTS)
Но несмотря на такое давнее знакомство, только в 1812 году врач Иоганн Фридрих Меккель-младший пришел к выводу, что акардия каким-то образом связана с близнецами, но как именно, он так и не понял. Лишь его племянник, Генрих, 38 лет спустя смог объяснить патогенез акардии, тогда как народ и некоторые ученые связывали рождение безголового плода с тем, что беременная женщина наблюдала, как приговоренному отрубали голову.
Патогенез и классификация
Со времен Меккеля нам известно, что акардия — это патология, встречающаяся у моноплацентарных близнецов. Другое название — TRAP, twin reversed arterial perfusion, или синдром близнецовой ретроградной артериальной перфузии. Здоровый близнец «накачивает» своего менее удачливого брата дезоксигенированной кровью, от чего тот и становится акардическим. Но каков патогенез этого явления? Почему вдруг здоровый эмбрион перекачивает кровь не обратно в плаценту, а в другого близнеца?
На данный момент известны две гипотезы, и обе связаны с артерио-артериальными анастомозами [2, 6].
Первая гипотеза связывает явление с артерио-артериальным анастомозом между близнецами. Напомним кровоснабжение нормального плода, чтобы понять патогенез акардии в данном случае.
Начинается плацентарное кровообращение с входящей в состав пупочного канатика пупочной вены, которая впадает в печень. Из органа кровь поступает в венозный проток, сообщающийся с нижней полой веной. По нижней полой вене богатая кислородом кровь попадает в правое предсердие, откуда через овальное окно попадает последовательно в правое предсердие и правый желудочек, откуда уже через аорту доставляется во все органы. Отток дезоксигенированной крови происходит через пупочные артерии, тоже входящие в состав пупочного канатика.
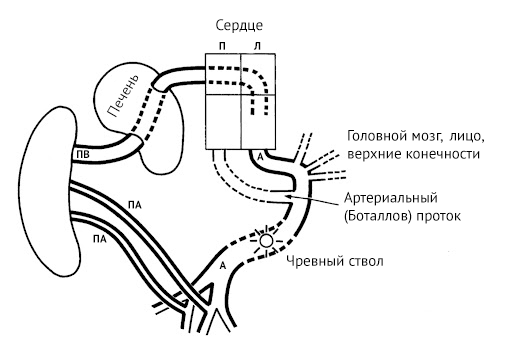
Источник: Giménez-Scherer JA, Davies BR. Malformations in acardiac twins are consistent with reversed blood flow: liver as a clue to their pathogenesis. Pediatr Dev Pathol, 2003.
Все это происходит при нормальных условиях. Однако если наблюдается анастомоз между пупочными артериями, что может быть у одноплацентарных близнецов, то часть дезоксигенированной крови может перекачиваться от одного близнеца к другому через подвздошные артерии и аорту обратно в сердце, которое со временем атрофируется из-за невозможности справиться с нагрузкой. Перераспределение кровотока между плодами из-за наличия анастомозов приводит к относительному снижению давления в артериальной системе одного из плодов, вплоть до полного изменения в ней направления потока крови.
Первая гипотеза объясняет, почему нижние конечности у акардического близнеца развиты лучше, чем верхние: частично оксигенированная кровь идет по подвздошным артериям по обратному пути [7]. И напротив, низкое давление в ретроградно кровоснабжаемой верхней части тела и низкое насыщение кислородом ухудшают развитие этой области.
В пользу этой гипотезы говорят данные о том, что при уменьшении площади плаценты или снижении кровенаполнения ее сосудов кардиомиоциты развиваются намного медленнее, чем в норме [1].
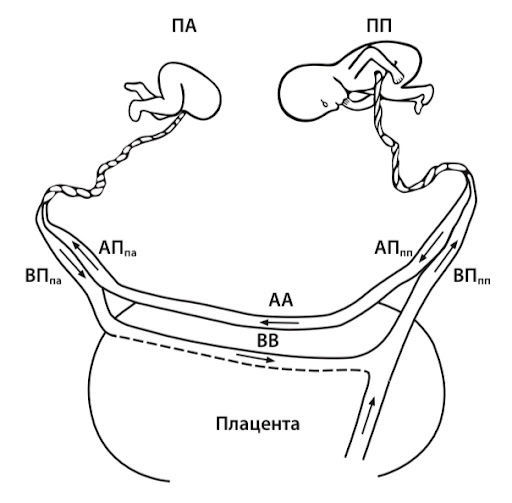
Источник: Михайлов А.В с соавт. Синдром обратной артериальной перфузии: патофизиологические аспекты и принципы диагностики. Таврический медико-биологический вестник, 2018.
Другая гипотеза связывает акардию с врожденными патологиями сердца. В отличие от первой гипотезы, где сердце атрофируется в результате ретроградного тока, эта гипотеза утверждает, что именно пороки сердца в эмбриогенезе дают возможность обратной перфузии, а не наоборот, хотя дальнейшее описание патогенеза мало чем отличается. Из-за пороков сердца давление в пупочной артерии акардического близнеца ниже, чем у здорового (называемого насосным), что и приводит к обратной перфузии. Если кровяное давление здорового близнеца превышает систолическое желудочковое давление близнеца с пороком сердца, сердце второго не может перекачивать кровь в достаточном объеме и атрофируется [7]. Во второй гипотезе акардический близнец не жертва со стороны своего собрата по утробе, а скорее паразит, использующий анастомозы для частичного выживания.
Несмотря на то, что исследователи находят у акардических близнецов кариотипы, отличные от здоровых близнецов, этиология таких отличий в геноме остается не до конца ясной, чтобы делать какие-то выводы касательно верности одной из двух вышеуказанных гипотез.
Таким образом, для формирования синдрома обратной артериальной перфузии необходимо выполнение следующих условий:
- наличие сосудистого артерио-артериального анастомоза между артериями пуповины двух плодов;
- относительный градиент давления крови в артериальных системах гемоциркуляции на ранних этапах эмбрионального развития монохориальной многоплодной беременности.
Помимо наличия двух гипотез, которые основаны на сходном наборе данных и приводят к диаметрально противоположным выводам о причинах развития такой патологии, акардия поражает нас еще и большим выбором вариантов, словно мы оказались в патологическом гастрономе [2].
Так, среди акардических близнецов есть ацефалы, не имеющие головы, но у них могут быть сформированы конечности. Органы грудной клетки у таких близнецов обычно отсутствуют, и их место занимают аморфные ткани. Это, пожалуй, самый распространенный тип акардических близнецов.
Если этого недостаточно, то природа может предоставить анцепсов, имеющих большинство частей тела, пусть и плохо сформированных, или акормусов, представляющих одну голову с пуповиной. Если и этого покажется мало, то есть и аморфусы, крайне редкая форма акардического близнеца. Как следует из названия, такой близнец напоминает скорее аморфный кусок тканей с кровеносными сосудами, а не что-то человеческое.
Синдром фето-фетальной трансфузии
Говоря о патогенезе, стоит ответить на вопрос: какую роль играет плацента в развитии сердца плода? Плацента, как всем известно, очень важный орган в эмбриогенезе. Именно плацента является поставщиком кислорода и питательных веществ для эмбриона и барьером для ксенобиотиков. А поскольку экспрессия генов в эмбриогенезе — очень чувствительный и тонкий процесс, именно плацента может влиять на дифференцировку кардиомиоцитов и морфогенез сердца [8].
В течение первых недель беременности спиральные артерии матери, которые в конечном итоге будут кровоснабжать плаценту, претерпевают сильные изменения, которые включает потерю эластина и утрату активности (или полную атрофию) гладких миоцитов из их стенок и расширение конечных сегментов, которые открываются в межворсинчатое пространство. С нарушением перестройки сосудов связывают такие патологии, как преэклампсия, преждевременные роды или выкидыши.
Когда речь заходит о близнецах, все немного иначе. Так как акардия в основном встречается у монозиготных близнецов, то в этиологии пороков сердца также есть две гипотезы [5]. Одна из гипотез утверждает о взаимосвязи между процессом разделения близнецов в эмбриогенезе и восприимчивостью к другим повреждающим факторам, так что нарушается развитие сердца по крайней мере у одного близнеца. Другая гипотеза настаивает на том, что существует неравное деление массы эмбриональных клеток, что создает заведомо неравный потенциал для развития.
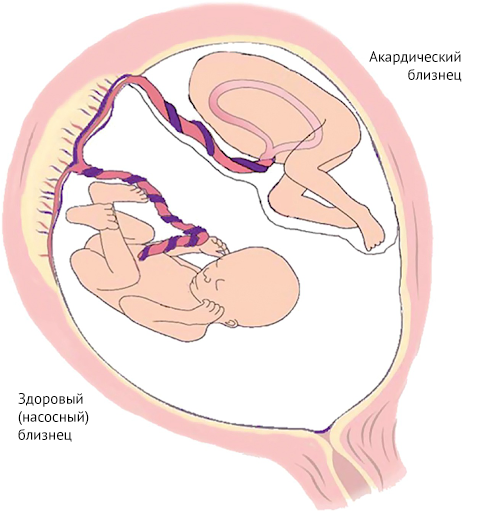
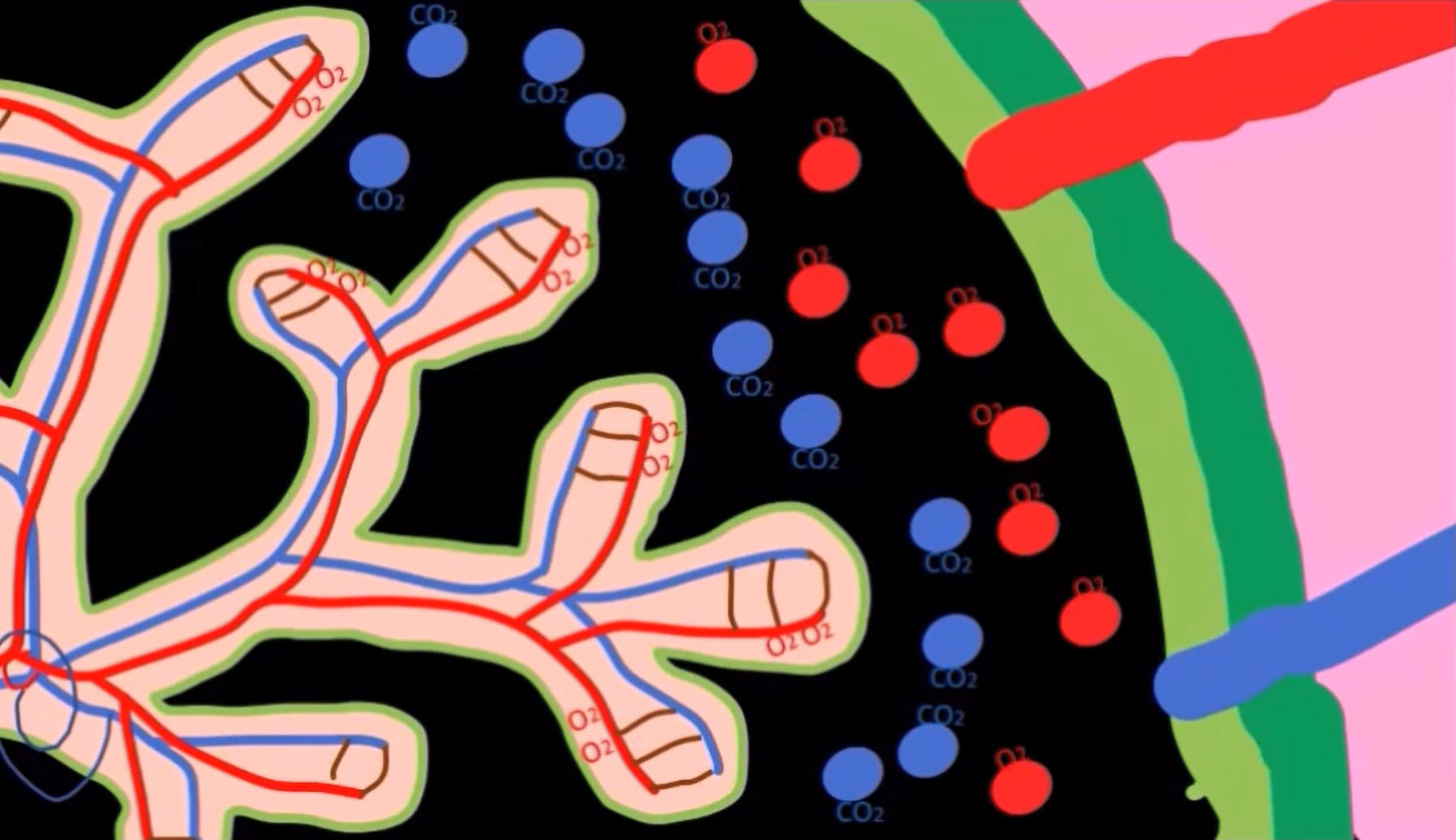
Этиология врожденных пороков сердца у близнецов изучена недостаточно. Можно только сказать, что такие поражения сердца являются следствием гемодинамических аномалий, которые могут возникнуть в результате синдрома фето-фетальной трансфузии (СФФТ), когда из-за общей плаценты монозиготные плоды могут иметь общее кровоснабжение [4]. Несмотря на тот факт, что каждый имеет свое место в плаценте, в ней могут образовываться анастомозирующие сосуды, кровь по которым способна перетекать от одного плода к другому, вызывая диспропорцию в ее объемах. В зависимости от направления тока крови, один из плодов становится «донором», второй — «реципиентом».
Ничего не напоминает? Да, TRAP — это один из вариантов СФФТ, наиболее серьезный. И соответственно работает по тому же принципу, когда один из близнецов — донор, а другой — реципиент. Отличаться будет только жизнеспособность обоих плодов.
Да, именно обоих. Акардический близнец шансов выжить не имеет, независимо ни от чего. Как только близнецы появляются на свет и пуповины перерезают, он жить более не способен. Однако СФФТ и акардия в том числе не просто так находятся в списке ишиопагов. Так как всю работу по перекачке крови за двоих делает лишь один близнец, то это грозит ему сердечной недостаточностью и многоводием [9]. Поэтому для здорового близнеца вероятность умереть составляет около 55 %, что, конечно, добавляет азарта ситуации, но угрожает здоровью матери. Причем риск развития сердечной недостаточности для насосного близнеца растет вместе с акардическим близнецом, который, как правило, превышает размеры своего здорового родственника [10]. Более того, помимо развития сердечной недостаточности у насосного плода может развиться и гипоксия тканей: так как ток крови в акардическим плоде обратный, то дезоксигенированная кровь отводится им через пупочную вену в плаценту, откуда может поступать в кровоток насосного [9]. Поэтому принято проводить хирургическое вмешательство: рассечение анастомозов в первые 16 недель, когда риски для насосного близнеца не так высоки.
▶ Читайте также: Фетальная хирургия врожденных пороков сердца
Что еще более интересно и заслуживает отдельного внимания, так это морфология акардического близнеца, которая способна повлиять на внутриутробную смерть насосного: так, среди наиболее опасных критериев является формирование у акардиуса почек [11, 12]. И стоит объяснить, почему это так.
Так как циркуляция амниотической жидкости сопряжена с мочевыделением и обратным заглатыванием жидкости (трансмембранный путь реабсорбции в работе van Gemert считается незначительной), почки играют решающую роль в этом процессе наряду с глотательным рефлексом. А так как при акардии не развивается головной мозг, то глотательные движения невозможны, что снижает реабсорбцию амниотической жидкости при сохранившемся выделении и приводит к многоводию. И напротив, если почки у акардического плода не развиты, то это может привести к его отеку и увеличению массы, что тоже угрожает здоровому плоду и матери. Согласно данным работам, более дифференцированный вид акардиака несет больше вреда для насосного близнеца.
Заключение
Таким образом, акардиальный плод, словно камикадзе, вредит здоровому близнецу всеми доступными — и довольно ограниченными — способами. И хотя данная патология довольно редка, в наш век развития вспомогательных репродуктивных методик, которые повышают возможность монозиготной многоплодной беременности, не стоит недооценивать риски.
Сегодня акардический плод более не внушает мистический ужас и не связывается больше ни с фазами Луны, ни с гневом бога, ни с тем, что мать ребенка видела казнь. Однако несмотря на развитие науки и наше сегодняшнее понимание патогенеза, все равно остается много белых пятен и спорных вопросов, которые еще не решены.
Так, нет окончательного ответа касательно гипотезы возникновения ретроградной перфузии. И хотя большинство ученых склоняется к версии, что сердце развивается нормально и лишь потом атрофируется из-за ретроградного тока, у второй гипотезы тоже есть большое число сторонников. Генетические факторы до конца не ясны. К тому же нет четкого мнения об этиологии сердечной недостаточности у монозиготных близнецов, что делает сложным окончательное решение данных дилемм.
Источники:
- Morrison JL, Botting KJ, Dyer JL, Williams SJ, Thornburg KL, McMillen IC. Restriction of placental function alters heart development in the sheep fetus. Am J Physiol Regul Integr Comp Physiol. 2007 Jul;293(1):R306-13. doi: 10.1152/ajpregu.00798.2006.
- Roets, E., Havenith, M. G., Klumper, F. J., Arabin, B., & van Eyck, J. (2006). Twin reversed arterial perfusion sequence. European Clinics in Obstetrics and Gynaecology, 2(1), 18–23. doi:10.1007/s11296-006-0023-z
- Obladen, M. (2010). From monster to twin reversed arterial perfusion: a history of acardiac twins. Journal of Perinatal Medicine, 38(3). doi:10.1515/jpm.2010.043
- Gijtenbeek, Manon et al. “Congenital Heart Defects in Monochorionic Twins: A Systematic Review and Meta-Analysis.” Journal of clinical medicine vol. 8,6 902. 24 Jun. 2019, doi:10.3390/jcm8060902
- Manning N. The influence of twinning on cardiac development. Early Hum Dev. 2008 Mar;84(3):173-9. doi: 10.1016/j.earlhumdev.2008.01.009.
- Vitucci, Annachiara et al. “Twin Reversed Arterial Perfusion Sequence: Current Treatment Options.” International journal of women's health vol. 12 435-443. 28 May. 2020, doi:10.2147/IJWH.S214254
- Malcomson, Roger. (2015). Keeling's Fetal and Neonatal Pathology.
- Burton Graham J., Jauniaux Eric. Development of the Human Placenta and Fetal Heart: Synergic or Independent? Frontiers in Physiology, vol. 9, 2018. doi: 10.3389/fphys.2018.00373
- Vitucci, A., Fichera, A., Fratelli, N., Sartori, E., & Prefumo, F. (2020). Twin Reversed Arterial Perfusion Sequence: Current Treatment Options. International journal of women's health, 12, 435–443. doi: 10.2147/IJWH.S214254
- Низяева Н. В., Костюков К. В., Гладкова К. А., Куликова Г. В., Щеголев А. И. Роль синдрома обратной артериальной перфузии близнецов в развитии плода-акардиуса. Архив патологии. 2016;78(4):54-57. doi: 10.17116/patol201678454-57
- van Gemert, M., Nikkels, P., Ross, M. G., & van den Wijngaard, J. (2021). Acardiac twin pregnancies part V: Why does an acardiac twin with renal tissue produce polyhydramnios?. Birth defects research, 113(6), 500–510. doi: 10.1002/bdr2.1874
- Healey, M. G. (1994). Acardia: Predictive risk factors for the co-twin’s survival. Teratology, 50(3), 205–213. doi:10.1002/tera.1420500306
